Введение
Крайне злободневной проблемой абдоминальной хирургии и онкологии следует считать возникновение и развитие послеоперационных моторно-эвакуаторных нарушений (МЭН) вплоть до паралитического илеуса [1]. Во многом причина подобных проблем кроется в развившейся дисмоторике локальных зон отделов пищеварительной трубки, что требует нивелировки за счет активации скоординированного сокращения гладких мышц. Подобный сценарий наиболее характерен для объемных резекционных вмешательств, при которых имеется необходимость выполнения нескольких анастомозов, что изменяет физиологические ритмы моторики кишечника, а при развитии анастомозита может стать механическим препятствие для прохождения химуса [1,2].
В работах математиков и биофизиков, посвященных описанию, моделированию и изучению процессов, протекающих в гибких биологических оболочках (на примере тонкой кишки) выделяются низшие и высшие формы перистальтической активности [3].
К низшим относят различные виды сегментирующих сокращений и ритмической сегментации. Возбуждение, возникающее при формировании в органе одной из низших форм перистальтической активности, не имеет возможности распространяться на большом протяжении и затухает, охватывая только ограниченную часть многослойной стенки органа. Можно утверждать, что главной причиной затухания возбуждения (при его распространении по органу) является ослабление связей между основными элементами его гладкомышечных структур (между волокнами круговых и/или продольных мышц).
К высшим формам перистальтики относят разные виды продольных, поперечных стоячих, бегущих, ударных, уединенных и других видов волн. В основных отделах кишечника их образование характеризуется распространением возбуждения на всю толщу гладкомышечной оболочки органа, с образованием в ней чередования зон из только активных либо только пассивных элементов. При возникновении высших форм перистальтики возбуждение не затухает, а переходит на возбудимые элементы соседних, в данный момент еще пассивных отделов пищеварительной трубки [4].
Современные медикаментозные препараты не способны активизировать ограниченную зону в органе и заставить ее смещаться в заданном направлении. Следовательно, прокинетики воздействуют на мышечные оболочки органов окольными путями [5], что, по-видимому, объясняет их довольно низкую эффективность для больных в критическом состоянии, а также в тяжелых случаях послеоперационных МЭН [2].
Физические принципы моделирования перистальтики
Представленные данные свидетельствуют о том, что нормальной функции гладкомышечных структур кишечника соответствуют только механические волны, бегущие из проксимальных отделов в дистальные, что формирует картину координированных сокращений (моторно-эвакуаторная функция, или «моторика»). Их образуют поперечные волны, перемещающиеся вдоль органа. Волны, бегущие в противоположном направлении (из дистальных отделов в проксимальные отделы кишечника), являются естественной реакцией на сложные многокомпонентные «возмущения» и приводят к инверсии движения химуса. Они могут возникать и при нормальной функции кишечника для смешивания и компоновки пищевого комка, что именуется явлением «антиперистальтики» [6–8].
Стоячие волны служат результатом интерференции двух одинаковых волн, фазы которых сдвинуты относительно друг друга на 180 градусов. При их возникновении эвакуации содержимого кишечника не наблюдается. При реализации ударных волн, полностью перекрывающих просвет в активной зоне органа, происходит быстрая (пропульсивная) эвакуация содержимого из органа, что может сопровождаться диарейным синдромом [6, 7, 9].
Особый интерес с точки зрения возможностей терапевтического воздействия представляют т.н. медленные электрические волны, образующие периодические фазы деполяризации и реполяризации мембран гладкомышечных клеток. Медленные волны возникают с достаточно постоянной для каждого отдела пищеварительного тракта частотой.
Как было показано рядом исследователей, в кишечнике существует проксимально-дистальный градиент частот медленных волн. Иными словами, максимальная частота наблюдается в двенадцатиперстной кишке и в начальном отделе тощей кишки, в дистальном направлении частота волн уменьшается. Электрофизиологически доказано, что возбудимые структуры желудка формируют медленные волны частотой 0,031–0,070 Гц (или 2–4 цикла в минуту), в двенадцатиперстной кишке этот параметр равняется 0,181–0,250 Гц (10–12 циклов в минуту), для тощей кишки он равен 0,13–0,10 Гц (9–12 циклов в минуту), а для подвздошной кишки – 0,071-0,130 Гц (6–8 циклов в минуту). В свою очередь самостоятельная генерация медленных электрических волн в толстой кишке составляет 0,011 Гц, т.е. до 0,6 цикла в минуту. Важно отметить, что частота медленных электрических волн определяет максимально возможную частоту сокращений гладких мышц того или иного органа желудочно-кишечного тракта (ЖКТ). Имеются экспериментальные данные о наличии биоэлектрической активности ЖКТ в межпищеварительный период, включающий фазу относительного покоя и фазу усиленной активности (голодная перистальтическая активность), последовательно сменяющих друг друга [10].
Резонансная электростимуляция (РЭС) основана на использовании низкоамплитудной электростимуляции, проводимой в режиме резонанса, т.е. при приближении частоты внешнего воздействия к частотам, характерным для искомой системы. Таким образом, можно говорить о селективности и избирательности действия.
От структурно-резонансной терапии и других современных способов контактной терапии РЭС отличается крайне низкими значениями тока импульсов, гораздо меньшими значениями частоты основной составляющей стимулирующих импульсов (от 0,02 до 0,5Гц), амплитудно-фазовой характеристикой и спектром гармоник (или формой импульсов).
На основании вышеприведенных данных можно сделать следующее заключение: сигналы, возникающие между любыми участками поверхности организма, обусловлены как биоэлектрической активностью, так и сокращениями органов. Если пренебречь затуханием сигналов в проводящих путях организма, можно утверждать, что мгновенные значения отклонений кривых от изолиний в относительных единицах (мкВ) соответствуют мгновенным значениям функционального состояния внутренних органов. При этом усредненные значения (за 2 минуты записи сигналов от момента выхода кривых на плато) отражают функциональное состояние внутренних органов интегрально.
Место резонансной стимуляции в исследовании и моделировании перистальтики различных отделов ЖКТ
К сожалению, большинство известных электрофизиологических методов, позволяющих получать информацию о моторно-эвакуаторной функции различных отделов ЖКТ [11], имеют ряд существенных недостатков. Все недостатки известных методов можно объяснить рядом общих причин:
- современные комплексы не приспособлены к систематическим исследованиям в палатах интенсивной терапии (регистрация должна осуществляться от 2 до 6 часов, необходим т.н. стандартный завтрак и т.д.);
- графические спектры перистальтической активности без привязки к смежным структурам теряют информативность ввиду отсутствия очередности и последовательности появления гармоник;
- факт выполнения лишь последовательной стимуляции по заранее отведенной программе или эмпирическое изменение условий стимулирующих серий «на глазок».
Технически решаемой проблемой является персонификация процесса электростимуляции пищеварительного тракта при рассматриваемой патологии, что достигается синхронизацией работы всех отделов ЖКТ в процессе одного сеанса, фиксацией изменений в «зонах интереса» с прицельным воздействием на искомый отдел. При этом не стоит забывать, что не всегда имеется полная арефлексия, а чаще какой-то сегмент пищеварительной трубки обладает меньшей пропульсивностью, ввиду чего появляется возможность производить прицельное воздействие на данный участок с максимальным ответом именно скомпрометированной зоны.
На наш взгляд, индивидуальное моделирование колебаний в перманентном режиме с возможностью ежеминутной коррекции позволяет не только за короткий интервал времени выйти на должный уровень пропульсивности, но и избежать форсированного воздействия с быстрым истощением сократительной способности окружающих отделов пищеварительного тракта.
В связи с этим нам видится крайне важным проведение предшествовавшей серии стимулирующих импульсов неинвазивной диагностики моторной функции (посредством графического отображения электрической активности органа) каждого отдела пищеварительного тракта методом «селективной полиграфии» четырех колебательных спектров, например, с использованием селективного электроэнтерогастрографа [патент РФ 2648819]. Применение резонансной терапии в последующем допустимо созданием того или иного варианта стимуляции: в стандартных последовательных режимах или на различные отделы в режимах online-коррекции (индивидуально-корригируемый способ).
Во время проведения сеанса лечения изменения состояния основных отделов ЖКТ нами оценивались не только по росту амплитуды колебаний, но и по форме «огибающей» (рис. 1). Под этим термином понимается воображаемая линия, соединяющая вершины соседних колебаний, расположенных по одну сторону от оси абсцисс, что позволяет оценить эффективность избранного типа электровоздействия.
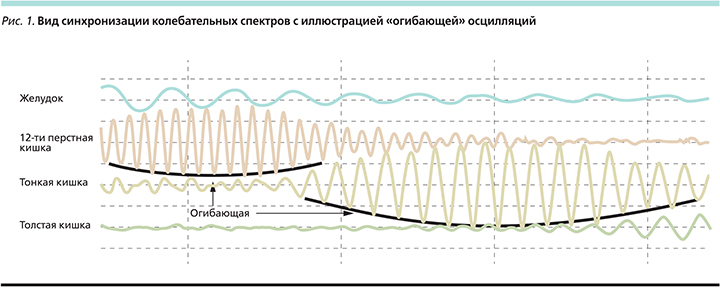
На основании ряда клинико-экспериментальных работ можно провести параллели между характером электрофизиологических данных при использовании РЭС и клиническими проявлениями моторной активности кишечника, что отражено в таблице [10,12–14].

Следовательно, в интегральных электрофизиологических методах биоэлектрические сигналы отображают динамические изменения функционального состояния всех возбужденных зон изучаемого органа (или всего организма при соответствующем положении электродов и широкой полосе регистратора). Сам факт появления биоэлектрических сигналов указывает на электрическую и механическую активность возбудимых структур в органах или их элементов (клеток и волокон). При этом мгновенные значения смещений (и амплитуд) отображают количество двигательных единиц, в это время электрически активных в данной структуре (спайковые потенциалы возбужденной или механически активной зоны органа).
Безусловно на сегодняшний день подобная резонансная терапия имеет широкий ареал применения. Однако важной особенностью современного ведения послеоперационного периода является уход от «монометодик» в пользу содружественного применения нескольких вариантов терапии, что отражается во всех принципах ускоренной реабилитации (fast-track), пропагандируемых в последние годы.
В случае развития тяжелого послеоперационного динамического пареза одним из сценариев видится замыкание порочного круга в виде моно- (энтеральной) или полиорганной дисфункции. Важным этапом следует считать применение гастроинтестинальной декомпрессии и энтерального лаважа, однако изолированно выступить триггером восстановления моторики данный вид терапии не в состоянии.
Нами данный вопрос решается комплексно с интеграцией в лечебный арсенал как лекарственных, так и неинвазивных электрофизиологических методик (резонансной терапии) у пациентов с послеоперационной динамической кишечной непроходимостью.
Одним из сценариев лечебного алгоритма следует считать комплаенс лекарственной и резонансной терапии пациента с МЭН в раннем послеоперационном периоде:
- выполнение электрогастроэнтерографии;
- введение фармпрепарата (серотонина адипинат, дистигмина бромид и т.д.);
- проведение РЭС;
- проведение энтерального лаважа;
- повторение подобной схемы при необходимости до достижения клинического результата.
При разрешении пареза воздействие по описанной схеме прекращают, продолжая стандартную лечебную программу, направленную на лечение и коррекцию основного заболевания (тяжелый острый панкреатит, острая кишечная непроходимость в раннем послеоперационном периоде на фоне распространенного перитонита и т.д.). На данный вариант содружественного применения лекарственной и резонансной терапии получен патент РФ 2655788, и данный метод успешно используется в лечебной работе ряда хирургических клиник [15, 16].
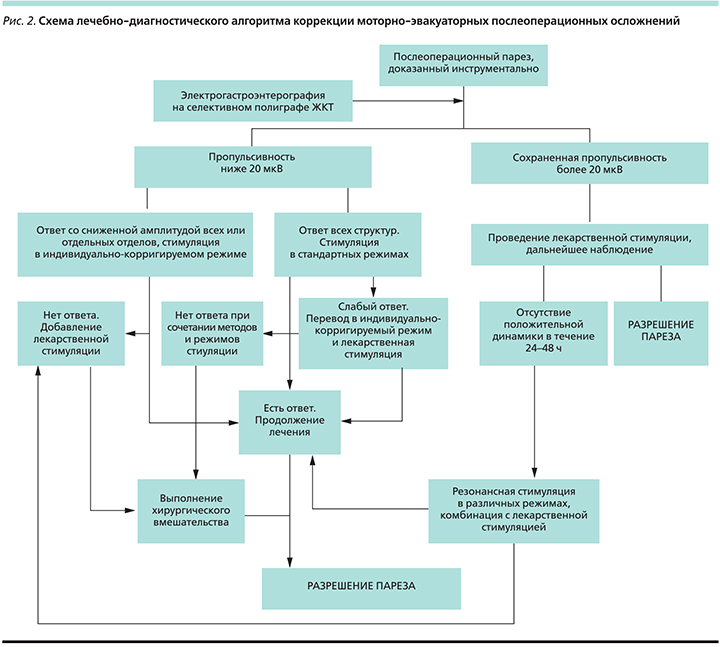
Таким образом, в лечебной практике имеется не только возможность стандартного частотно-импульсного воздействия с моделированием эффекта за счет увеличения/понижения силы тока, но и индивидуально-корригируемая опция, позволяющая работать на т.н. малых токах, а также возможны различные сочетания резонансной терапии с иными методами лекарственной стимуляции перистальтической активности ЖКТ. Вышеприведенную вариативность действий можно графически представить следующим пошаговым алгоритмом (рис. 2). Подобная вариативность позволяет всегда иметь пациент-ориентированную модель стимуляции, что способствует увеличению процента «позитивных» ответов и долю консервативно-разрешенных динамических МЭН.
Заключение
Современная парадигма профилактики и лечения осложнений раннего послеоперационного периода, где существенную позицию сохраняет динамическая кишечная непроходимость, включает мультидисциплинарный и мультимодальный подходы. Последние базируются на принципе исключения монометодического воздействия без четких критериев эффективности, а также предполагает активное использование средств и методов неинвазивной природы или с минимальной степенью инвазивности (установка зондов для декомпрессии или лаважа).


