Биотерапия нейроэндокринных опухолей
Аналоги соматостатина (АСС). АСС играют ключевую роль в лечении диссеминированных высокодифференцированных нейроэндокринных опухолей (НЭО), как функционирующих, так и нефункционирующих. Воздействуя на рецепторы соматостатина, они ингибируют гормональную активность НЭО и оказывают прямое антипролиферативное действие, увеличивая медиану времени до прогрессирования.
В настоящее время считается, что антипролиферативный эффект осуществляется путем связывания с рецепторами соматостатина и с системным воздействием, что приводит к угнетению таких клеточных функций, как секреция, подвижность и пролиферация [1, 2].
Всего выделено пять подтипов соматостатиновых рецепторов. Рецепторы соматостатина представлены и в первичных опухолях, и в их метастазах. Биологические эффекты АСС связаны с их сродством к определенному типу рецепторов. Торможение секреции связано с соматостатиновыми рецепторами второго типа (SSTR2). Сродством к этому типу рецепторов обладают все синтетические АСС, применяемые в настоящее время.
На основании анализа 35 825 случаев НЭО желудочно-кишечного тракта (ЖКТ), найденных в регистрах базы данных SEER (США), выживаемость пациентов достоверно улучшилась в период с 1988 по 2004 г., когда АСС (октреотид) был введен в клиническую практику, по сравнению с 1973–1987 гг. до внедрения октреотида.
В России используются пролонгированные АСС: октреотид (Сандостатин ЛАР™, Новартис), Октреотид Депо™, Фарм-Синтез), Октреотид Лонг™, Натива) и ланреотид (Соматулин Аутожель™, Ипсен), эффективные для купирования симптомов, а также обладающие антипролиферативной активностью в высоких дозах. Октреотид и ланреотид различаются по структуре и аналогами друг другу не являются. Так, при непереносимости одного препарата он может быть заменен на другой.
АСС для контроля карциноидного синдрома. АСС являются терапией 1-й линии при функционально активных НЭО, включая опухоли с проявлениями карциноидного синдрома и других функционально активных НЭО поджелудочной железы – ПЖ (например, випома и глюкагонома).
Препараты пролонгированного действия (Октреотид Депо, Октреотид Лонг 20–30 мг внутримышечно 1 раз в 28 дней), ланреотид (Соматулин Аутожель 120 мг глубоко подкожно 1 раз в 28 дней) используются в течение длительного времени при успешном контроле симптомов, вызванных гиперсекрецией функционально активных НЭО. Рекомендуется начинать терапию АСС короткого действия октреотидом 50–100 мкг в течение 7–10 дней 2–3 раза в сутки [3–5], особенно пациентам с выраженными симптомами.
В случае недостаточного контроля симптомов предусмотрена эскалация дозы пролонгированных АСС выше стандартных [6, 7]. Кроме того, эскалация дозы АСС может осуществляться путем сокращения интервала с 4 до 3 недель.
АСС для контроля роста опухоли. АСС показали свою антипролиферативную активность при НЭО на основе двух плацебо-контролируемых исследований. Октреотид ЛАР в исследовании PROMID – НЭО производных средней кишки (midgut) G1 и ланреотид Аутожель в исследовании CLARINET – НЭО ЖКТ и ПЖ G1/G2, Ki-67<10% [9].
Октреотид ЛАР, Октреотид Депо, Октреотид Лонг и ланреотид Аутожель рекомендуются в качестве 1-й линии системной терапии при высокодифференцированных НЭО для контроля роста опухоли [8, 9]. Согласно рекомендациям ENETS (European Neuroendocrine Tumor Society), АСС можно использовать в качестве 1-й линии системной терапии при НЭО G1 и G2 (Ki-67<10%) длительно – при сохранении стабилизации процесса и под контролем переносимости. По результатам исследования CLARINET OLE, назначение ланреотида Аутожель больным энтеропанкреатическими высокодифференцированными НЭО значительно увеличивает медиану выживаемости без прогрессирования.
Согласно рекомендациям ENETS, АСС должны быть назначены на момент постановки диагноза в случаях массивного поражения печени и значительной распространенности опухоли как неблагоприятных прогностических факторов. После прогрессирования болезни на АСС их использование целесообразно продолжить для подавления функциональной активности опухоли (при наличии симптомов), более того, доза препарата должна быть повышена для возобновления его эффективности (пролонгированный октреотид – до 40–60 мг последовательно), для ланреотида целесообразно уменьшение интервала между введениями до 21 дня.
Назначение АСС может быть рассмотрено в случае отрицательного результата на экспрессию рецепторов соматостатина (SSTR), если опухоль небольшого размера и велика вероятность ложноотрицательного результата (по результатам сцинтиграфии рецепторов соматостатина).
Интерферон α. Интерферон (ИФН) используется для лечения больных карциноидным синдромом более 30 лет. Обоснованием иммунной терапии служит способность ИФН-α стимулировать NK-клетки, а также с прямым антиангиогенным эффектом. Исследования показали, что ИФН способны стимулировать функцию натуральных клеток-киллеров, вызывать интратуморальный фиброз, ингибировать синтез белков и гормонов, блокировать клеточное деление в G1- и S-фазах клеточного цикла, влиять на ангиогенез за счет ингибирования VEGF [10]. Впервые K. Oberg в 1982 г. начал исследование эффективности ИФН при НЭО ЖКТ и получил объективный эффект для 15% больных. Анализ сводных данных лечения 383 больных ИФН-α продемонстрировал следующие результаты: симптоматический эффект наблюдался в 40–60% случаев, биохимический ответ – в 30–60%, стабилизация опухоли (более 36 месяцев) – у 40–60% больных, редукция опухоли – у 10–15%. Доза ИФН колебалась от 3 до 9 МЕ 3 раза в неделю. Корреляции между дозой и объективным эффектом не отмечено, использование высоких доз не привело к улучшению результатов. Медиана выживаемости составила 20 месяцев. [11]. По данным К. Oberg, комбинация ИФН с химиотерапией (ХТ) не улучшила результатов лечения [12].
ИФН-α является терапией 2-й линии в лечении функционально активных НЭО. Рекомендуется использовать ИФН-α как добавление к терапии АСС при недостаточном контроле симптомов функционирующих опухолей. Кроме того, ИФН-α могут использоваться в качестве терапии 1-й линии в отсутствие экспрессии SSTR. Рекомендуемая доза ИФН-α 3 млн МЕ 3–5 раз в неделю подкожно [4, 13]. В отношении пациентов, которые не переносят стандартный режим введения, альтернативно может быть использован пегилированный ИФН-α (50–180 мкг/нед подкожно) [12]. ИФН-α обладают антипролиферативным действием и могут быть рассмотрены в качестве антипролиферативной терапии.
ИФН-α был изучен в сравнении с бевацизумабом в большом рандомизированном исследовании (n=400) больных НЭО различных локализаций G1/2 с прогрессированием заболевания или другими плохими прогностическими признаками, одновременно получавших октреотид ЛАР (исследование SWOG). Медиана времени до прогрессирования не различалась между ИФН-α и бевацизумабом [13]. Это исследование подтверждает антипролиферативную активность ИФН-α.
Эффективность ИФН-α подтверждена в терапии карциноидного синдрома и в первую очередь используется в качестве 2-й линии лечения или добавления к терапии АСС в случае недостаточного контроля карциноидного синдрома при функционирующих НЭО ПЖ.
Таргетные препараты при лечении высокодифференцированных НЭО
В течение последних 5 лет в клиническую практику введены таргетные препараты для высокодифференцированных НЭО G1 и G2 (NEN) (не карцином NEC). Это мультикиназный ингибитор сунитиниб и m-TOR ингибитор эверолимус. Продолжается изучение VEGFR блокатора бевацизумаба.
Эверолимус рекомендован для различных НЭО, сунитиниб – только для НЭО ПЖ.
Сунитиниб (Сутент) – мультитаргетный тирозинкиназный ингибитор (VEGFR, PDGFR), зарегистрирован на основании результатов плацебо-контролируемого исследования III фазы 171 больного НЭО ПЖ [14]. Медиана выживаемости без прогрессирования в группе с сунитинибом была 11,4 месяца по сравнению с плацебо – 5,5 месяца. Объективный эффект в группе сунитиниба составил 9,3%, плацебо – 0%. Контроль роста опухоли (частичный эффект+стабилизация) – 70%.
Сунитиниб может использоваться при диссеминированных НЭО ПЖ G1–G2 после АСС или при невозможности проведения ХТ или в отсутствие рецепторов к соматостатину [15]. Сунитиниб применяется в режиме 37,5 мг/сут длительно внутрь в 1-й линии лечения. Используются таблетки 25,0 и 12,5 мг. При развитии токсичности доза может быть уменьшена до 25 мг/сут.
Наиболее часто отмечаемые побочные эффекты: диарея, тошнота, рвота, астения, усталость от лечения.
Эверолимус (Афинитор), m-TOR ингибитор, также изучали в плацебо-контролируемых исследованиях (RADIANT 1–4) больных НЭО G1–G2 различных локализаций: ЖКТ, ПЖ, легкие и др. [16]. Препарат может быть использован во 2–3-й линиях лечения диссеминированных больных, а также в 1-й линии лечения в отсутствие рецепторов к соматостатину или невозможности проведения ХТ. С учетом токсичности, возможности развития сахарного диабета и пульмонита в редких случаях противопоказаниями к использованию эверолимуса могут быть неконтролируемый диабет или сопутствующие заболевания легких.
У больных НЭО ЖКТ (производные средней кишки midgut) эверолимус вызывает контроль роста опухоли в 75% (плацебо – 45%) и выживаемость без прогрессирования – 16,4 месяца (плацебо – 11,3 месяца).
При НЭО ПЖ эверолимус эффективен в 72% (плацебо – 25,9%) и выживаемость без прогрессирования – 11, 4 месяца (плацебо – 5,4 месяца).
В исследовании RADIANT-4 доказана эффективность эверолимуса для больных высокодифференцированными нефункционирующими НЭО легких и ЖКТ. Выживаемость без прогрессирования в группе с эверолимусом – 11 месяцев, плацебо – 3,9.
Эверолимус используется в режиме 10 мг/сут длительно внутрь, при развитии токсичности может использоваться доза 5 мг/сут. Лечение проводится до прогрессирования или непереносимой токсичности.
Пока нет достаточных данных по использованию других таргетных препаратов, таких как бевацизумаб, сорафениб, пазопаниб или акситиниб, при НЭО ПЖ или др. Результаты рандомизированного исследования сунитиниба при НЭО из средней кишки (midgut) пока не оценены.
При функционирующих НЭО стандартной практикой служит комбинация таргетных препаратов и АСС, т.к. эти больные нуждаются не только в контроле роста опухоли, но и в купировании карциноидного или других синдромов. Представляется целесообразным использование комбинации таргетных препаратов и АСС при нефункционирующих НЭО при наличии соматостатиновых рецепторов, однако пока отсутствуют сравнительные исследования, подтверждающие это [17].
При НЭО легких эверолимус может использоваться в 1-й линии лечения независимо от АСС (например, при карциноиде при маленьком уровне экспрессии рецепторов к соматостатину) [18].
Химиотерапия НЭО
НЭО нельзя назвать чувствительными к ХТ. Тем не менее в последние годы лекарственная терапия НЭО активно развивается.
Алгоритм выбора лечения зависит от типа опухоли и ориентирован на классификации ВОЗ и рекомендации ENETS.
Применение ХТ при НЭО ЖКТ и ПЖ G1 в 1-й линии не рекомендуется, за исключением случаев отсутствия эффекта от предшествовавшего лечения (АСС, иммунотерапия, таргетная терапия) или при быстром прогрессировании. При НЭО G2 применение ХТ в 1-й линии±АСС рекомендовано при значительной массе опухоли и наличии карциноидного синдрома. Рекомендуется использовать режимы, не содержащие цисплатин и карбоплатин. ХТ при НЭО G3 служит основным способом лечения.
Основные режимы лекарственной терапии представлены в табл. 1.

Применение ХТ при НЭО легких и тимуса
Применение ХТ при НЭО легких и тимуса G1 в 1-й линии терапии не рекомендуется, за исключением случаев отсутствия эффекта от предшествовавшего лечения (АСС, иммунотерапия, таргетная терапия) или при быстром прогрессировании. При НЭО G2 применение ХТ (±АСС) в 1-й линии рекомендуется при значительной массе опухоли и наличии карциноидного синдрома.
Основные режимы лекарственной терапии для НЭО легких и тимуса G2 представлены в табл. 2.
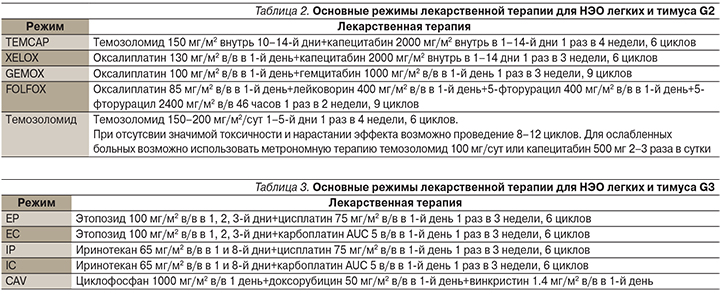
При НЭО G3 основным способом лечения является ХТ, предпочтительными режимами 1-й линии – комбинации EP или EC.
Основные режимы лекарственной терапии для НЭО легких и тимуса G3 представлены в табл. 3.
Таким образом, своевременная постановка диагноза и индивидуализированный подход к лечению остаются основным условием эффективного лечения.



