Введение
Гистологическая дифференцировка кератоакантомы (КА) и плоскоклеточного рака (ПКР) кожи сложна, а механизмы их различного биологического потенциала изучены недостаточно.
КА – это эпителиальное новообразование кожи, которое характеризуется циклическим течением (имеет в своем развитии стадии роста, стабилизации и регресса), в одних случаях спонтанно инволюцирует в сроки до 3 месяцев от начала заболевания (типичная КА), в других – длительно персистирует, достигает гигантских размеров (более 2 см в диаметре), рецидивирует, часто трансформируется в рак (атипичная КА) [2–4, 10]. Непредсказуемое клиническое течение КА наряду с трудностью, а зачастую и невозможностью ее дифференцировки с ПКР кожи [2, 5] обусловливает актуальность поиска новых и совершенствования старых методов верификации КА. В период активного роста отличить КА от ПКР кожи особенно трудно, поэтому особый интерес представляет сравнительный анализ пролиферативной активности клеток КА и ПКР кожи [6, 7, 9].
Антиген Ki-67 представляет собой ядерный белок, экспрессия которого строго связана с пролиферацией клеток. Определение экспрессии применяют для количественной оценки активности роста опухолевых клеток в различных опухолях человека. Минимально выраженная экспрессия Ki-67 наблюдается в ядрах пролиферирующих клеток в фазе G1 клеточного цикла и после митоза, максимальная – в середине клеточного цикла. По экспрессии Ki-67 можно идентифицировать клетки, находящиеся во всех фазах клеточного цикла (G1,S,G2 и M), кроме фазы покоя G0 [1, 3, 5, 8].
Цель исследования: выявить различия пролиферативной активности клеток кератоакантомы и плоскоклеточного рака кожи на основе сравнительного анализа экспрессии маркера клеточной пролиферации Ki-67 в кератоакантоме и плоскоклеточном раке кожи.
Методы
Были обследованы 44 пациента с атипичными КА, у которых были диагностированы следующие клинические формы этой опухоли: у 12 (27,3%) – стойкие, у 17 (38,6%) – гигантские, у 2 (4,6%) – центробежные, у 2 (4,6%) – мультинодулярные, у 1 (2,3%) – грибовидная, у 4 (9,1%) – в форме кожного рога, у 6 (13,6%) – рецидивные, в т.ч. в одном случае КА при синдроме Мюир–Торре. Соотношение мужчин и женщин равнялось 1,2:1 (мужчин 24 – 54,5%, женщин 20 – 45,5%). Возраст пациентов варьировался в пределах 22–89 лет, средний возраст – 59,98±1,4 года. В исследование также были включены 20 пациентов с инфильтративно-язвенной формой ПКР кожи T1N0M0, из которых мужчин было 18 (60%), женщин 12 (40%) при соотношении мужчины:женщины – 2,1:1.
КА в 95,5% случаев возникала на фоне здоровой кожи, лишь у 1 пациента КА возникла на фоне предшествовавшего красного плоского лишая и у 1 – на фоне базалиомы. Атипичные КА локализовались преимущественно на открытых участках кожного покрова – у 35 (79,5%) пациентов, как правило, на лице (табл. 1).
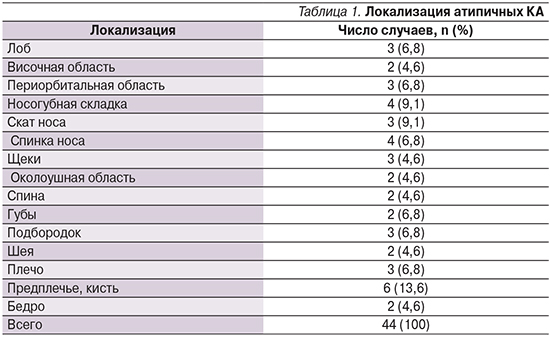
Из 44 пациентов с атипичными КА у 27 предварительно была произведена краевая диагностическая биопсия, у 17 опухоли были удалены полностью, что позволило провести их полноценное гистологическое исследование.
Биопсия кожи и первичная обработка биопсийного материала проведены под местной анестезией 0,5%-ным раствором новокаина, брали биоптат диаметром 0,4×0,6 см.
Морфологический анализ включил гистологический и иммуногистохимический (ИГХ) методы исследования. Материал фиксировали в 10%-ном растворе формалина, затем залили в парафин по обычной методике. Готовили срезы толщиной 3–5 мкм, депарафинировали по стандартной схеме и окрашивали гематоксилином и эозином. Для ИГХ исследования серийные срезы толщиной 3–5 мкм наносили на предметные стекла с адгезивным покрытием, депарафинирование срезов и восстановление антигенности проводили в буфере рН 9.0 в PT Module (Thermo Scientific, Великобритания). ИГХ-реакцию проводили с использованием автоматических систем Ventana Benech Ultra (Roche) или Lab Vision, тип 480s (Великобритания) по стандартным протоколам, в отдельных случаях (при малом объеме материала в диагностических биопсиях) – ручным методом. Использовали маркер к антигену ядер пролиферирующих клеток Ki-67 (клон MIB1, DAKO), его экспрессию оценивали количественно с подсчетом индекса пролиферации как % меченых клеток из расчета на 100 опухолевых (при учете 1000–2000 клеток) или оценивали характер распределения меченых ядер по плоскости среза. Подсчет меченых ядер проводился в репрезентативных полях зрения (РПЗ).
Дифференциальная диагностика КА и ПКР включила исследование выраженности и диагностической информативности следующих патоморфологических признаков: 1) клеточного полиморфизма, 2) атипии ядер, 3) инвазии акантотических тяжей, 4) инвазии отшнурованных эпидермальных комплексов, 5) частоты митозов, 6) наличия патологических митозов, 7) наличия зоны дисплазии эпидермиса по периферии опухоли, 8) степени выраженности рогового кратера («чаши»), 9) формирования и распада роговых жемчужин, 10) ороговения отдельных клеток, 11) наличия апоптотических телец, 12) выраженности воспалительного инфильтрата в дерме и 13) его состава (эозинофилы, плазматические клетки, лимфоциты, сегментоядерные лейкоциты), 14) инфильтрации лейкоцитами эпидермальных комплексов, 15) акантолиза, 16) очагов некроза.
Оценку выраженности каждого признака проводили полуколичественным методом [+, ++, +++]. Митотическую активность определяли по количеству фигур митоза в 10 РПЗ при большем увеличении (×400). Число митозов <10 в 10 РПЗ оценивали как [+], 10–20 как [++] и >20 как [+++]. Частоту патологических митозов выражали в % к общему числу учтенных митозов: <10% – [+], <30% – [++], 30% и более – [+++].
Результаты исследования
Гистологическое исследование. При сравнительном полуколичественном анализе ряда гистологических и цитологических признаков в 44 случаях атипичных КА и 20 – ПКР кожи была установлена их слабая информативность для проведения дифференциального диагноза. Частота и степень выраженности формирования и распада роговых жемчужин, наличие апоптотических телец, ороговения отдельных клеток, воспалительного инфильтрата, инфильтрации лейкоцитами эпидермальных комплексов в различных формах атипичных КА по степени выраженности практически не различались. Клеточный полиморфизм, укрупнение ядер, инвазия акантотических тяжей, митотическая активность и патологические митозы регистрировались при всех формах атипичных КА, однако их максимальная выраженность отмечена среди рецидивных и стойких КА.
Клеточный полиморфизм определен в КА и ПКР кожи в 77,3 и 95,0% случаев, атипия ядер – в 79,5 и в 95,0%, митозы определялись в 56,8 и 85,0% случаев соответственно, что не является достоверным различием, но повышенная митотическая активность [+++] определялась в 30% случаев ПКР и только в 6,8% случаев КА. Патологические митозы определены в КА и ПКР кожи в 40,9 и 70,0% случаев соответственно. Инвазивный рост акантотических тяжей эпидермиса определен в 84,1% случаев атипичных КА. Атипическое ороговение с образованием «жемчужин», характерное, как полагают, для ПКР, в нашем исследовании встретилось в 80,0% случаев ПКР и 77,3% – атипичных КА. Распад роговых жемчужин определялся в КА достоверно реже, чем в ПК, – в 20,5 и в 70,0% случаев соответственно, хотя наиболее выраженным этот патоморфологический признак (интенсивностью 3+) отмечен только в 6,8% случаев КА. Ороговение отдельных клеток определено в КА и ПКР кожи в 52,3 и 70,0% случаев соответственно, что не является достоверным различием. Апоптотические тельца обнаруживались в 93,2% случаев КА и в 80,0% – ПКР кожи. Выраженность и состав воспалительного инфильтрата – это признак, который рассматривался некоторыми исследователями как информативный в плане дифференциальной диагностики КА и ПКР кожи. Такой инфильтрат определен в 52,3% случаев КА и в 70,0% случаев ПКР кожи. Инфильтрация эпидермальных комплексов лейкоцитами определена в КА и ПКР кожи в 63,6 и 75,0% случаев соответственно. Зона дисплазии эпидермиса по периферии опухоли встречалась в незначительном количестве случаев как в КА (9,1%), так и в ПКР кожи (20,0%). Акантолиз встретился в 15,9% случаев КА и в 30% случаев ПКР [+]. Некроз опухолевых клеток отмечен только при ПКР, но всего в 15% случаев. Считать этот признак надежным дифференциально диагностическим критерием КА и ПКР кожи нельзя, т.к. в подавляющем большинстве случаев раннего рака некротические изменения отсутствуют (табл. 2).
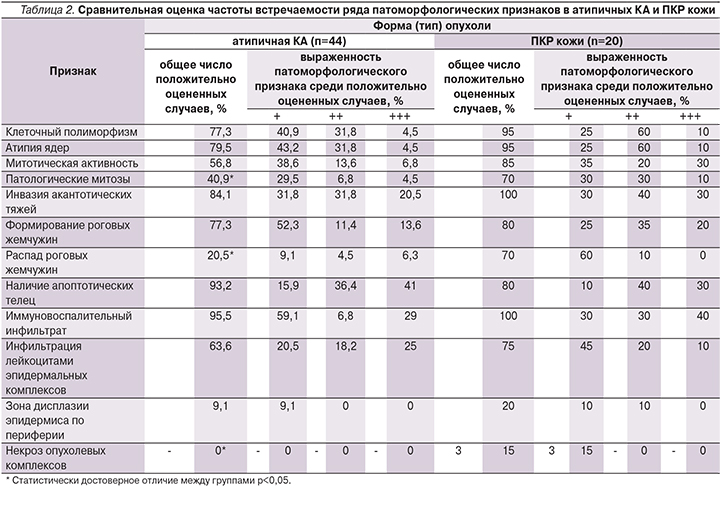
Сравнительное гистологическое исследование биоптатов КА и ПКР кожи показало, что обнаруженные нами различия между атипичной КА и ПКР кожи не убедительны. Достоверно реже по суммарным значениям в атипичных КА встречались патологические митозы, распад роговых жемчужин, акантолиз и в них полностью отсутствовали очаги некроза опухолевых клеток. Ни один из учтенных признаков не может быть признан достаточно информативным, для того чтобы на гистологическом уровне провести окончательный дифференциальный диагноз между атипичной КА и ПКР кожи и который мог бы стать четким диагностическим критерием лишь для одного из этих типов опухолей.
ИГХ-исследование. При ИГХ-исследовании с использованием маркера ядер пролиферирующих клеток Ki-67 биоптаты КА и ПКР были подразделены на следующие три группы: 1) операционные биоптаты 14 КА, удаленных радикально, когда диагноз был установлен на основании характерной гистологии; 2) биоптаты 16 КА, удаленных секторально, наиболее близкие по строению к ПКР; 3) биоптаты 20 ПКР кожи. Контролем служили фрагменты здоровой кожи 3 пациентов (в возрасте от 45 до 65 лет), полученные при пластических операциях в отделении челюстно-лицевой хирургии МОНИКИ.
В ткани здоровой кожи отмечено специфическое окрашивание Ki-67 ядер клеток базального слоя эпидермиса; индекс Ki-67 составил 15,33±2,4, что было достоверно ниже такового пролиферации в КА. Индекс пролиферации Ki-67, который рассчитывался по всей площади среза справа налево и сверху вниз, в КА 1-й и 2-й групп не имел существенных отличий от ПКР кожи (табл. 3).

Однако имели место существенные различия в распределении окрашенных ядер: в КА этот маркер экспрессировали ядра клеток базального слоя бородавчато-акантотических разрастаний эпидермиса, в то время как в ПКР кожи специфически окрашенные ядра клеток распределялись неравномерно, диффузно и во всех участках опухоли – и по периферии, и в центральных отделах (рис. 1, Б, Г).
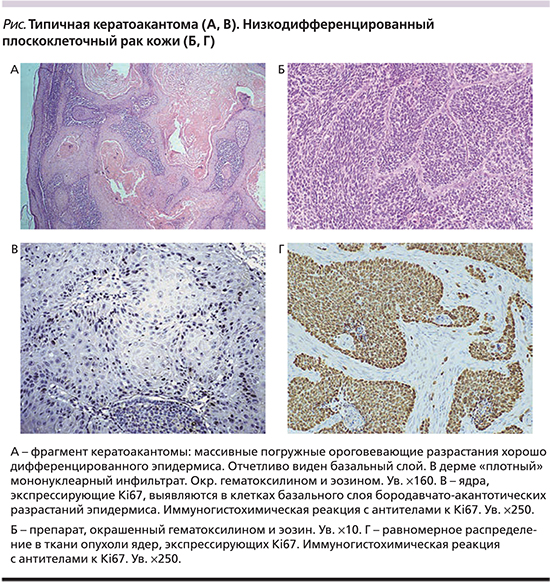
В 25 атипичных КА экспрессия Ki-67 имела базальное распределение, в 5 было выявлено диффузное распределение окрашенных ядер (рис. 1, А, В). Анализ этих пяти клинических наблюдений показал, что это были рецидивные КА, в двух из которых присутсивовали клинические и морфологические признаки трансформации КА в ПКР кожи.
Таким образом, по значению индекса Ki-67, который определялся как средний процент при учете меченых ядер во всем срезе тканевого образца, в КА и ПКР кожи статистически значимых различий не было выявлено. Однако эти два типа опухолей достоверно различались по особенностям распределения в них меченых Ki-67 ядер опухолевых клеток: в случае КА оно было базальным, в случае ПКР – диффузным и неравномерным. Важно отметить, что в случае атипичных КА с признаками трансформации в ПКР распределение меченых ядер также было неравномерным. Поэтому в случае КА неравномерное распределение ядер, меченных Ki-67, можно считать фактором неблагоприятного прогноза.
Обсуждение
Хорошо известно, что дифференцировка КА и ПКР на гистологическом уровне сложна, а надежные тканевые иммуногистохимические маркеры для этих типов опухолей отсутствуют, поэтому поиск и изучение спектра маркеров более специфических для этих двух типов опухолей остаются актуальной проблемой. Для решения этой задачи I.C. Watanabe et al. (2015) с помощью CD105 и CD34 оценивали плотность микрососудов в КА и ПКР, а также экспрессию в них маркера пролиферации Ki-67. Авторы показали, что индекс Ki-67 в ПКР был существенно выше, чем в КА, а в КА формировалось больше новых сосудов (неоваскуляризация), что свидетельствует о различии в патогенезе этих двух типов опухолей кожи. Значение определения индекса пролиферации Кi-67 для диагностики КА и ПКР кожи подтверждено и другими авторами (A. Basta-Juzbašiæ et al., 2004; М. Connolly et al., 2008; N. Scola et al., 2014). A. Basta-Juzbašiæ et al. (2004) показали, что в КА наблюдали более интенсивную экспрессию цитокератина 10 и более низкий индекс Ki-67, чем в ПКР. Однако полученные нами данные свидетельствуют о том, что индекс Ki-67, который по стандартам определяется по всей площади среза опухоли, не может отражать истинную разницу в пролиферативной активности клеток КА и ПКР, поскольку распределение меченых ядер в этих двух типах опухоли существенно различается. Именно особенности распределения меченых ядер позволяют не только отличить КА и ПКР кожи, но и выделить из КА группу повышенного риска трансформации в ПКР.
Выводы
Особенности распределения в КА и ПКР ядер, экспрессирующих Ki-67, имеет большое диагностическое значение для проведения дифференциального диагноза между этими двумя типами опухолей кожи.


