Введение
Неходжкинские лимфомы (НХЛ) – гетерогенная группа лимфопролиферативных заболеваний кроветворной системы, характеризующихся разнообразием морфоиммунологических вариантов, в детском возрасте отличающихся высокоагрессивным течением с быстрой диссеминацией, поражением костного мозга и центральной нервной системы [1]. Эта группа нозологий составляет до 12% всех злокачественных опухолей у детей [2], занимая третье место в структуре онкологической заболеваемости среди детей [3]. Заболеваемость в детской возрастной группе составляет 11,5 случаев на 100 тыс. человек в год [3]. Возрастным пиком диагностирования заболевания является период от 5 до 9 лет [3]. Возможна локализация в лимфатических узлах, часты случаи экстранодальных лимфом с источником в лимфоидной ткани слизистой оболочки желудочно-кишечного тракта, бронхов, мочевыводящих путей. В том случае, если в костном мозге обнаружено более 25% опухолевых клеток, диагностируется острый лейкоз [4].
В структуре детской заболеваемости в этой обширной группе лидируют следующие морфологические варианты [5]:
- лимфома Беркитта составляет 38–43% всех НХЛ;
- Т- (Т-ЛЛ) и В-лимфобластные (В-ЛЛ) лимфомы – 29%;
- диффузная В-крупноклеточная лимфома (ДВККЛ) – 13%;
- анапластическая крупноклеточная лимфома (АККЛ) – 10–15%;
- медиастинальная В-крупноклеточная лимфома (МВККЛ) – 4%.
Наиболее агрессивным течением характеризуется лимфома Беркитта, фракция пролиферирующих клеток у нее максимальная (Ki-67 около 100%) [6]. Однако высокая пролиферативная активность определяет и хорошую чувствительность к цитостатической терапии.
Этиология
В преобладающем большинстве случаев этиология НХЛ остается неизвестной. Установлено, что мутации, возникающие в пораженной клетке, формируются на фоне активации протоонкогенов (MYC, BCL-2, BCL-6, PIM-1, PAX-5) и инактивации антионкогенов (p16INK4a, P53, P27KIP1) [7]. Убедительно не доказано, однако сообщается о возможном воздействии факторов окружающей среды [8].
К ним относятся химические (гербициды, хлорофенолы, химиотерапия в анамнезе); физические (радиация, лучевая терапия в анамнезе). Также сообщается о влиянии иммунодефицитных состояний (синдромы Дауна, Клайнфельтера, Луи–Бар, ВИЧ), аутоиммунных заболеваний (ревматоидный артрит, системная красная волчанка, синдром Шегрена), инфекционных заболеваний (инфекционный мононуклеоз) [9].
Клиническая картина
Клиническая картина НХЛ у детей развивается быстро. Как правило, первоначальные симптомы определяются локализацией опухоли. При наличии образований в средостении (в частности, при лимфобластной лимфоме) могут наблюдаться респираторные нарушения, кашель и дыхательная недостаточность с плевритом, дисфагия, экссудативный перикардит, признаки сдавления верхней полой вены [10]. Расстройства желудочно-кишечного тракта, картина острого живота, асцит – так зачастую разворачивается клиническая картина В-зрелоклеточных опухолей, при этом можно выявить гепатоспленомегалию, при большом объеме опухоль может быть обнаружена при пальпации [11]. При вовлечении яичников может также наблюдаться картина острого живота. Ввиду быстрой диссеминации процесса наряду с любой из вышеперечисленных картин и отдельно от них возможно развитие симптомокомплекса поражения центральной нервной системы, при прорастании в эпидуральное пространство – сдавление спинного мозга [12]. Часто на фоне диссеминации заболевания поражаются яички, однако возможно и их первичное поражение [13]. Вовлеченные в процесс лимфатические узлы увеличены, безболезненные, плотные, асимметричные, могут сливаться в конгломераты. При применении антибактериальной терапии положительной динамики не отмечается. Геморрагический и болевой синдромы могут быть выявлены при любой локализации опухоли.
Для пациентов с НХЛ также характерны общие симптомы. Выраженность их вариабельна и зависит от степени распространенности заболевания, длительности течения. На фоне интоксикации отмечается снижение аппетита, вялость. Заболевание может сопровождаться лихорадкой, потерей массы тела [1]. Однако эти симптомы редко выходят на первый план, определяющими в клинической картине заболевания считаются проявления, связанные с локализацией опухоли.
Диагностика
Первичный осмотр включает сбор жалоб, анамнеза, физикальный осмотр.
Проводится оценка лабораторных данных: клинический (оценка формулы крови, особое внимание обращают на тромбоциты – при их числе менее 30 тыс./мкл необходима заместительная терапия перед инвазивными вмешательствами) и биохимический (оценка функций печени, почек, активности лактатдегидрогеназы, содержания мочевой кислоты, электролитов) анализы крови, коагулограмма (фибриноген, протромбиновый индекс, тромбиновое время, активированное частичное тромбиновое время, XIIа-зависимый фибринолиз), анализ мочи и оценка диуреза, определение группы крови и Rh-фактора, сывороточных иммуноглобулинов, маркеров вирусных инфекций.
При поступлении производится пункция костного мозга из 2–4 точек для следующих исследований:
- миелограмма;
- цитологическое исследование;
- иммунофенотипирование (при вовлечении костного мозга).
Помимо этого выполняется люмбальная пункция для цитологического и биохимического исследований. Следует учитывать, что анализ спинномозговой жидкости должен проводиться только при атравматичной пункции [1].
Обязательные инструментальные исследования направлены на поиск основного образования, выявление метастазов, оценку распространенности процесса и осложнений.
К ним относятся:
- ультразвуковое исследование (УЗИ) органов брюшной полости, малого таза, периферических лимфатических узлов, яичек;
- рентгенологическое исследование органов грудной клетки;
- компьютерная томография органов грудной клетки, брюшной полости, малого таза;
- магнитно-резонансная томография головного/спинного мозга (применяется при наличии неврологической симптоматики или опухоли в области головы, шеи);
- сканирование с технецием (может быть выполнено при подозрении на поражение костей скелета).
Для получения опухолевого субстрата может быть произведена биопсия образования, эксцизионная биопсия пораженного лимфатического узла; кроме того, цитологический материал можно изготовить из асцитической жидкости или экссудата плевральной полости, пунктата костного мозга. Препарат направляют на цитологическое и гистологическое исследования, проводится иммуногистохимический анализ.
Для определения типа опухоли и выбора тактики лечения следует изучить иммунологические и молекулярно-генетические характеристики опухоли. Для НХЛ наиболее характерны реципрокные транслокации; численные изменения кариотипа и образование изохромосом встречаются реже [14].
Основные генетические и иммуномаркеры, выявляемые у детей при НЛ, представлены в табл. 1 и 2.
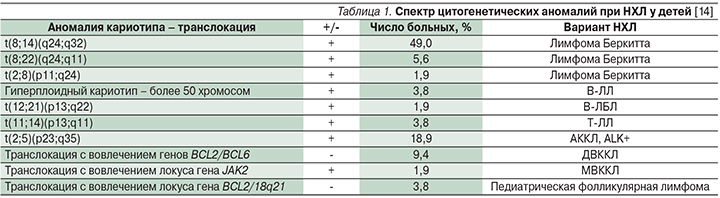
При лимфоме Беркитта наиболее часто на поверхности клеток выявляется экспрессия кластеров дифференцировки CD19, CD20, CD10, CD22, sIgM, нет маркеров Т-клеток и клеток-предшественниц, а также определяется высокая пролиферативная активность на основании уровня биомаркера Ki-67 [15]. Цитогенетическое исследование в 80% случаев обнаруживает аномалии хромосомы-8 (где расположен протоонкоген c-MYC): t(8;14) (q24;q32) – перестройка гена c-MYC и тяжелых цепей иммуноглобулина H (IgH), реже – t(8;22)(q24;q11) – перестройка с локусом лямбда-цепи Ig встречается в 15%, а каппа-цепи – t(2;8)(q11–12;q24) – в 5% [15]. Приведенные нарушения стимулируют гиперсинтез белка с-MYC [16]. Помимо этих изменений выявляются аберрации в локусах 1q. 6q. 7q, 17q, ди- и трисомии хромосом-1 и -7, делеции хромосомы-6, при этом перестройки в 6q, 7q неблагоприятны [17]. На данный момент изучается влияние поломок и в других генах ID3, GNA13, RET, PIK3R1, SWI/SNF, ARID1A, SMARCA4 [18].
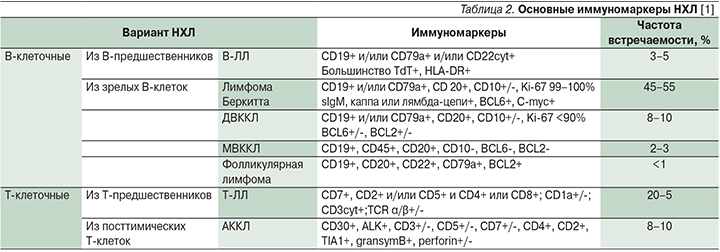
При Т-ЛЛ выявляется перестройка генов Т-клеточного рецептора (T-cell - receptor, TCR). Чаще (до 70% случаев) определяются изменения кариотипа, однако корреляций с прогнозом заболевания не обнаружено [19].
Для В-ЛЛ характерна зависимость прогноза заболевания от нарушений кариотипа. Прогностически благоприятна гиперплоидия при условии отсутствия транслокаций и других хромосомных аномалий [20]. Гиперплоидность характерна в детском возрасте: она встречается в 25% случаев. Худший прогноз выявлен у детей с транслокацией t(12;21) (q13;q22), особенно при гиперлейкоцитозе и возрасте старше 10 лет [4].
ДВККЛ классифицируется на 4 варианта: центробластный (67%), иммунобластный (12%), анапластический (6%) и вариант, богатый Т-клетками (9%) [21]. Для этого заболевания характерна активация онкогена BCL-6 в результате транслокации t(3;14) (q27;q32). Помимо этого может быть выявлена перестройка локусов гена c-MYC (8q24). Отдельно выделены double-hit (с сочетанием транслокаций с-MYC и BCL-2) и triple-hit (плюс BCL-6) lymphoma, для которых характерно крайне агрессивное течение и химиорезистентность, что связано с запуском антиапоптотического каскада [22].
АККЛ, как правило, является ALK (anaplastic-lymphoma kinase, киназа анапластической лимфомы)-позитивной, пораженная клетка отличается атипизмом и полиморфизмом. Данная опухоль представлена тремя гистологическими вариантами – классическим, мелкоклеточным и гистиоцитарным [23]. Для АККЛ характерны экспрессия CD30 без В-клеточных и гистиоцитарных маркеров, а также транслокация t(2;5)(q23;q35) и ее продукт – химерный белок ALK-NMP (nucleophosmin, нуклеофосмин). У детей часто встречаются трисомии, в частности хромосомы-7 [24]. Неблагоприятным прогностическим фактором является возникновение транслокации t(3;8)(q26.2;q24) и реаранжировок в генах c-MYC, MCL1, HOX11/TCL3. Экспрессия СD3 прогностически неблагоприятна в случае рецидивов АККЛ: 5-летняя выживаемость составляет 18 против 72% при CD3-негативном статусе [25].
На основании результатов обследования произведено стадирование заболевания по S. Murphy (1980) [26]:
• I стадия – поражение одной нодальной или экстранодальной области (Е), за исключением средостения и брюшной полости;
• II стадия:
а) поражение одной экстранодальной области с вовлечением региональных лимфатических узлов (НЕ);
б) поражение двух и более областей лимфатических узлов по одну сторону диафрагмы;
в) поражение двух экстранодальных областей с вовлечением региональных лимфатических узлов по одну сторону диафрагмы (или без их вовлечения в процесс);
г) первичное поражение желудочно-кишечного тракта (илеоцекальный угол) с вовлечением лимфатических узлов брыжейки (или без их вовлечения).
• III стадия:
а) поражение двух отдельных экстранодальных областей по обе стороны диафрагмы (IIIE);
б) поражение двух и более областей лимфатических узлов по обе стороны диафрагмы;
в) все первичные опухоли средостения;
г) все распространенные поражения брюшной полости и забрюшинного пространства.
• IV стадия – одно из вышеуказанных поражений с вовлечением центральной нервной системы (ЦНС) и/или костного мозга, костей, или внутренних органов (печени, почек, легких, плевры, кожи, перикарда, желудка и других органов).
Лечение
В связи с высокой вероятностью развития неотложных состояний требуется незамедлительное начало терапии. При расположении объемного образования в средостении может развиваться синдром сдавления верхней полой вены. Как правило, при начале циторедуктивной химиотерапии данная симптоматика нивелируется и не требует хирургических вмешательств. В случае компрессии дыхательных путей может быть выполнена интубация трахеи. При дыхательной недостаточности, обусловленной экссудативным плевритом, при выпотном перикардите и угрозе тампонады сердца, а в некоторых случаях и при напряженном асците в экстренном порядке проводится пункция этих полостей с дальнейшим использованием содержимого для диагностики. Наличие кишечной непроходимости, кровотечения или перфорации органов также зачастую требует экстренного оперативного лечения. При развитии неврологической симптоматики на фоне расположения опухолевого образования в структурах головного или спинного мозга срочно начинают химиотерапию, а при наличии показаний – нейрохирургические мероприятия по декомпрессии [1].
В настоящее время для лечения НХЛ используют риск-адаптированные программы полихимиотерапии (ПХТ), различающиеся по интенсивности, длительности, с учетом природы опухоли (Т- или В-ряда, степени зрелости). К примеру, в случае зрелоклеточных В-НХЛ крайне важна интенсификация стартовых блоков химиотерапии, а при лимфобластных лимфомах из клеток-предшественниц используется длительное лечение с дальнейшей поддерживающей терапией [27].
Неотъемлемым аспектом лечения НХЛ, в особенности В-НХЛ, является соблюдение тайминга. К примеру, протокол В-NHL-BFM (Berlin-Frankfurt-Munster) 90/95 (В-НХЛ-БФМ 90/95) рекомендует соблюдать интервал между курсами не более 3 недель [28]. Зачастую это правило нарушается, в основном ввиду развития осложнений, что ухудшает результаты лечения.
Для терапии зрелоклеточных В-НХЛ у детей разработаны эффективные протоколы B-NHL-BFM 90, FAB (France-America-Britain, Франция-Америка-Британия)-2006 и их более современные модификации [29]. Возможность использовать единую программу лечения для данной группы гемобластозов определяется сходным иммунофенотипом (CD10, CD19, CD20, CD22), высокими показателями Ki-67 (что определяет хорошую чувствительность к цитостатической терапии). В Российской Федерации также применяется программа комбинированной иммунохимиотерапии В-НХЛ-2004м, представляющая собой модификацию B-NHL-BFM90/95, которая предполагает снижение дозы метотрексата до 1 г/м2 в первом и втором блоках для пациентов с III–IV стадиями и добавление ритуксимаба в первые 4 блока [30]. В новом варианте этого протокола (В-NHL-2010м) усовершенствованы критерии стратификации больных на группы риска. Все эти программы состоят из циторедуктивной префазы и дальнейших циторедуктивных и консолидирующих блоков с использованием высокодозного метотрексата и цитарабина, а также циклофосфамида, винкристина, дексаметазона и этопозида. Поддерживающей терапии для заболеваний данной группы не требуется. Продолжительность лечения – от 2 до 5 месяцев. При неэффективности лечения проводится терапия второй линии курсами ICE (ifosfamide, carboplatin, etoposide; ифосфамид, карбоплатин, этопозид), DHAP (dexamethasone, high dose cytarabine, cisplatin; дексаметазон, высокодозный цитарабин, цисплатин), решается вопрос о проведении трансплантации гемопоэтических стволовых клеток, однако повторная ремиссия достигается не всегда и чаще бывает краткосрочной [31]. Пятилетняя общая выживаемость пациентов с ранними стадиями заболевания близка к 100%, а поздними составляет около 85% [21].
МВККЛ отличается от других В-НХЛ по клинической картине (как правило, локализуется в средостении, быстро достигает больших объемов, сдавливает жизненно важные образования), по морфологии и иммунофенотипу, в связи с чем стандартная терапия В-НХЛ для нее малоэффективна [32]. В настоящее время предпринимаются попытки улучшить результаты терапии применением программы иммунохимиотерапии DA-R-EPOCH (dose-adjusted rituximab, etoposide, prednisone, vincristine, cyclophosphamide, doxo-rubicin; ритуксимаб, этопозид, преднизолон, винкристин, циклофосфамид, доксорубицин с регулированием доз). При наличии остаточного образования, которое определяется активным при позитронно-эмиссионной томографии, рассматривается вопрос о проведении локальной лучевой терапии [31].
Основными агентами в ПХТ лимфобластных лимфом/лейкоза (протоколы ALL – acute limphoblastic leukemia: mBFM90/95, ALL IC-BFM 2002) служат антрациклиновые антибиотики, винкристин, циклофосфамид, антиметаболиты (меркаптопурин, метотрексат), преднизолон и L-аспарагиназа. При этом метотрексат используется в высоких дозах (до 5000 мг/м2) в зависимости от происхождения опухоли, стадии и прогностической группы риска [33]. Из новых препаратов, включающихся в терапию лимфобластных лимфом/лейкоза, нужно выделить клофарабин, а также неларабин (последний применим в отношении Т-клеток) [34]. Лечение длительное (до 30 месяцев) и включает фазы индукции, консолидации, реиндукции и дальнейшую поддерживающую терапию. При инициальном поражении ЦНС применяется краниальное облучение. Помимо системной химиотерапии проводится эндолюмбальная профилактика/терапия нейролейкоза. Для лечения рецидивов используются гемцитабин, неларабин, винорельбин, курсы ICE (ifosfamide, carboplatin, etoposide; ифосфамид, карбоплатин, этопозид) и др., однако прогноз для данной группы пациентов остается неблагоприятным [35]. Для закрепления второй ремиссии применяют аллогенную трансплантацию костного мозга [31].
АККЛ – самая распространенная опухоль группы периферических Т-клеточных лимфом [5]. В отношении АККЛ на данный момент отсутствует единый стандарт лечения. Используют различные программы, применяемые при других типах НХЛ (В-НХЛ, лимфобластные лимфомы с учетом стратификации по группам риска, зависящей от активности лактатдегидрогеназы, стадии заболевания, экспрессии ALK и CD8, наличия экстранодального поражения) [36]. Разработан протокол АККЛ-БФМ (Берлин–Франкфурт–Мюнстер) 2012. Таргетная терапия при данном заболевании представлена гербимицином А и 17-AAG (анти-NPM-ALK-препараты), однако следует учитывать возможность формирования к ним резистентности [37]. Кроме того, в отношении ALK-позитивных АККЛ изучается перенос с помощью аденовируса супрессоров ALK-NPM, Jak3 (Janus kinase – янус-киназа), STAT3 (Signal Transducer and Activator of Transcription – сигнальный белок и активатор транскрипции) [38]. Как и для всех CD30+-опухолей возможно использование брентуксимаба; применяется и кризотиниб для ALK+ АККЛ [39, 40]. К этому типу опухолей применим радиоконъюгат – моноклональное анти-CD25-антитело, конъюгированное с 90-иттрием [25]. В случае рецидива заболевания высока вероятность повторной ремиссии при проведении ПХТ второй линии и ауто- или аллогенной трансплантации гемопоэтических стволовых клеток [41]. В целом можно отметить, что АККЛ достаточно чувствительны к терапии, однако частота рецидивов при этом заболевании высока [42].
Благодаря исследованиям клеточных рецепторов кластеров дифференцировки, которые стали мишенью для специфических моноклональных антител, активно развивается таргетная терапия [39, 40]. В лечении НХЛ из периферических В-клеток стали использовать ритуксимаб (анти-CD20-антитело), позволивший снизить дозу метотрексата, тем самым уменьшив его побочные эффекты [43]. Помимо комплемент-опосредованного лизиса CD+-клеток ритуксимаб усиливает цитостатический эффект доксорубицина, винбластина, глюкокортикостероидов, стимулирует апоптоз путем повышения в клетке ионов Са2+ и активации тирозинкиназ [44, 45]. Начато использование в детской практике специфического ингибитора протеасомы 26S – бортезомиба, активирующего апоптоз опухолевых клеток и повышающего их чувствительность к химио- и лучевой терапии [46]. Брентуксимаб ведотин используется при CD30-позитивных лимфомах, в частности при АККЛ, лимфоме Ходжкина и первичной медиастинальной В-крупноклеточной лимфоме [47]. Изучаются терапевтические возможности епратузумаба (анти-CD22-антитело), кризотиниба (ингибитора ALK-тирозинкиназы) [48].
Недавно исследовательская группа Children's Oncology Group начала клиническое исследование по использованию в терапии В-НХЛ наряду с ПХТ и ритуксимабом нового препарата – ибритумомаба тиуксетана (радиоиммуноконъюгат 90-иттрий) [49].
Хирургический метод в лечении НХЛ как самостоятельный не применяется. Инвазивные вмешательства требуются при диагностике заболевания (биопсия) и при необходимости лечения осложнений, а также в некоторых случаях для удаления остаточного образования [29].
Лучевая терапия применяется ограниченно: в качестве профилактики и лечения поражений ЦНС при острых лимфобластных лейкозах/лимфомах из клеток-предшественниц, а также иногда при первичной медиастинальной В-крупноклеточной лимфоме [50].
Пациенты с НХЛ требуют полноценной сопроводительной терапии, осуществление которой возможно в крупных центрах. Для профилактики и лечения неотложных состояний необходимы доступность хирургической, нейрохирургической и реанимационной служб, постоянный контроль жизненно важных функций, лабораторных показателей. Путем создания асептических условий, регулярного контроля флоры отделения, использования антибактериальной терапии проводится профилактика и лечение инфекций.
В случае ожидаемого развития цитопении возможно применение стимуляторов гемопоэза [51]. На фоне агрессивной химиотерапии часто наблюдается поражение слизистой оболочки желудочно-кишечного тракта, в т.ч. выраженного орального мукозита. В настоящее время для лечения этого состояния применяется ряд гигиенических мер, направленных на уход за ротовой полостью, при необходимости – парентеральное питание. Для профилактики синдрома лизиса опухоли назначают инфузионную терапию в режиме гипергидратации с форсированием диуреза, гипурикемические препараты [52].
Заключение
В настоящее время пациенты с НХЛ имеют благоприятный прогноз для жизни и здоровья: общая выживаемость при незапущенных стадиях приближается к 100%, однако терапия сопровождается тяжелыми осложнениями, порой представляющими риск для жизни, а выживаемость при 3–4-й стадиях все же еще остается неудовлетворительной. Перспективы лечения в значительной степени определяются изучением генетической и гистохимической природы данного заболевания. Это позволит синтезировать новые препараты, применение которых повысит эффективность лечения, снизит риск и тяжесть осложнений. Активная исследовательская работа по их разработке ведется в крупнейших медицинских центрах Российской Федерации и мира, что дает надежду на улучшение ситуации в ближайшие годы.



