Введение
Иммуновоспалительные заболевания относятся к числу распространенных и тяжелых болезней человека, частота их в популяции составляет около 10% [1]. В последнее время большое внимание уделяется коморбидной патологии при ревматических заболеваниях, в структуре которой одно из лидирующих мест занимают инфекции [2].
Инфекционная патология интересна в контексте аутоиммунных заболеваний не только из-за роли триггера, запускающего иммунопатологический процесс, но и по целому ряду причин. Во-первых, клиническая картина дебюта или ухудшения иммуновоспалительного заболевания нередко напоминает инфекционный процесс, что объясняется вовлечением в патогенез одних и тех же цитокинов [3–5]. Следствием отсроченной диагностики аутоиммунной патологии является более позднее назначение иммуносупрессивной терапии, что нередко негативно влияет на прогноз. С другой стороны, избыточное применение антибиотиков не по показаниям приводит к росту резистентности микрофлоры, появлению осложнений лекарственной терапии. Кроме того, присоединение коморбидной инфекции на фоне ранее диагностированного иммуновоспалительного заболевания может привести к неправильной трактовке состояния больного с последующим усилением базисной противовоспалительной терапии, которая в той или иной мере обладает иммуносупрессивными свойствами [6]. Подобная тактика опасна развитием тяжелых инфекционных осложнений, что особенно актуально в последнее время ввиду широкого внедрения в клиническую практику генно-инженерных биологических препаратов, действие которых направлено на специфические компоненты патогенеза ревматических заболеваний [7, 8].
Клиническое наблюдение
Пациент И. 42 лет оперирован в травматологическом отделении ГБУЗ РК «Республиканская больница им. В.А. Баранова» (Петрозаводск) 27.08.2015 по поводу коксартроза III стадии (выполнено тотальное эндопротезирование правого тазобедренного сустава). Из анамнеза известно, что на боль в суставе впервые обратил внимание 2 года назад, когда при обследовании по поводу дерматита в Республиканском кожно-венерологическом диспансере (Петрозаводск) был диагностирован псориаз. При поступлении в травматологическое отделение ГБУЗ РК «Республиканская больница им. В.А. Баранова» отмечено наличие ладонно-подошвенного псориаза.
После выписки из травматологического отделения 11.09.2015 появились распирающая боль, отек, покраснение в области послеоперационного рубца, лихорадка до 39° С, в связи с чем вновь госпитализирован, диагностирована глубокая перипротезная инфекция правого тазобедренного сустава. Проводились перевязки с антисептиками, получал антибактериальную терапию (цефотаксим, затем ванкомицин с переходом на пероральную форму рифампицина, далее фторхинолоны) в соответствии с результатами микробиологического исследования, где первично выявлен Staphylococcus aureus (MSSA – Methicillin-Sensitive Staphylococcus Aureus), затем – Acinetobacter baumanii. На фоне лечения сформировался свищ с умеренным серозным отделяемым, явления интоксикации уменьшились, однако с начала октября пациент отмечает ухудшение течения псориаза (появление и распространение псориатических бляшек по телу).
В связи с сохранением системной воспалительной реакции в после-операционном периоде, отсутствием положительной динамики лабораторных тестов 09.11.2015 под наркозом выполнено удаление эндопротеза правого тазобедренного сустава, установлен артикулирующий спейсер. В послеоперационном периоде рана правого бедра закрылась полностью, отек и гиперемия регрессировали. Несмотря на положительную динамику в локальном статусе, по-прежнему сохранялись субфебрилитет, высокие цифры лабораторных маркеров воспаления. При осмотре дерматологом представление сложилось о псориазе, смешанной форме (вульгарном, ладонно-подошвенном), прогрессировании.
С учетом ухудшения течения псориаза для дообследования с целью исключения псориатического артрита больной был переведен в ревматологическое отделение, где на основании проведенных клинико-инструментальных исследований диагностирован псориатический артрит (спондилоартрит, олигоартрит), HLA-B27-ассоциированный, левосторонний сакроилиит 2-й стадии, рентгенологическая стадия 1, активность 1, ФК 2. Помимо боли и ограничения движений в правом тазобедренном суставе на данном этапе при осмотре пациента обращало на себя внимание наличие боли в правом коленном суставе, а также боль и припухлость в левом голеностопном суставе.
Ввиду отсутствия возможности полностью исключить инфекционный процесс в правом тазобедренном суставе от базисной терапии метотрексатом решено было воздержаться, начата терапия сульфасалазином по 2 г/сут и нестероидными противовоспалительными средствами (НПВС), продолжена антибактериальная терапия ципрофлоксацином внутрь в дозе 1000 мг/сут. На этом фоне отмечена положительная динамика: уменьшение степени выраженности суставного синдрома, кожных проявлений, снижение лабораторной активности болезни.
После выписки из ревматологического отделения пациент продолжал принимать НПВС, сульфасалазин, несмотря на что спустя 2 месяца отметил прогрессирование псориаза, повышение температуры тела до 38° С, появление боли во всех суставах и костях, в связи с чем 25.05.2016 вновь был госпитализирован. В условиях травматологического отделения выполнено вскрытие, дренирование гнойного затека в области послеоперационного рубца (в верхней трети правого бедра). На фоне хирургической санации, антибактериальной терапии (левофлоксацин 1000 мг/cут) и продолжающейся терапии сульфасалазином достигнута стойкая нормотермия, но сохранялось серозно-гнойное отделяемое из свищевой раны правого бедра. При микробиологическом исследовании раневого отделяемого вновь выделен S. aureus (MSSA).
В августе 2016 г. выполнено реэндопротезирование правого тазобедренного сустава, послеоперационный период – без особенностей.
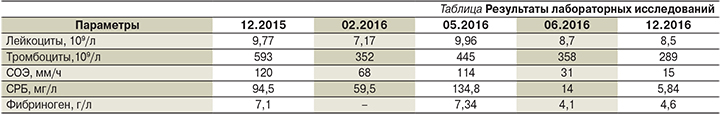
Госпитализировался в ревматологическое отделение Республиканской больницы в декабре 2016 г. При поступлении жалобы на боль в тазобедренных суставах (преимущественно в левом), утренняя скованность – минимальная, другие суставы не беспокоят, псориаз – в ремиссии, температура тела нормальная, лабораторные тесты практически полностью нормализовались (см. таблицу). При выполнении спиральной компьютерной томографии тазобедренных суставов выявлен асептический некроз головки левой бедренной кости, справа – состояние после эндопротезирования. Пациенту даны рекомендации по продолжению приема сульфасалазина, НПВС – по требованию.
Обсуждение
У пациента с псориазом в анамнезе, носителя HLA-B27, диагностирован правосторонний коксартроз III стадии, который с учетом изменений, выявленных при спиральной компьютерной томографии обоих тазобедренных суставов, является следствием асептического некроза головки бедренной кости. Среди факторов, провоцирующих развитие данной патологии, наиболее значимы аутоиммунные заболевания и лечение глюкокортикостероидами [9]. Согласно критериям псориатического артрита CASPAR (ClASsification criteria for Psoriatic ARthritis, 2006) [10], у пациента диагностирована данная аутоиммунная патология. Послеоперационные гнойные осложнения спровоцировали усиление суставного синдрома и прогрессирование псориаза. Подобная синхронность в нарастании суставного синдрома и ухудшения состояния кожи типична для псориатического артрита [11, 12]. В то же время исключительно антимикробная терапия и адекватная хирургическая санация не привели к ремиссии иммуновоспалительного заболевания, потребовав назначения иммуносупрессивной терапии, лимитированной наличием очага инфекции. Препаратом выбора в данном случае послужил сульфасалазин, обладающий как противовоспалительной, так и антимикробной активностью. Поэтапная полноценная хирургическая санация очага инфекции в сочетании с этиотропной антимикробной терапией необходимой продолжительности и одновременным применением противовоспалительных препаратов позволила практически полностью устранить суставной синдром, лабораторные проявления активности заболевания и привела к ремиссии кожного псориаза. Сохраняющийся дискомфорт со стороны левого тазобедренного сустава служит следствием симметричного асептического некроза головки бедренной кости слева, требует наблюдения и своевременного решения вопроса о хирургическом лечении.
Относительно данной клинической ситуации нужно отметить, что псориаз является независимым фактором риска для развития аутоиммунных заболеваний, при этом дерматозе может развиться любая ревматическая патология [11]. В то же время к внешним факторам, способствующим развитию псориатического артрита у больных псориазом, относятся травмы, инфекции, стрессы [12].
Псориатический артрит является наиболее тяжелым проявлением псориаза, которое поражает до 42% пациентов [12, 13]. Деструктивные процессы начинаются на ранних стадиях заболевания вследствие активного воспаления и приводят к рентгенологически значимым поражениям суставов практически у 50% пациентов в среднем через 2 года от постановки диагноза псориатического артрита [13–16].
Коморбидность, встречающаяся при любой аутоиммунной патологии, включает кардиоваскулярные, инфекционные осложнения, а также малигнизацию, остеопороз, осложнения со стороны желудочно-кишечного тракта и др. В каждом конкретном случае, выбирая лечебную тактику, нужно взвешивать риск и пользу, выбирая оптимальный путь решения проблемы для каждого конкретного пациента с учетом существующих рекомендаций.
Коморбидные инфекции в ревматологии сложны для диагностики, т.к. нередко имеют стертую клиническую картину ввиду приема пациентами НПВС, иммуносупрессии вследствие основного заболевания и проводимой базисной терапии. В то же время недостаточная эффективность антимикробной терапии и адекватной хирургической санации при верифицированном очаге инфекции должна заставлять задуматься о неинфекционных причинах системной воспалительной реакции, включающих аутоиммунную патологию, онкологические заболевания, а также более редкие причины (в т.ч. лекарственную лихорадку). Разумное отношение к целесообразности антимикробной терапии, оптимизация ее длительности позволят снизить риск развития антибиотикорезистентности микроорганизмов и побочных эффектов лекарственной терапии, а повышение лабораторной активности, нарастание суставного синдрома, появление лихорадки при иммуновоспалительном заболевании должны мотивировать к дообследованию с целью исключения коморбидной инфекции.
Заключение
Сочетание аутоиммунной патологии с коморбидной инфекцией вызывает серьезные затруднения как при диагностике, так и при лечении обоих заболеваний (в данном случае – псориатического артита и послеоперационной перипротезной глубокой гнойной инфекции). Своевременная диагностика и лечение как ревматологической патологии, так и ее бактериальных осложнений чрезвычайно важны, поскольку способны улучшить прогноз и длительность жизни данной категории пациентов.



