Введение
Остеоартроз – сложное многофакторное хроническое заболевание, частая причина болевого синдрома (БС) и инвалидности среди взрослого населения. Это заболевание представляет собой часто встречаемую форму суставной патологии, им страдают 10–20% населения планеты [1]. В России, по данным проведенных эпидемиологических исследований, частота поражения остеоартрозом коленных и тазобедренных суставов среди взрослых составляет 13% [2]. Число больных остеоартрозом удвоилось за последние 20 лет [3]. Подобная динамика обусловлена такими факторами, как увеличение продолжительности жизни и рост частоты ожирения.
По мере совершенствования методик и способов диагностики признаки остеоартроза все чаще выявляются у лиц молодого возраста [1, 3].
Артериальная гипертензия (АГ) у пациентов, страдающих остеоартрозом, встречается значительно чаще, чем в популяции [4, 5]. По данным зарубежных авторов, распространенность АГ среди больных остеоартрозом составляет от 52 до 55% [6, 7]. Исследования, проведенные в РФ, показывают еще большую частоту встречаемости АГ при остеоартрозе, составляющую от 45 до 80% в зависимости от возрастных категорий [8–10]. Возникновение и прогрессирование АГ у больных остеоартрозом могут быть связаны с рядом факторов [11–13]. Во-первых, это наличие хронической боли разной степени выраженности, повышающей активность таламических центров головного мозга и увеличивающей секрецию катехоламинов. Установлено, что боль при остеоартрозе не только ухудшает качество жизни, но и ассоциируется с уменьшением продолжительности жизни больных даже в большей степени, чем наличие сопутствующих потенциально опасных заболеваний (ИБС, АГ и др.) [13, 14]. Во-вторых, использование для лечения нестероидных противовоспалительных препаратов (НПВП) также может приводить к повышению артериального давления (АД). По данным мета-анализа рандомизированных контролируемых исследований, прием НПВП ассоциируется с увеличением риска развития АГ на 50% по сравнению с плацебо [15]. В-третьих, развитие АГ может быть связано с наличием умеренной эндотелиальной дисфункции, оксидативного стресса, увеличением концентрации провоспалительных медиаторов у больных остеоартрозом [12, 15–17].
Установлено, что у больных остеоартрозом при наличии АГ нарушения суточного профиля АД обусловлены его преимущественным повышением в ночное время [19]. Наличие патологических профилей при проведении суточного мониторирования АД и повышение пульсового давления можно расценить как факторы увеличения сердечно-сосудистого риска.
Современная клиническая практика базируется на комплексном подходе к терапии остеоартроза, т.к. в рамках полиморбидности данная патология занимает особое место. Целью терапии остеоартроза служит замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции суставов. Медикаментозное лечение включает методы воздействия на местный процесс в суставе и околосуставных тканях, влияние на организм больного в целом [10, 18]. При этом необходим учет не только всего многообразия факторов, вызвавших заболевание, стадий, особенностей клинического течения (числа пораженных суставов), степени нарушения функции суставов, но и наличия сопутствующей патологии. Назначение симптоматических лекарственных средств замедленного действия (SYSADOAs) может способствовать уменьшению выраженности БС, повышению комплаентности пациентов к рекомендациям и лечению, снижению потребности в анальгетической терапии.
В настоящее время наибольшую доказательную базу имеют хондроитина сульфат (ХС) и глюкозамина гидрохлорид (ГГ) [3, 16, 20, 21]. Эти средства при остеоартрозе оказывают разнообразное положительное влияние, усиливая и дополняя эффекты друг друга.
Целью нашего исследования была оценка безопасности и эффективности применения комбинированного хондропротектора (КХП; ХС+ГГ) для пациентов, страдающих остеоартрозом в сочетании с АГ.
Методы
В открытое проспективное рандомизированное исследование для оценки эффективности и безопасности длительного использования КХП АРТРА (для лечения остеоартроза коленных суставов были включены 44 пациента с I–III рентгенологическими стадиями заболевания (по классификации Келлгрена и Лоуренса, 1957) [2]. Диагноз был установлен на основании классификационных критериев остеоартроза АСR (Альтман и соавт., 1991) [2]. Средний возраст пациентов составил 42,7±6,6 года, среди них мужчин было 13, женщин – 31. До начала исследования пациенты никогда не принимали препаратов ХС и ГГ. Больные включались в обследование по мере обращения по поводу заболевания в диагностическую поликлинику Клиники ФГБОУ ВО «Читинская государственная медицинская академия» в 2010 г. В работу не вошли пациенты с сопутствующими ИБС, ожирением, сахарным диабетом, новообразованиями. Все лица, принимавшие участие в исследование, дали информированное согласие.
С учетом частой встречаемости АГ при остеоартрозе всем пациентам проведено суточное мониторирование АД. Средняя длительность мониторирования АД составила 22,4±2,1 часа, интервалы измерения АД днем – 15, в ночное время – 30 минут. Определены усредненные показатели систолического, диастолического артериального давления (САД, ДАД) за сутки. В период проведения измерения АД пациентам не ограничивались физические нагрузки. За двое суток до исследования и в день его проведения больные не принимали никаких антигипертензионных препаратов. На основании показателей суточного мониторирования АД проведено разделение пациентов на группы: 1-ю составили 24 больных изолированным остеоартрозом, 2-ю группу – 20 пациентов, имевших сочетание остеоартроза с АГ. Группы больных были сопоставимыми по полу и возрасту, их клиническая характеристика представлена в табл. 1. Более длительный анамнез остеоартроза наблюдался у пациентов 2-й группы. Установить, какое заболевание возникло первым (остеоартроз или АГ), не представлялось возможным. Среди обследуемых в обеих группах преобладали пациенты с II рентгенологической стадией остеоартроза. У всех пациентов, включенных в исследование, БС по визуальной аналоговой шкале (ВАШ) расценивался как умеренно выраженный. Индекс массы тела (ИМТ) был больше в группе пациентов с остеоартрозом в сочетании с АГ.
Наблюдение за каждым больным проводилось в течение 6 месяцев: до проведения исследования, через 12 и 24 недели приема препарата Артра (Юнифарм Инк, США). В состав таблетки входят ХС натрия (500 мг) и ГГ (500 мг). Лекарственный препарат назначали по общепринятой схеме: первые 3 недели – по 1 таблетке 2 раза в день, в последующем – по 1 таблетке в день.
Состояние пациентов оценивали на основании субъективных и объективных характеристик. На всех этапах наблюдения проведен контроль клинико-лабораторных показателей. На момент обследования 33 из 44 пациентов по поводу БС использованы НПВП (диклофенак, ациклофенак, мелоксикам, целекоксиб). Прием НПВП был ситуационным или курсовым в течение 7–10 дней.
Эффективность терапии изучена по следующим показателям:
- индекс WOMAC (Western Ontario and McMaster University, версия индекса в мм) [22, 23];
- средние значения выраженности БС по ВАШ [23];
- потребность в НПВП (кратность приема НПВП в течение недели).
На всех больных заполнялись специально разработанные тематические карты, кроме того, данные вносились в электронную базу для дальнейшего анализа. Статистическая обработка данных проведена с помощью пакета статистических программ STATISTICA v.10 (StatSoft Inc., США). Все вариационные ряды тестировались на нормальность. Если распределение рядов не подчинялось критериям нормальности, применяли методы непараметрической статистики. Для описания количественных признаков определены средние величины (М), стандартное отклонение (SD). При использовании методов непараметрической статистики определены медиана, межквартильный размах (от 25 до 75%). Значимость различий оценивали с использованием t-критерия Стьюдента при нормальном распределении признака и с помощью U-критерия Манна–Уитни при распределении, отличном от нормального. При парном сравнении количественных признаков (до и после лечения) применяли критерий Вилкоксона. Критерий χ2 использован для сравнения частот бинарного признака, при малых значениях частот вводилась поправка Йейтса на непрерывность. Различия считались значимыми при р<0,05.
Результаты
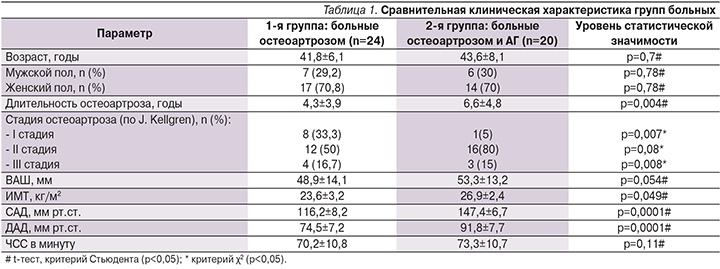
При оценке показателей боли по ВАШ в процессе лечения комбинированным хондропротектором для обследованных больных отмечена положительная динамика (см. рисунок). Средние значения по ВАШ при первичном осмотре составили 48,9 мм в 1-й группе и 53,3 – во 2-й, через 12 недель приема отмечено снижение выраженности БС в обеих группах. К 24-й недели терапии в группе больных изолированным остеоартрозом данный показатель составил 29,8 мм (p=0,012), в группе пациентов, имевших сочетание остеоартроза с АГ, – 32,1 (p=0,013).
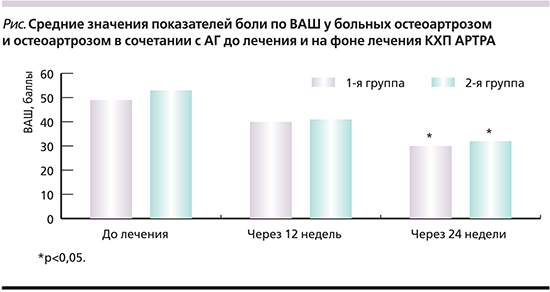
Основным критерием оценки эффективности терапии был функциональный индекс WOMAC, претерпевший изменения в процессе лечения. Как следует из табл. 2, положительная динамика наблюдалась в отношении как суммарного показателя, так и всех его составляющих уже после 12 недель приема препарата в обеих обследуемых группах пациентов. Различий по индексу WOMAC между 1-й и 2-й группами до приема лекарственного препарата, через 12 и 24 недели терапии выявлено не было. При изучении динамики БС по индексу WOMAC под влиянием препарата оказалось, что выраженность БС уменьшилась в обеих группах (на 38,8 и 40,4% соответственно). Эффективность КХП для больных остеоартрозом подтверждается и достоверным уменьшением средних показателей скованности в целевых суставах. Постепенно в процессе лечения уменьшались средние показатели функционального индекса WOMAC (на 26,1 и 23,4%), который отражает физическую активность, затруднение при выполнении бытовых движений и утомляемость. При оценке суммарного показателя функционального индекса через 12 и 24 недели выявлена положительная динамика. Максимальные различия получены к завершению курса терапии, что служит подтверждением эффективности терапии КХП.
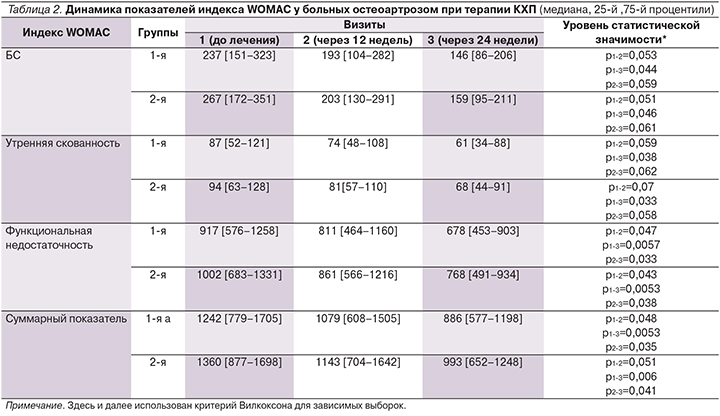
Позитивный терапевтический эффект КХП способствовал уменьшению кратности приема дозы НПВП. Так, в начале лечения кратность приема НПВП составляла в группах 3,5±1,2 и 4,3±1,8 в неделю. К окончанию курса приема этот показатель составил 1,4±1,1 и 1,7±0,9. Из 24 пациентов 1-й группы 11 прекратили прием НПВП, во 2-й группе 9 человек не принимали НПВП даже ситуационно. Вероятно, это может свидетельствовать об анальгезирующей способности препарата для больных при условии отмены НПВП.
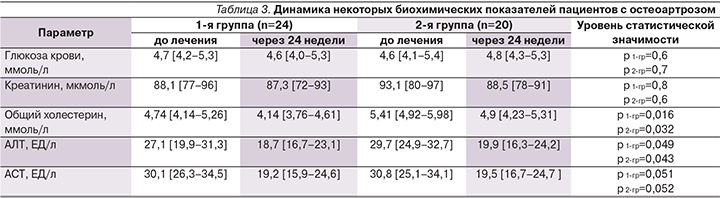
В процессе наблюдения контролировались некоторые биохимические показатели крови больных. Данные исследования представлены в табл. 3. Не продемонстрировали изменений в процессе лечения концентрации глюкозы, креатинина, АСТ крови в обеих группах больных. Однако выявлено снижение содержания общего холестерина крови: в 1-й группе – с 4,74 до 4,14 ммоль/л (р=0,016), или на 12,7% от исходного показателя; во 2-й – с 5,41 до 4,9 ммоль/л (р=0,032), или на 9,4%. Концентрация АЛТ также снизилась после 24-й недели приема КХП в обеих группах. Полученные в исследовании результаты подтверждают эффективность и безопасность длительного (24-недельного) приема КХП.
В течение всего периода исследования ни один пациент не прекратил приема КХП. Побочные проявления в виде метеоризма и диареи (до 3–4 раз в сутки) наблюдались через 5–7 дней приема препарата у 4 больных, однако лечение не прекращалось, в последующем нарушения функции желудочно-кишечного тракта исчезли.
Обсуждение
Симптоматические лекарственные средства замедленного действия (SYSADOAs) – эффективные и наиболее безопасные препараты при длительном применении и широко используются для лечения остеоартроза. Полученные нами данные полностью согласуются с результатами ранее проведенных исследований [3, 19–21], в которых авторы продемонстрировали позитивное влияние хондропротекторов на показатели БС, индексы WOMAC, Lequesne. ХС и ГГ оказывают неидентичное и разнообразное влияние на различные структуры. ГГ, являющийся составляющей частью КХП, после перорального приема распределяется во всем организме, но максимальные его концентрации обнаруживаются в суставном хряще, почках и печени [19, 20]. ГГ – эссенциальный субстрат для синтеза гликозамингликанов и гиалуроновой кислоты, стимулирует синтез протеогликанов, ингибирует фактор активации провоспалительных генов [19, 20]. Следовательно, он купирует провоспалительное действие интерлейкина-1. Благодаря этому механизму ГГ способен подавлять экспрессию генов и синтез белков в системе циклоокигеназы-2. ХС также принимает участие в нейтрализации патологических реакций при остеоартрозе. Биодоступность препарата не превышает 10–13%, но накапливается он преимущественно в хрящевой ткани. Механизм действия ХС не совсем ясен и продолжает изучаться. Фармакологические эффекты реализуются посредством подавления биосинтеза медиаторов воспаления, матриксных металлопротеиназ, образования супероксидных радикалов, угнетения синтеза оксида азота в синовиальной оболочке, хрящевой ткани, субхондральной кости [18, 20, 21]. Клиническая результативность ХС при лечении остеоартроза определяется воздействием на различные механизмы развития и прогрессирования заболевания [24]. Доказано, что использование ХС за счет подавления синтеза липидов, связывания Е-селектина, фибрина в кровеносных сосудах улучшает микроциркуляцию субхондральной кости [25]. Снижение содержания общего холестерина, вероятно, можно объяснить улучшением функции суставов и увеличением физической активности пациентов, включенных в исследование.
Заключение
На основании полученных результатов изучения эффективности КХП Артра при длительной (24 недели) терапии отмечена позитивная динамика по шкале WOMAC показателей БС, утренней скованности и индекса функциональной активности больных изолированным остеоартрозом и остеоартрозом в сочетании с АГ. Снизилась потребность пациентов в приеме НПВП для уменьшения БС. Переносимость препарата хорошая. При длительном приеме лекарственного средства никто из пациентов не выбыл из исследования по причине плохой переносимости или появления побочного действия. В процессе длительной терапии не выявлено повышения уровней глюкозы, креатинина, АЛТ и АСТ у пациентов указанных групп, что свидетельствует о безопасности длительного применения изучавшегося КХП АРТРА. Таким образом, данный хондропротектор оказался эффективным и безопасным средством при длительной терапии остеоартроза коленных суставов.



