Введение
Ювенильные гемангиомы (гемангиомы новорожденных, младенческие гемангиомы) – самые распространенные опухоли детского возраста, которые, по оценкам различных исследователей, встречаются у 3–12% младенцев, принадлежащих к европеоидной расе [1–4]. Ювенильные гемангиомы (ЮГ) – это доброкачественные сосудистые опухоли, возникающие при локальном развитии значительных нарушений регуляции неоангиогенеза [1–4].
В 85–90% случаев ЮГ подвергаются спонтанному регрессу до возраста 6–9 лет [1–5]. До последних лет методы лечения ЮГ включали оперативные методики (эксцизия, эмболизация, лазерное или электрохирургическое удаление, криодеструкция и склеротерапия) и консервативные методы лечения. При обширных сегментарных или осложненных гемангиомах показана системная терапия. Средством выбора ранее служили глюкортикостероиды, которые применялись системно (преднизолон или метилпреднизолон) или внутриочагово (двухфазный бетаметазон, триамцинолон). В отсутствие эффекта от гормональной терапии назначался препарат второй линии – интерферон, а при его неэффективности – винкристин [4–6]. При использовании указанных средств нередко возникают серьезные побочные эффекты: при лечении преднизолоном – катаракта, гипертрофическая кардиомиопатия, диабет, стеатоз печени; при лечении интерфероном – лихорадка, миалгия, лейкопения, гемолитическая анемия, интерстициальный нефрит, значительные неврологические нарушения. Вместе с тем при риске развития серьезных системных или местных осложнений при лечении детей классическими методами не всегда удается достичь желаемого результата [5, 6].
Большой интерес вызывали новые данные о перспективном средстве для фармакотерапии сосудистых новообразований – пропранололе, давно известном в качестве антигипертензивного препарата и используемом не только взрослыми для лечения артериальной гипертензии, но и детьми при кардиальной патологии. Первое описание случайной находки ангиангиогенного эффекта пропранолола – неселективного β-адреноблокатора (β-АБ), произвело революцию в терапии гемангиом и опубликовано сотрудниками госпиталя г. Бордо (Франция) во главе с C. Léauté-Labrèze в 2008 г. [7].
Кроме системного применения β-АБ сегодня накоплен значительный опыт топической терапии очаговых поверхностных ЮГ. Наибольшая клиническая эффективность при местном лечении ЮГ установлена для неселективного β-АБ – тимолола [8]. Местная терапия ЮГ β-АБ представляется наиболее актуальной методикой лечения, т.к. исследования распространенности и клинико-функциональных особенностей установили превалирование поверхностных и очаговых форм ЮГ [9–11]. Вместе с тем отсутствуют исследования профиля безопасности и эффективности длительной топической терапии поверхностных гемангиом.
Целью исследования было оценить свойства тимолола in vitro, его клиническую эффективность и безопасность при местной антиангиогенной терапии детей с поверхностными очаговыми ЮГ.
Материал и методы
Лабораторные исследования. Цитотоксичность тимолола в культурах клеток оценивали на основе измерения концентрации лактатдегидрогеназы (ЛДГ) – LDH-тест (Cytotoxicity Detection Kit Plus, Roche Life Science, Германия). Для определения цитостатической дозы исследования проведены с концентрациями тимолола в растворе 1 мкмоль/л, 10 и 100 мкмоль/л. Результаты теста сравнились с CT50 (цитотоксическая доза для 50% клеток в культуре). LDH-тест проведен в 96-луночном планшете с питательной средой (100 мкл 10% DMEM) и исследуемой культурой клеток (2×104) с добавлением тимолола в указанных концентрациях. Культивирование сред проведено при 37°С и 5% СО2 в течение суток, после чего проведено введение катализатора и красителя для количественной оценки ЛДГ и инактивация 1 моль/л раствора соляной кислоты. Контрольные исследования плотности клеточных культур выполнены с дистиллированной водой. Фотометрический анализ LDH-теста осуществлен на планшет-ридере Phomo (Autobio Labtec Instruments Co., Ltd., Китай) при 492 нанометрах (стандартная длина волны – 620 нм).
Влияние тимолола на метаболическую активность клеток in vitro изучали при проведении теста WST-1 (модифицированный МТТ-тест) в трех линиях культур клеток: HDMEC – эндотелиальные, HaCat – линия кератиноцитов, L929 – культура фибробластов.
WST-1-тест позволяет оценивать количество метаболически активных клеток. WST-1 (тетразоливая соль) расщепляется до формазана клеточными энзимами. Содержание формазана в клеточной среде отражает активность митохондриального дегидрогенеза, следовательно, интенсивность окраски прямо зависит от числа клеток, обладающих интенсивным метаболизмом. Клетки засеивались в отдельные 96-луночные планшеты на 100 мкл питательной среды (для HDMEC – ECGM-MV, для HaCat и L929 – DMEM). Культивирование клеточных сред осуществлено при 37°С и 5% СО2 в течение 24 часов. Исследование негативной метаболической активности выполнено для 1 мкмоль/л, 10 и 100 мкмоль/л тимолола. После 24 часов культивирования ко всем образцам был добавлен маркер клеточной пролиферации WST-1 (Roch, Германия), после чего выполнена повторная инкубация. Через 30 и 60 минут инкубации с WST-1 осуществлено измерение формазанового продукта на планшет-ридере на 450 нм (стандартная длина волны – 620 нм). Результаты сравнивались с A. dest., отрицательным контролем – лунками, содержащими только питательные среды ECGM-MV или DMEM соответственно; их сочетание с A. dest (100 мкмоль/л) или тимололом (100 мкмоль/л). В качестве положительного контроля измерения выполнялись в лунках, содержащих питательную среду и культуры соответствующих клеток.
Исследование влияния тимолола на миграцию клеток in vitro выполнено методом механического повреждения конфлюэнтного монослоя в культурах эндотелиальных клеток. Для эксперимента были подготовлены культуры клеток в чашках Петри с числом 5×105 клеток/чашка. Инкубация (37°С, 4,9% СО2) осуществлена в течение 2 суток до формирования необходимой плотности клеток, полученные культуры высевались на предметные стекла в объеме 10 мкл с числом 8×105 эндотелиальных клеток (ЭК). Через 4 часа добавлялись питательная среда (Dulbbeco’s MEM), дистиллированная вода как контроль и тимолол в объеме 10 мл. Через сутки инкубации с помощью одноразовых пипеток произведено «повреждение» конфлюэнтного монослоя в виде прямой поперечной линии шириной 0,5 мм.
Интенсивность миграции оценена микроскопически в интервалах 0,6 часа, 12, 22, 32 и 48 часов. Анализ и микрофотографии монослоя производили с помощью микроскопа «Bio Zero» Keyence (Япония) и программной среды «BioZero Application».
На основании динамики изменения площади «повреждения» монослоя рассчитывался индекс угнетения миграции (ИУМ, IУМ) – отношение процента площади, оставшейся свободной от мигрировавших клеток, к исходной – свободной от клеток, непосредственно после повреждения монослоя.
Оценка терапевтической эффективности и безопасности. Оценка эффективности топического применения тимолола изучена при лечении 56 детей с поверхностными ЮГ в возрасте от 2 до 14 месяцев. Методика лечения включила нанесение 0,25%-ного крема с неселективным β-АБ тимололом дважды в сутки под окклюзию в течение 4–8 месяцев. Для изучения безопасности и риска побочных эффектов – гипогликемии и снижения скорости проведения электрических импульсов по проводящей системе сердца, 10 детям в возрасте 2–4 месяцев проведен контроль уровня глюкозы капиллярной крови и измерение интервала P-Q при электрокардиографии (ЭКГ).
Статистический анализ. Сравнительный анализ экспериментальных результатов изучения цитопатического эффекта тимолола, влияния на метаболизм и миграцию клеток in vitro выполнен в программной среде IBM SPSS Statistics с применением дисперсионного анализа апостериорного критерия Дункана.
Результаты
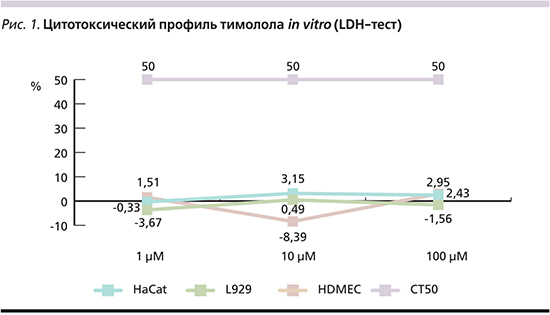
Цитотоксичность и влияние на метаболизм клеток. Анализ цитотоксичности тимолола в объеме 1 мкмоль/л, 10 и 100 мкмоль/л in vitro по отношению к контролю (индекс оптической плотности, IОП) составляет 4,51%, -8,39 и 4,95% соответственно. LDH-тест свидетельствует о низких показателях цитолиза (СT<50%) в культуре ЭК и указывает на отсутствие прямого цитопатического эффекта тимолола в отношении ЭК.
Индекс оптической плотности (IОП), характеризующий цитотоксичность тимолола в объеме 1 мкмоль/л, 10 и 100 мкмоль/л в культуре HaCat in vitro, составляет -0,33%, 3,2 и 2,43% соответственно. Таким образом, LDH-тест не выявил нарушения жизнеспособности клеток и указывает на отсутствие цитотоксического влияния тимолола на кератиноциты (КЦ).
Соотношение показателей ЛДГ при исследовании образцов с тимололом и контроля в объеме 1 мкмоль/л, 10 и 100 мкмоль/л – IОП, составляет -0,67%, 0,49 и -1,56% соответственно. Характер цитолиза в культуре фибробластов (ФБ) свидетельствует об отсутствии цитопатического эффекта тимолола в данной линии клеток.
Результаты изучения цитотоксичности LDH-теста в линиях клеточных культур: HDMEC (культура ЭК), HaCat (линия КЦ), L-929 (культура ФБ) на основе сравнения индексов оптической плотности изучаемых образцов, свидетельствуют о низких показателях цитолиза (СT<50%) и указывают на полное отсутствие цитопатического потенциала тимолола (рис. 1), в т.ч. высоких доз (10 мкм) in vitro, что позволило дальнейшее проведение экспериментальных исследований.
Показатели фотометрического исследования при анализе влияния тимолола на метаболизм клеток в линии HaCat (культура КЦ) через 30 минут после введения WST-1 сопоставимы (p=0,001) с таковыми при инкубации культуры КЦ с дистиллированной водой (A. dest. – Aqua destillata). Отсутствия достоверных отличий (p=0,001) оптической плотности образцов не выявлено не только при сравнении между группами (при инкубации культур клеток с тимололом и A. dest.), но и внутри групп при анализе различных объемов веществ (1 мкмоль/л, 10 и 100 мкмоль/л). Повторные измерения в культуре КЦ через 60 минут после введения WST-1 также указывают на отсутствие значимых отличий (p=0,001) в оптической плотности образцов при инкубации с тимололом и A. dest. вне зависимости от объема исследуемых веществ.
При анализе результатов WST-теста установлена корреляция показателей (p=0,001) с положительным контролем (образцы, содержащие питательную среду и клетки линии HaCat – 0,486±0,018) и достоверное (p=0,001) их отличие от оптической плотности отрицательного контроля – образцов, содержащих только питательную среду DMEM (0,135±0,006); ее сочетание с 100 мкмоль/л A. dest. (0,14±0,004) или с 100 мкмоль/л тимолола (0,133±0,009).
Результаты WST-теста в культуре HaCat указывают на отсутствие негативного влияния тимолола на метаболизм клеток и свидетельствуют об отсутствии цитостатического эффекта на КЦ in vitro.
Показатели фотометрического исследования при анализе влияния тимолола на метаболизм клеток в линии L929 (культура ФБ) через 30 минут после введения WST-1 сопоставимы (p=0,001) с таковыми при инкубации культуры КЦ с A. dest. Отсутствия достоверных различий (p=0,001) оптической плотности образцов не установлено при сравнении показателей между группами (при инкубации культур клеток с тимололом и A. dest.) и внутри групп при исследовании различных объемов веществ (1 мкмоль/л, 10 и 100 мкмоль/л). Следующие измерения в культуре ФБ через 60 минут после введения WST-1 указывают также на отсутствие значимых различий (p=0,001) в оптической плотности образцов при инкубации с тимололом и A. dest. вне зависимости от объема исследуемых веществ. При сравнении результатов WST-теста установлена корреляция показателей (p=0,001) с положительным контролем (образцы, содержащие питательную среду и клетки линии L929 – 2,81±0,17) и достоверное (p=0,001) их отличие от оптической плотности отрицательного контроля – образцов, содержащих только питательную среду DMEM (0,135±0,006); DMEM в сочетании с 100 мкмоль/л A. dest. (0,14±0,004) или с 100 мкмоль/л тимолола (0,133±0,009).
Результаты WST-теста в культуре L929 указывают на отсутствие негативного влияния тимолола на метаболизм клеток и свидетельствуют об отсутствии цитостатического эффекта на культуру ФБ in vitro. Оптическая плотность формазанового продукта в линии HDMEC (культура ЭК) через 30 минут после введения WST-1 сопоставима (p=0,001) при инкубации с тимололом и A. dest. Отсутствие достоверных различий (p=0,001) оптической плотности образцов установлено при сравнении показателей между группами (при инкубации культур клеток с тимололом и A. dest.) и внутри групп при исследовании различных объемов веществ (1 мкмоль/л, 10 и 100 мкмоль/л).
 Измерения оптической плотности в культуре ЭК через 60 минут после введения WST-1 также указывают на отсутствие значимых отличий (p=0,001) в оптической плотности образцов при инкубации культур клеток с тимололом и A. dest. и питательной средой ECGM-MV вне зависимости от объема исследуемых веществ. WST-тест для 1 мкмоль/л, 10, 100 мкмоль/л тимолола и 1 и 10 мкмоль/л A. dest. выявил корреляцию показателей (p=0,001) с положительным контролем (образцы, содержащие культуру клеток и питательную среду ECGM-MV, – 0,608±0,078). При этом оптическая плотность образцов, которые культивировались с 100 мкмоль/л A. dest., были достоверно ниже (0,368±0,053; p=0,001) уровня положительного контроля, но сопоставимыми с таковыми при инкубации с 100 мкмоль/л тимолола (0,375±0,075). Вместе с тем показатели оптической плотности при инкубации с 1 мкмоль/л, 10 и 100 мкмоль/л исследуемых веществ (тимолола и A. dest.) были выше отрицательного контроля (ECGM-MV; 0,038±0,003; p=0,001).
Измерения оптической плотности в культуре ЭК через 60 минут после введения WST-1 также указывают на отсутствие значимых отличий (p=0,001) в оптической плотности образцов при инкубации культур клеток с тимололом и A. dest. и питательной средой ECGM-MV вне зависимости от объема исследуемых веществ. WST-тест для 1 мкмоль/л, 10, 100 мкмоль/л тимолола и 1 и 10 мкмоль/л A. dest. выявил корреляцию показателей (p=0,001) с положительным контролем (образцы, содержащие культуру клеток и питательную среду ECGM-MV, – 0,608±0,078). При этом оптическая плотность образцов, которые культивировались с 100 мкмоль/л A. dest., были достоверно ниже (0,368±0,053; p=0,001) уровня положительного контроля, но сопоставимыми с таковыми при инкубации с 100 мкмоль/л тимолола (0,375±0,075). Вместе с тем показатели оптической плотности при инкубации с 1 мкмоль/л, 10 и 100 мкмоль/л исследуемых веществ (тимолола и A. dest.) были выше отрицательного контроля (ECGM-MV; 0,038±0,003; p=0,001).
Анализ результатов WST-теста в культуре HDMEC указывает на отсутствие негативного влияния тимолола на метаболизм клеток и свидетельствует об отсутствии цитостатического эффекта на культуру ЭК in vitro.
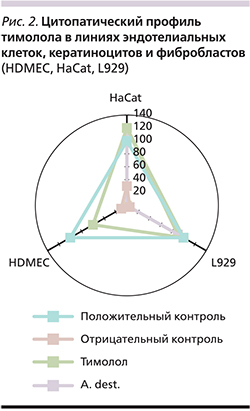
Определения маркера пролиферации (WST) на основании измерения оптической плотности образцов через 30 и 60 минут инкубации в трех линиях культур клеток: HDMEC – эндотелиальные, HaCat – линия кератиноцитов, L929 – культура фибробластов, в присутствии 1 мкмоль/л, 10 и 100 мкмоль/л тимолола свидетельствуют об отсутствии его негативного влияния на метаболизм клеток и цитопатического потенциала in vitro (рис. 2).
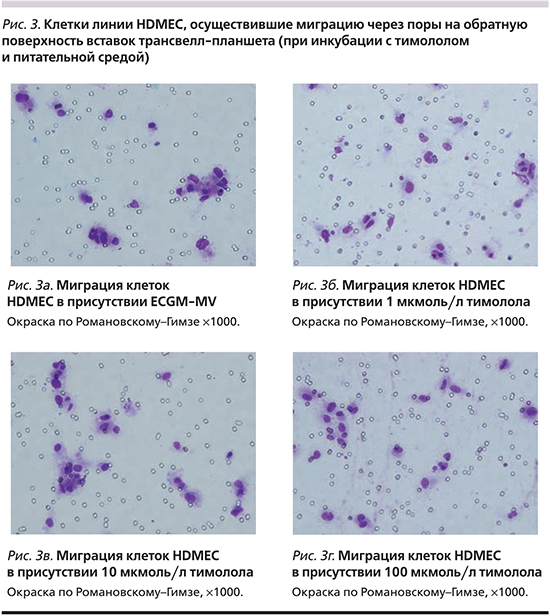
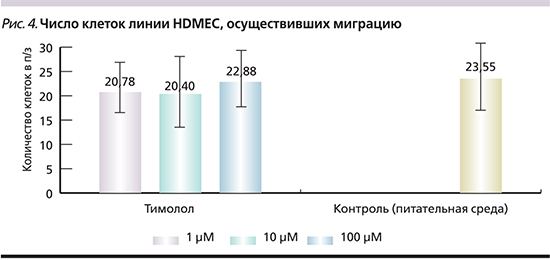
Хемотаксис. При анализе влияния тимолола на хемотаксис ЭК установлено, что число клеток линии HDMEC, осуществивших миграцию через поры на обратную поверхность вставок трансвелл-планшета после инкубации в течение 5 часов с введением тимолола (рис. 3), не отличалось при 1 мкмоль/л, 10 и 100 мкмоль/л тимолола (20,77±5,38; 20,4±7,56 и 22,87±5,67 клетки в поле зрения соответственно; p=0,001) от числа спонтанно мигрировавших клеток в контроле (23,55±5,7 клетки в поле зрения; p=0,001, рис. 4). Совокупный IХ составил 0,9, что указывает на отсутствие влияния тимолола на хемотаксис ЭК in vitro.
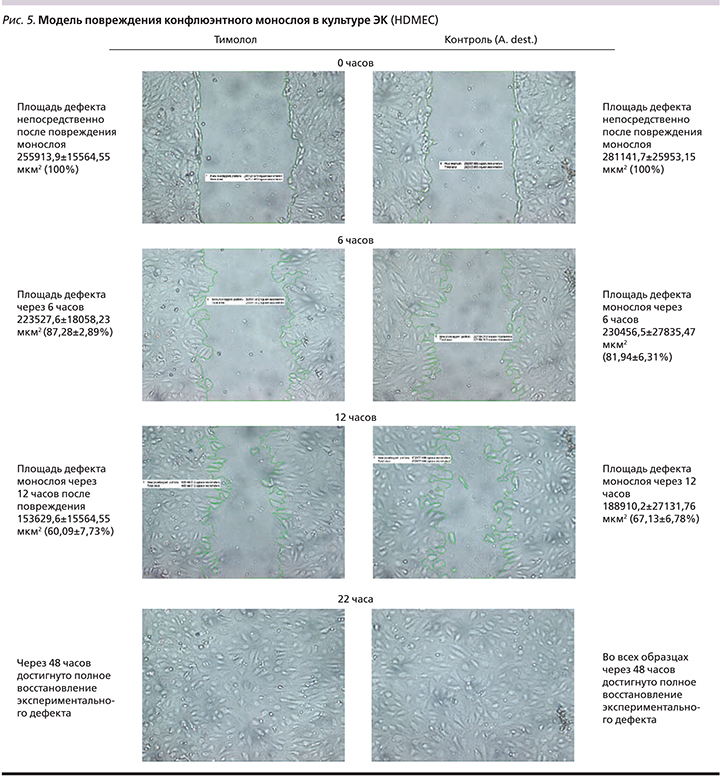
Миграция. Изучение миграции ЭК в модели «повреждения» монослоя культуры HDMEC (рис. 5) в присутствии тимолола и контроля – A. dest., свидетельствует о сопоставимой площади зоны, свободной от ЭК, при исследовании через 0 и 6 часов (p=0,001). Площадь дефекта в культуре с тимололом через 12 часов после нанесения повреждения монослоя была меньше, чем в контроле (153629,589±20256,7711 и 188910,172±27131,7641 мкм2 соответственно; p=0,001). Однако через 22 часа установлено полное восстановление конфлюэнтности монослоя ЭК в каждой экспериментальной серии во всех исследуемых образцах.
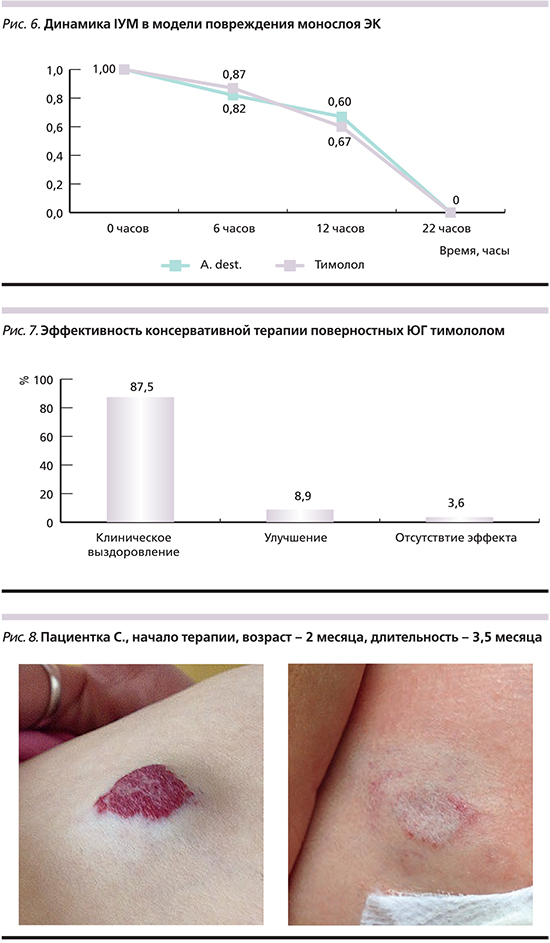
Динамика IУМ в модели повреждения монослоя ЭК (рис. 6) свидетельствует о сопоставимых показателях и скорости восстановления конфлюэнтности монослоя ЭК в присутствии тимолола и Aq. dest. (контроль).
Эффективность и безопасность. При оценке клинической эффективности установлена удовлетворительная переносимость лечения, не было отмечено развития побочных эффектов системного или местного характера, связанных с применением тимолола. Измерения интервала Р-Q не выявили нарушений в проводящей системе сердца, его длительность составила 0,11±0,6 секунды.
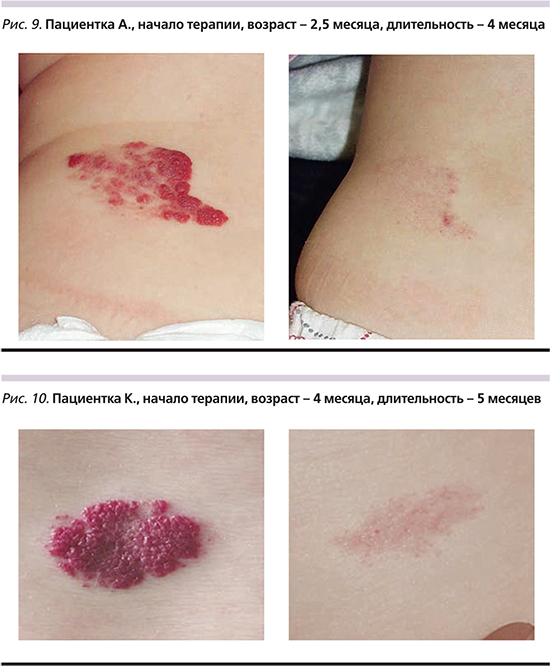
Клиническое выздоровление отмечено у 49 (87,5%) пациентов, у 4 (7,1%) – значительное улучшение и у 3 (5,3%) эффект от лечения отсутствовал (рис. 7). При этом первичный эффект при лечении проявлен через 4 недели с уменьшения напряженности гемангиомы, потери блеска и интенсивности окраски, появления участков фиброза преимущественно в центральной части новообразования и дальнейшего регресса вплоть до полной инволюции.
Наибольший эффект отмечен при раннем начале лечения в возрасте 2–3 месяцв, что, возможно, коррелирует с динамикой уровня проангиогенных факторов, в т.ч. VEGF (Vascular endothelial growth factor), и изменением ангиоархитектоники гемангиом. При полном разрешении опухоли на поверхности кожи определялись остаточные телеангиэктазии и участки, представленные поверхностными структурами малого диаметра (0,5–1,0 мм), напоминающие мелкие цистерны розового цвета, при дальнейшем наблюдении подобные явления разрешались полностью (рис. 8–10). Рецидива гемангиом не отмечено.
Обсуждение
ЮГ – самые распространенные опухоли кожи детского возраста, которые, по оценкам различных исследователей, встречаются у 3–10% новорожденных. До настоящего времени методы лечения ЮГ включали различные по эффективности методики, в т.ч. методы оперативного удаления, применение глюкокортикостероидов и цитостатиков, при лечении которыми имеются существенные побочные эффекты и осложнения.
Новый подход к фармакотерапии ЮГ основан на эффективности применения β-АБ, а местная терапия ЮГ β-АБ представляется наиболее актуальной методикой лечения очаговых поверхностных гемангиом в практике дерматовенеролога.
В ряде исследований установлена безопасность терапии топическими средствами, содержащими β-АБ, но до сегодняшнего дня остаются не вполне ясными механизмы индукции регресса ЮГ при лечении средствами данной группы.
Всесторонняя оценка безопасности терапии и понимание механизма антиангиогенного эффекта β-АБ важны для их широкого применения при лечении детей с ЮГ, т.к. одна из гипотез эффективности основана на прямом апоптозе эндотелиоцитов [13].
Результаты фотометрии ЛДГ в культуре HDMEC, L929 и HaCat при инкубации с раствором тимолола, WST-тест в линиях ЭК, КЦ и ФБ указывают на отсутствие негативного влияния тимолола на метаболизм клеток и свидетельствуют об отсутствии цитостатического эффекта in vitro.
При анализе влияния тимолола на хемотаксис и миграцию ЭК в модели «повреждения» монослоя отсутствуют признаки его негативного влияния на подвижность клеток.
Оценка местной терапии ЮГ свидетельствует о высокой эффективности β-АБ тимолола: выздоровление отмечено у 87,5% детей, у 7,1% – значительное улучшение, и у 3 (5,3%) – эффект от лечения отсутствовал. При этом отмечена необходимость начала ранней терапии ЮГ и ее неэффективность в возрасте старше 6–8 месяцев, что, вероятно, обусловлено изменением активности проангиогенных факторов, инициирующих развитие ЮГ. Лечебный эффект обусловлен не подавлением деления клеток гемангиомы, а отрицательным влиянием на цитокиновое окружение, что способствует развитию ранней инволюции, напоминающей фазу самопроизвольного регресса, характерную для ЮГ.
Отсутствие местных и системных побочных эффектов, в т.ч. нарушений проводящей системы сердца, обусловливает высокий профиль безопасности проводимого лечения, что является одним из наиболее актуальных требований при ведении пациентов раннего детского возраста.
Заключение
Проведенные экспериментальные исследования in vitro указывают на отсутствие негативного влияния тимолола на жизнеспособность (LDH-тест и WST-1, модифицированный MTT-тест) ЭК, ФБ и КЦ, миграцию и подвижность ЭК in vitro. Результаты исследований свидетельствуют о безопасности применения неселективного β-АБ и отсутствии прямого негативного влияния на клетки, что в совокупности с высокой клинической эффективностью и отсутствием побочных системных эффектов позволяет рекомендовать использование тимолола для консервативной терапии очаговых поверхностных ЮГ.
Источник финансирования
Исследования выполнены в соответствии с планом научных исследований стипендии Президента РФ для молодых ученых и аспирантов, осуществляющих перспективные исследования и разработки по приоритетным направлениям модернизации российской экономики (2015–2017).
Исследования проведены в рамках гранта Министерства образования и науки РФ для обучения за рубежом в 2013/14 учебном году (протокол от 25.06.2013 № 2) в клеточной лаборатории Института экспериментальной и клинической хирургии медицинского факультета Университета земли Саар (Германия).



