Введение
Диссеминированная аденокарцинома желудка и кардиоэзофагеального перехода, именуемая в дальнейшем рак желудка (РЖ), – гетерогенное заболевание, результаты лечения которого остаются крайне неудовлетворительными. В 2012 г., по данным мировой статистики, было диагностировано 952 тыс. новых случаев РЖ и 723 тыс. смертельных исходов от него [1].
Высокие показатели летальности при РЖ обусловлены не только низкой выявляемостью его ранних форм, но и невозможностью адекватно оценивать т.н. минимальную остаточную болезнь после проведенной терапии, прогнозировать дальнейший исход заболевания.
За последнее десятилетие ведется активное изучение прогностической роли наличия диссеминированных опухолевых клеток (ДОК) в костном мозге (КМ) или циркулирующих в крови больного (ЦОК) при различных солидных опухолях.
По данным международных исследований, ДОК, выявляемые в КМ онкологических больных на диагностическом этапе, служат основным источником отдаленных метастазов в дальнейшем. Наибольшее число работ в этом направлении посвящены изучению прогностической роли ДОК и ЦОК при операбельных стадиях рака молочной железы, наименьшее – при операбельном РЖ.
По данным литературы, частота выявления ДОК в КМ больных РЖ I–III стадий колеблется от 20 до 51% и является независимым неблагоприятным фактором прогноза выживаемости, свидетельствуя об исходной диссеминации процесса [2–4].
Целью нашего исследования стало изучение частоты и прогностической значимости наличия ДОК в КМ больных диссеминированным РЖ.
Материал и методы
С ноября 2013 по апрель 2016 г. в отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проведено исследование по выявлению микрометастазов и/или ДОК в КМ больных диссеминированным РЖ. Всем больным была назначена комбинированная химиотерапия в режиме mFOLFIRINOX (иринотекан 180 мг/м² в день 1+оксалиплатин 85 мг/м² в день 1+лейковорин 200 мг/м² в день 1 +5-фторурацил 250 мг/м² в день 1 внутривенно струйно с последующей инфузией 5-ФУ в дозе 2200 мг/м² на протяжении 48 часов каждые 2 недели).
В задачу исследования вошел сравнительный анализ выживаемости без прогрессирования (ВБП) болезни и общей выживаемости (ОВ) больных в зависимости от наличия или отсутствия ДОК в КМ пациентов до начала химиотерапии (ХТ).
ВБП определена как временной интервал с момента начала ХТ 1-й линии до регистрации прогрессирования процесса или смерти от любой причины, если таковая наступит раньше.
ОВ больного определена как временной интервал с момента начала ХТ 1-й линии до регистрации смерти пациента от любой причины.
Оценка ДОК в КМ была выполнена 43 больным перед началом специфического лечения. Иммунофенотипическая диагностика осуществлена на материале, полученном при пункции КМ (1,0 мл). Определение микрометастазов проведено методом проточной цитометрии с окрашиванием антителами CD45 и EpCam или CD45 и цитокератинами, описанным ранее [5].
К ДОК-позитивным (ДОК+) случаям отнесены таковые с наличием не менее 1 опухолевой клетки на 10 млн миелокариоцитов. Характеристика больных представлена в табл. 1.
Результаты
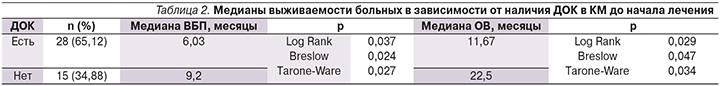
Из всей группы пациентов (n=43) наличие ДОК в КМ было обнаружено у 28 (65,1%) пациентов, в 34,9% случаев (n=15) ДОК в КМ отсутствовали.
Анализ данных показал, что ДОК в КМ достоверно чаще выявлялись при локализации первичной опухоли желудка в области кардиоэзофагеального перехода, чем при локализации в других отделах (p=0,05).
Отмечена корреляция между степенью дифференцировки опухоли и поражением КМ: частота выявления ДОК была достоверно выше в группе больных с низкодифференцированной и перстневидноклеточной формами аденокарциномы, чем при высокой и умеренной степенях дифференцировки (p=0,01 и p=0,024 соответственно).
В данном исследовании не выявлено связи наличия ДОК с полом больных, локализацией отдаленных метастазов, числом зон метастазирования.
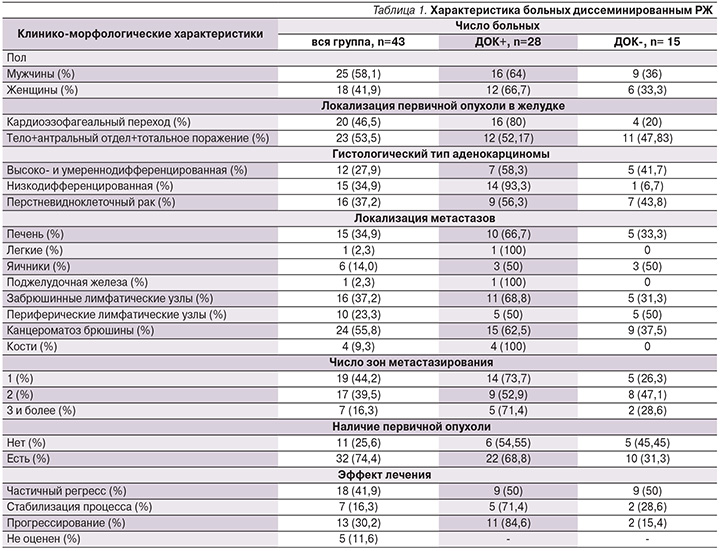
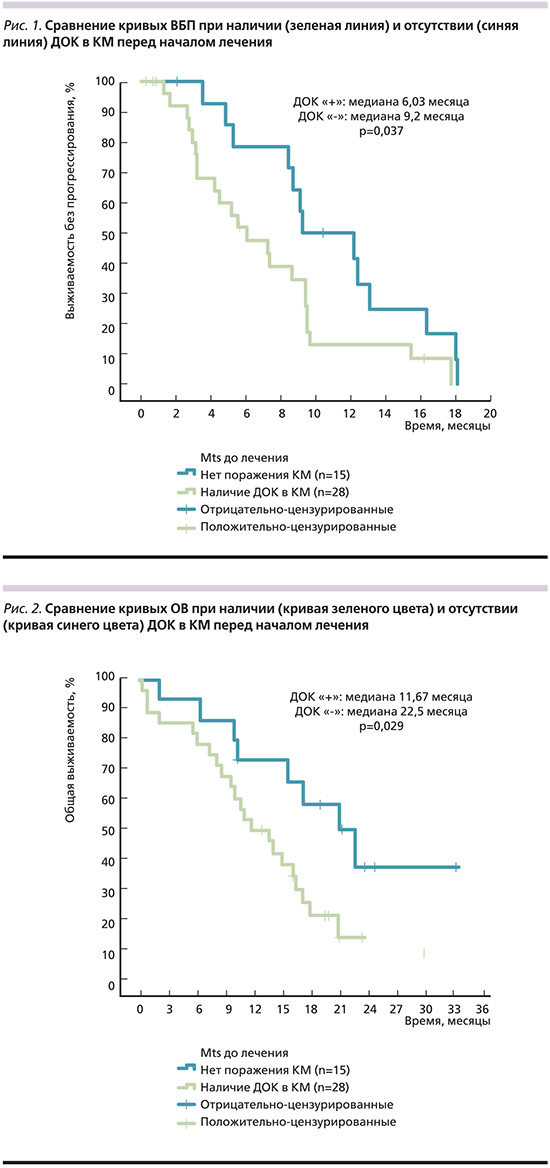
Анализ отдаленных результатов лечения показал, что наличие ДОК в КМ пациентов до начала противоопухолевой терапии сопровождается достоверным ухудшением как ВБП, так и ОВ больных (табл. 2, рис. 1, 2).
Выявлено, что прогностически значимым титром ДОК в КМ является 6 и более опухолевых клеток на 10 млн миелокариоцитов.
Обсуждение полученных результатов
Возможно, одним из наиболее значительных достижений фундаментальной онкологии последних 15 лет стало открытие способности опухолевых клеток к диссеминации еще на доклинической стадии развития опухоли [6].
Основными участниками диссеминации являются ЦОК. Опухолевые клетки, утрачивая межклеточные связи и подвергаясь эпителиально-мезенхимальной трансформации, путем пассивной или активной интравазации попадают в системный кровоток, где большая их часть погибает. Выжившие клетки достигают капилляров и трансэндотелиально мигрируют в ткани [7].
Благодаря особенностям сосудистой архитектоники костная ткань обладает наиболее благоприятными условиями для экстравазации опухолевых клеток. Помимо транспортной функции сосудистая сеть костной ткани принимает участие в остеогенезе и гемопоэзе путем прямого межклеточного взаимодействия и паракринных (ангиокринных) сигнальных путей. Для поддержания постоянства, самовоспроизведения и состояния «покоя» стволовых гемопоэтических клеток необходима особая сосудистая микросреда с вовлечением различных подтипов сосудов, включая как эндотелиальные, так и периваскулярные клетки. Создающаяся таким образом сосудистая микросреда носит название сосудистых ниш. Особенностью сосудистой сети ткани КМ является обилие синусоидальных расширенных капилляров с резко замедленным кровотоком. Эндотелий таких синусоидов фенестрирован, что облегчает перемещение гемопоэтических клеток из КМ в сосуды и обратно. Вместе с тем значительное замедление кровотока и естественная повышенная проницаемость сосудистой стенки способствуют экстравазации и депонированию ДОК в КМ. Как показывают исследования, ДОК в КМ в течение длительного времени могут находиться в неактивном, «дремлющем» состоянии [8].
Переход ДОК в дремлющее состояние в КМ может быть инициирован не только взаимодействием с микросредой, но и мезенхимальным фенотипом клетки. Для реактивации необходима обратная мезенхимально-эпителиальная трансформация, которая вернет опухолевой клетке способность к пролиферации и образованию метастатических опухолей [7]. Реактивацию ДОК в КМ обеспечивают все те же сосудистые ниши [8].
В многочисленных клинических исследованиях выявлена достоверная корреляция между наличием ДОК в КМ и ухудшением выживаемости больных при различных солидных опухолях в операбельной стадии при раке молочной железы [9], предстательной железы [10], легкого [11], толстой кишки [12] и других локализаций [13, 14].
Данные нашего исследования демонстрируют высокую частоту поражения КМ микрометастазами (65,1% больных) при диссеминированном РЖ. Частота выявления ДОК коррелировала со степенью дифференцировки опухоли и была достоверно выше при низкодифференцированной и перстневидноклеточной формах аденокарциномы, чем при высокой и умеренной степенях дифференцировки (p=0,01 и p=0,024 соответственно). Корреляции с такими традиционными неблагоприятными прогностическими факторами, как пол больных, локализация отдаленных метастазов, число зон метастазирования, в нашем исследовании не выявлено. Сходные данные были получены в зарубежных исследованиях [15, 16].
Медиана ВБП при наличии ДОК в КМ составила 6,03, в отсутствие – 9, 2 месяца, медиана ОВ – 11,67 и 22,5 месяца соответственно. Несмотря на малочисленность групп, разница статистически достоверна.
Всем больным в исследовании была проведена комбинированная ХТ по одной и той же схеме, что исключает возможность искажения отдаленных результатов лечения с разной эффективностью различных схем.
Таким образом, полученные данные свидетельствуют о том, что наличие ДОК в КМ больных диссеминированным РЖ является фактором неблагоприятного прогноза выживаемости пациентов.



