Таргетная терапия для лечения меланомы кожи (МК) берет свое начало в 2011 г., когда впервые было получено увеличение общей продолжительности жизни пациентов с метастатической меланомой кожи (мМК) при использовании ингибитора BRAF (BRAFi) вемурафениба по сравнению со стандартной химиотерапией дакарбазином [1]. Хорошо известно, что мМК характеризуется неблагоприятным прогнозом. Медиана общей продолжительности жизни при проведении химиотерапии варьируется от 6 до 9 месяцев [2]. Однако благодаря развитию молекулярной биологии и усилиям исследователей в области иммунологии в лечении мМК появилось два новых класса препаратов (таргетные и иммуноонкологические), которые существенно влияют как на общую выживаемость (ОВ) пациентов, на выживаемость без прогрессирования (ВБП), так и на частоту объективного ответа (ЧОО).
Для решения вопроса о возможности использования таргетной терапии в отношении пациентов с мМК обязательно определение мутации BRAF. Данный онкоген кодирует молекулу, участвующую в передаче пролиферативного сигнала с тирозинкиназных рецепторов, расположенных на мембране, к ядру. Самой частой мутацией в гене BRAF при МК является мутация V600E – замена аминокислоты валин на глутамин, что приводит к увеличению киназной активности фермента BRAF по отношению к нижестоящей киназе MEK во внутриклеточном пути передачи сигнала. Помимо мутации V600E могут встречаться и другие мутации: V600K (замена валина на лизин), V600R (валина на аргинин), V600D (валина на аспарагиновую кислоту), V600M (валина на метионин). Так, по данным Lovly C.M. и соавт., фактически среди мутаций BRAF V600 79%, 12%, 5% и 4% были мутации V600E, V600K, V600R и V600M соответственно [3]. Наиболее часто данный вид мутации встречается у пациентов с МК, возникшей на коже без хронического солнечного повреждения («отпуск на пляже»).

При наличии мутации в гене BRAF используют препараты, блокирующие BRAF в монорежиме (вемурафениб, дабрафениб) или в комбинации с препаратами, блокирующими нижележащую киназу МЕК (траметиниб, кобиметиниб). В данной статье мы представим подробный обзор данных по комбинированной таргетной терапии вемурафенибом (BRAFi) и кобиметинибом (MEKi) пациентов с мМК c мутацией BRAF V600.
Исследование coBRIM является регистрационным исследованием III фазы, в котором сравнивали комбинацию вемурафениб плюс кобиметиниб (В+К) с монотерапией вемурафенибом. Это двойное слепое рандомизированное (1:1) плацебо-контролируемое мультицентровое исследование, куда были включены (рандомизированы) 495 пациентов. Группу вемурафениба плюс плацебо составили 248 пациентов и 247 пациентов – группу вемурафениб плюс кобиметиниб. Группы пациентов были хорошо сбалансированы по характеристикам (табл. 1). Первичная цель исследования – оценить ВБП по оценке исследователей, вторичные – ОВ, ЧОО, продолжительность ответа, ВБП по оценке независимого комитета, безопасность, а также качество жизни. Обновленный анализ ВБП и частоты ответа (срез данных 16.01.2015) был проведен при медиане наблюдения 14,2 месяца. Обновленная медиана ВБП по оценке исследователей составила 12,3 месяца (95% ДИ – 9,5–13,4) для группы комбинированной терапии В+К по сравнению с 7,2 месяца (5,6–7,5) для группы вемурафениба и плацебо (ОР – 0,58 [95% ДИ – 0,46–0,72], p<0,0001). Частота объективного ответа в группе В+К составила 70% по сравнению с 50% в группе вемурафениб плюс плацебо (табл. 2).

Во время проведения протокол-специфичного финального анализа ОВ (срез данных от 28.08.2015 при наступлении 255 событий [52%]) медиана наблюдения за пациентами составила 18,5 месяцев. Комбинация В+К значительно увеличивала ОВ пациентов по сравнению с группой вемурафениба. Медиана ОВ составила 22,3 месяца (95% ДИ – 20,3–NE) по сравнению с 17,4 месяца (95% ДИ – 15,0–19,8) для пациентов, получавших вемурафениб (ОР – 0,70 [95% ДИ – 0,55–0,90]; p=0,005). Однолетняя ОВ составила 74,5% для группы комбинированной терапии В+К (95% ДИ – 68,9–80,2) и 63,8% (57,6–70,0) для группы вемурафениба; 2-летняя ОВ – 49,1% (41,4–55,2) и 38,6% (31,3–44,7) соответственно (рис. 1).
Профиль безопасности для группы В+К был переносимым и управляем. Нежелательные явления (НЯ), связанные с лечением, наблюдались у 241 (98%) пациента группы В+К и у 233 (95%) – группы вемурафениба. При этом НЯ 3-й и более степеней выраженности наблюдались у 147 (60%) и у 128 (52%) пациентов соответственно. Наиболее частыми НЯ 3–4-й степени в группе В+К по сравнению с группой вемурафениба было увеличение γ-глутамилтрансферазы (36 [15%] в группе В+К против 25 [10%] в группе плацебо и вемурафениб), увеличение креатинфосфокиназы сыворотки крови (30 [12%] против 1 [<1%]) и увеличение АЛТ (аланинаминотрансфераза) (28 [11%] против 15 [6%]).

Лечение по причине развития НЯ было остановлено в отношении 52 (11%) из 493 пациентов, включая 35 (14%) из 247 в группе В+К и 17 (7%) в группе вемурафениба. В группе комбинированной терапии В+К у 87 (35%) доза вемурафениба была редуцирована из-за НЯ и у 75 (30%) пациентов была редуцирована доза кобиметиниба.
В группе вемурафениб+плацебо у 72 (29%) из 246 пациентов была редукция дозы вемурафениба и у 27 (11%) – редукция плацебо.
В исследовании coBRIM пациенты получали первую линию терапии. Те пациенты, у которых было зарегистрировано прогрессирование заболевания, в последующем получали различные виды терапии (табл. 3), включая химио-, иммуноонкологическую терапию, а также таргетную терапию. Наиболее часто пациенты обеих групп получали в последующем иммунотерапию в 42% и 37% соответственно. Одним из самых часто назначаемых иммуноонкологических препаратов был ипилимумаб (табл. 3).

Исследование BRIM7 – исследование Ib-фазы, на основании результатов которого было инициировано исследование III фазы coBRIM в связи с высокими показателями эффективности терапии и удовлетворительной переносимостью. В данное исследование вошли две группы пациентов: 1) пациенты, ранее не получавшие вемурафениб (BRAFi-naive); 2) пациенты с прогрессированием заболевания на фоне терапии вемурафенибом непосредственно перед включением в исследование (BRAFi-PD).
В исследование BRIM7 были включены 129 пациентов: 66 – в группу BRAFi- PD и 63 – в группу BRAFi-naive. Поскольку это исследование Ib-фазы, то первое, что изучали исследователи – максимально переносимую дозу кобиметиниба в сочетании с вемурафенибом и дозолимитирующую токсичность. Эффективность терапии была второй ключевой целью данного исследования. Пациенты получали вемурафениб в дозе 720 мг или 960 мг 2 раза в сутки непрерывно перорально и кобиметиниб в дозе 60 мг, 80 мг и 100 мг однократно в сутки перорально, либо 14 дней приема и 14 дней отдыха (14/14), либо 21 день приема и 7 дней отдыха (21/7), либо постоянно (28/0).

Дозолимитирующая токсичность наблюдалась более 7 дней у 4 пациентов (слабость 3-й степени при дозе 960 мг 2 раза перорально+80 мг один раз в день перорально 14/14; удлинение интервала QTc при дозе 960 мг 2 раза в сутки перорально+60 мг один раз в день перорально 21/7; стоматит 3-й степени и миалгия/артралгия при дозе 960 мг 2 раза в сутки перорально+60 мг один раз в день перорально 28/0). Дозовый режим, который был выбран для исследования III фазы coBRIM – вемурафениб 960 мг 2 раза в сутки перорально непрерывно+ кобиметиниб 60 мг один раз в сутки перорально 21/7. В исследовании BRIM7 ЧОО составила 15% в группе BRAFi-PD и 87% (включая 15% полных ответов) в группе BRAFi-naive. Медиана ВБП составила 2,8 (95% ДИ – 2,6–3,4) и 13,7 месяца (95% ДИ – 10,1–17,5) соответственно [4]. При проведении последующего анализа (срез данных от 15.09.2015) медиана наблюдения составила 26 и 8 месяцев соответственно. Подтвержденная ЧОО в группе BRAFi-naive составила 87%, при этом число полных ответов увеличилось до 19% за счет двух пациентов, у которых полный ответ (из частичных ответов) был зарегистрирован на 31-м и 34-м месяцах терапии. Медиана ВБП в группе BRAFi-naive составила 13,8 месяца в группе BRAFi-PD 2,8 месяца (рис. 2). Медиана ОВ 31,2 и 8,5 месяцев соответственно. Показатели одно-, двух-, трехлетней ОВ для группы BRAFi-naive составили 83, 64%, и 37% соответственно. В то время как для группы BRAFi-PD двухлетняя ОВ составила всего лишь 17% [5]. Обновленные данные (срез данных от 26.04.2016) ОВ были представлены в ноябре 2016 г., где четырехлетняя ОВ составила 35,9% (21,9–50,0) [6].
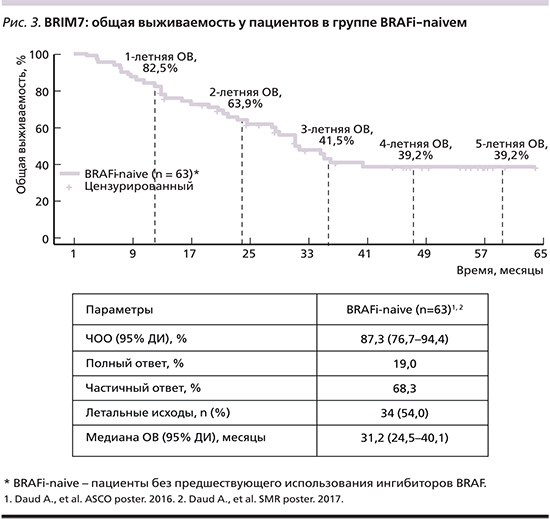
Последнее обновление результатов исследования BRIM7 было представлено в октябре 2017 г., где пятилетняя ОВ оказалась равной четырехлетней ОВ – 39,2% (25,8–52,5) (срез данных от 10.07.2017). При этом медиана ОВ увеличилась с 31,2 (срез данных от 2016 г.) до 31,8 месяца (срез данных от 10.07.2017) (рис. 3) [7]. Остальные данные остались без изменений. Сводные данные результатов комбинированной терапии В+К на основании двух исследований представлены в табл. 4.
Заключение
За последние несколько лет с момента регистрации FDA (Управление по контролю качества пищевых продуктов и лекарственных средств, США) в 2011 г. первого BRAFi вемурафениба появилось еще несколько BRAF и МЕК-ингибиторов. В данной статье мы подробно остановились на возможностях комбинированной терапии В+К для пациентов с мМК. Около 50% пациентов группы комбинированной терапии В+К в исследовании coBRIM имели фактор неблагоприятного прогноза – повышенный уровень ЛДГ. Несмотря на это, показатели медианы ВБП и медианы ОВ остаются высокими, что еще раз подчеркивает возможность использования комбинированной таргетной В+К-терапии у пациентов с повышенным уровнем ЛДГ.
Исследование BRIM7 представляет очень большой интерес в связи с наличием группы ранее предлеченных BRAFi пациентов (BRAFi-PD). На сегодняшний день в России, отчасти в связи с тем что BRAFi были зарегистрированы ранее, в 2013 г., существует ряд пациентов, которые получают монотерапию BRAFi. И ни одно исследование, кроме BRIM7, не дает ответа на вопрос: нужно ли добавлять MEKi к монотерапии BRAFi пациенту с мМК, у которого зарегистрировано прогрессирование заболевания? Мы видим, что добавление MEKi к терапии BRAFi в случае прогрессирования заболевания дает лишь незначительную прибавку ВБП у части пациентов. Поэтому при планировании лечебной тактики для пациента с мМК с мутацией BRAF-V600 оптимально начинать сразу с комбинации BRAFi и MEKi. Кроме того, исследование BRIM7 продемонстрировало один из лучших показателей медианы ОВ для комбинации BRAFi и MEKi – 31,8 месяца с пятилетней ОВ, равной 39,2%. При этом поздние полные ответы на терапию (на 31-м и 34-м месяцах лечения) демонстрируют и подтверждают противоопухолевую активность не только в первые месяцы лечения.



