На основании многолетнего опыта клиники НИИ медицинской микологии им. П.Н. Кашкина СЗГМУ им. И.И. Мечникова и проведения эндоскопических исследований пищевода можно сделать вывод, согласно которому визуальная диагностика кандидозного и эозинофильного эзофагитов сопряжена со значительными трудностями. Они обусловлены макроскопической картиной эзофагитов с наличием т.н. белых налетов, характерных для обоих вариантов воспаления пищевода. Однако точность и своевременность постановки правильного диагноза имеют первостепенное значение, т.к. лечебная тактика и прогноз этих заболеваний принципиально различаются. Следует указать, что морфологическое исследование биоптатов слизистой оболочки пищевода остается «золотым» стандартом в постановке диагноза.
Кандидозный эзофагит (КЭ) обусловлен инвазией микромицетов рода Candida в эпителий и стенку пищевода пациентов с различными проявлениями иммунодефицитов. Обычно это больные СПИД, некомпенсированным сахарным диабетом, получающие терапию глюкокортикостероидами (ГКС), цитостатиками и иммуносупрессорами. Такие пациенты жалуются на дисфагию, одинофагию (боль при глотании), ретростернальный дискомфорт, кашель и наличие белых творожистых налетов на языке и слизистой оболочке ротоглотки. По оценочным данным, в Российской Федерации только в группе ВИЧ-инфицированных насчитывается не менее 11 тыс. пациентов, страдающих рецидивирующим кандидозом пищевода [1].
Эозинофильный эзофагит (ЭЭ) – хроническое воспаление пищевода, опосредованное эозинофилами, с симптомами дисфункции пищевода (преимущественно дисфагия и боль в грудной клетке). ЭЭ чаще болеют мужчины (соотношение мужчины/женщины 3:1). При тщательном обследовании у 60–90% пациентов выявляется аллергия к аэроаллергенам и/или пищевым аллергенам [2]. Среди жалоб больных ЭЭ преобладают нарушения глотания, загрудинные боли, икота. Особенности лечения ЭЭ заключаются в том, что они резистентны к терапии ингибиторами протонной помпы (ИПП), антацидами и всеми антигистаминными препаратами. Наибольшую опасность для пациентов с ЭЭ представляет спонтанная перфорация пищевода [3].
Рефлюксный эзофагит (РЭ) обусловлен повреждением преимущественно нижнего отдела пищевода, вызываемым спонтанным и регулярным забросом в пищевод желудочного или кишечного содержимого. Причин РЭ несколько: снижение тонуса нижнего пищеводного сфинктера и способности пищевода к самоочищению; неспособность слизистой оболочки противостоять повреждающему действию забрасываемого рефлюктанта; нарушение опорожнения желудка; повышение внутрибрюшного давления.
Клинически РЭ чаще проявляется изжогой, кислой или горькой отрыжкой. Выраженная недостаточность кардии – нижнего пищеводного сфинктера – проявляется симптомом «завязывания шнурков»: в этом случае происходит заброс желудочного содержимого при наклонах туловища.
Диагностика РЭ основана на результатах эндоскопического исследования, реже применяют суточное мониторирование кислотности пищевода, манометрическое исследование пищеводного сфинктера, совместную импеданс-рН-метрию пищевода.
В практической работе важно учитывать, что при РЭ возможны и внепищеводные респираторные проявления. Это прежде всего рефлюкс-ассоциированный кашель, рефлюкс-ассоциированный ларингит и рефлюкс-ассоциированная бронхиальная астма. Известно, что у ряда пациентов после правильно проведенного лечения РЭ исчезают или редуцируются такие симптомы, как кашель, охриплость голоса, приступы удушья. В то же время перечисленные симптомы служат довольно частой причиной обращения за медицинской помощью.
Принято выделять два основных механизма кашля, вызываемого желудочно-пищеводным рефлюксом. Во-первых, это стимуляция пищеводно-трахеобронхиального рефлекса раздражающим воздействием желудочного содержимого на вагусные рецепторы абдоминального отдела пищевода. Во-вторых, активация кашлевого рефлекса при аспирации содержимого пищевода [4].
При обследовании пациентов без иммунодефицита, страдавших хроническим непродуктивным кашлем неясной этиологии продолжительностью более 3 недель, группа исследователей показала, что синдром постназального бронхиального затека, бронхиальная астма и гастроэзофагеальная рефлюксная болезнь были причиной кашля в 86% случаев [5]. А среди взрослых некурящих пациентов, имевших нормальную рентгенограмму органов грудной клетки и не получавших ингибиторы ангиотензинпревращающего фермента, этот показатель возрастал до 99,4%. У таких больных гастроэзофагеальный рефлюкс был причиной кашля в 40% случаев. В целом РЭ является причиной кашля с мокротой в 15% случаев [6].
Cовокупный показатель распространенности ЭЭ в странах Европейского Союза составляет около 35 на 100 тыс. населения [3]. Если взять эти эпидемиологические данные за основу, можно предположить, что в Санкт-Петербурге проживают около 1800 таких пациентов. Терапевтический эффект от назначения антигистаминных препаратов больным ЭЭ отсутствует. Поздняя диагностика и неадекватная терапии приводят к стриктуре и перфорации пищевода. Современный план лечения пациентов с ЭЭ включает индивидуальную элиминационную диету (преимущественно исключают молоко, сою, пшеницу, яйца, орехи и креветки). Методом выбора при терапии ЭЭ является пероральный прием топических ГКС (флутиказон или будесонид) 2 мг/сут в течение 2–3 недель; при хорошем эффекте доза ГКС снижается, но лечение продолжается не менее одного года. В отсутствие топических ГКС показан преднизолон 50 мг/сут, при осложнениях – дилатация, на стадии клинических испытаний находится препарат, блокирующий интерлейкин-13.
Критерии диагностики ЭЭ: обнаружение ≥15 эозинофилов в поле зрения (увеличение ×400) в биоптатах пищевода, полученных от пациента, получавшего 8-недельную (!) терапию ИПП (например, рабепразол или пантопразол) в стандартной дозе. Важно подчеркнуть, что пациент должен продолжать получать терапию ИПП на момент получения биоптатов (!). Необходимо 4 биоптата из дистальных отделов пищевода, 4 – из проксимальных и дополнительно – из зоны «белых экссудатов» [2, 3].
 Известно, что длительная терапия ГКС приводит к многочисленным и серьезным побочным лекарственным эффектам. Следовательно, ответственность за своевременность и правильность диагноза крайне высоки и указанные выше правила дифференциальной диагностики должны соблюдаться очень тщательно.
Известно, что длительная терапия ГКС приводит к многочисленным и серьезным побочным лекарственным эффектам. Следовательно, ответственность за своевременность и правильность диагноза крайне высоки и указанные выше правила дифференциальной диагностики должны соблюдаться очень тщательно.
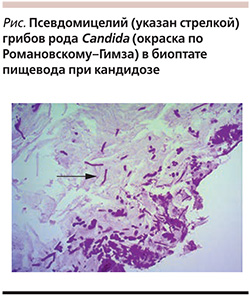
Критерием диагноза кандидоза слизистых оболочек является обнаружение нитевидной формы микромицетов Candida (псевдомицелий) в морфологическом препарате (см. рисунок). Терапия флуконазолом в дозе 3 мг/кг/сут в течение 2–3 недель большинство пациентов приводит к излечению.
В случае флуконазол-резистентного возбудителя КЭ терапию проводят пероральным раствором итраконазола 200 мг/сут или парентеральным введением вориконазола (внутривенно 6 мг/кг/сут каждые 12 часов в первый день, а затем 4 мг/кг/сут каждые 12 часов), или суспензией позаконазола 400 мг (10 мл) 2 раза в день внутрь во время еды, или каспофунгином (внутривенно 70 мг/сут в первый день, затем 50 мг/сут за одно введение), или микафунгином 150 мг/сут внутривенно, или анидулафунгином 200 мг/сут внутривенно, или внутривенным капельным введением амфотерицина В в дозе 0,3–0,7 мг/кг/сут.
С учетом вышеизложенного необходимо подчеркнуть важность практических подходов, направленных на диагностику и дифференциальную диагностику эзофагитов в практике аллерголога-иммунолога.
Выводы
- При выявлении рефлюкс-эзофагита необходимо консультирование пациента гастроэнтерологом с целью подбора терапии ИПП.
- При выявлении кандидоза пищевода необходимо назначение флуконазола 150–200 мг/сут в течение 2–3 недель с последующим контролем излеченности и рецидивирования. КЭ, обусловленный резистентными к флуконазолу видами гриба, может быть излечен итраконазолом, вориконазолом, позаконазолом, микафунгином, каспофунгином или амфотерицином В. Однако с учетом многочисленных сложностей при выборе в этом случае антифунгального препарата целесообразна консультация клинического миколога. При рецидивирующем характере кандидоза пищевода требуется противорецидивное лечение: обычно флуконазол 200 мг еженедельно. Длительность такой терапии определяется характером факторов, влияющих на систему антифунгальной резистентности пациента.
- Установление диагноза ЭЭ возлагает большую ответственность на врача, т.к. назначение системных ГКС на длительный срок требует тщательного обоснования. Желательно заключение консилиума трех специалистов – аллерголога-иммунолога, гастроэнтеролога и морфолога. Решение о прекращении терапии или коррекции дозы ГКС также должно приниматься коллегиально.
- При ЭЭ важно подчеркнуть отсутствие эффекта и необоснованность назначения антигистаминных препаратов.



