Цереброваскулярная болезнь (ЦВБ) одна из важнейших проблем медицины социальной и экономической значимости во всем мире, что обусловлено высокой заболеваемостью, инвалидизацией и смертностью. Росту числа случаев заболеваний способствуют многие причины, в т.ч. старение населения планеты. Профилактика, лечение и реабилитация ЦВБ невозможны без учета факторов ка, влияющих на возникновение и течение заболевания [1, 2]. Выявление некорригируемых факторов риска, к которым относят возраст, пол, недостаточную массу тела при рождении, этническую принадлежность, генетическую предрасположенность, позволяет идентифицировать лиц с высоким риском развития ЦВБ. К корригируемым факторам риска ЦВБ относятся артериальная гипертензия (АГ), церебральный атеросклероз, психоэмоциональные перегрузки, хронический стресс, дислипопротеинемия, метаболический синдром, фибрилляция предсердий, поражение магистральных сосудов головы, гемостатические нарушения, злоупотребление алкоголем, курение, избыточная масса тела, прием комбинированных оральных контрацептивов и др. [3, 4].
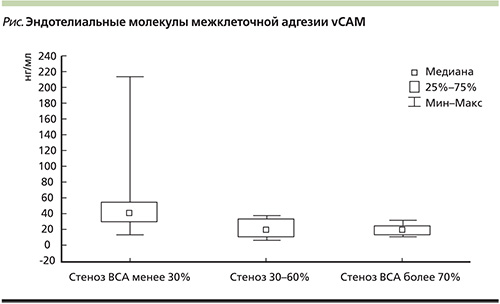
Эти патологические состояния, особенно АГ и атеросклероз сосудов, приводят к развитию хронической гипоперфузии мозга. Постепенно эластичность сосудов снижается, развивается жесткость артериальной стенки. При определении нами индекса жесткости на диагностическом приборе Ангиоскан отмечалось увеличение жесткости сосудистой стенки в зависимости от выраженности стеноза. Так, в группе пациентов со стенозом до 30% показатель составлял 7,5+0,2, со стенозом 30–70% – 9,0+0,1; со стенозом более 70% – 9,1+0,2 (при норме – 5–8 м/с) На этом фоне формирующиеся гипоксия тканей головного мозга, дефицит глюкозы приводят к развитию ишемического каскада. При ишемии избирательно нарушаются механизмы синаптической передачи, увеличивается внеклеточная концентрация γ-аминомасляной кислоты и глутамата, уменьшается синтез дофамина и норадреналина. Нарушается ауторегуляция мозгового кровотока, развивается вазоспазм, усиливается агрегация тромбоцитов и формируется внутрисосудистый стаз, что в свою очередь усугубляет ишемию. Увеличение содержания внутриклеточного кальция, снижение синтеза окиси азота, образование свободных радикалов приводят к прогрессированию патологического процесса. Одним из важнейших механизмов патогенеза ЦВБ является дисфункция эндотелия. Эндотелий вырабатывает биологически активные вещества, играющие важную роль. Большое значение придается оксиду азота, который синтезируется из L-аргинина при участии эндотелиальной NO-синтазы. При дисфункции эндотелия биодоступность оксида азота снижается, местные воспалительные реакции способствуют патологической перестройке сосудистой стенки. Проведенное нами изучение эндотелиальной функции с помощью определения количества эндотелиальной молекулы межклеточной адгезии vCAM выявило, что сосудистое воспаление более выражено в начале формирования атеросклеротической бляшки (см. рисунок). Это вызывает агрегацию и адгезию тромбоцитов, нарушает регуляцию сосудистого тонуса в сторону вазоконстрикции, увеличивает образование свободных радикалов. Повышение агрегационной способности тромбоцитов служит одной из причин развития острой церебральной ишемии [3–5].
АГ, атеросклероз церебральных и прецеребральных артерий, нарушение системного кровообращения – самые распространенные причины ЦВБ, полиморфность клинической картины определяется сложностью патогенетических механизмов. Выделяют острые и хронические формы ЦВБ. К острым формам относят инсульт и преходящее нарушение мозгового кровообращения, к хроническим – хроническую ишемию мозга (ХИМ), медленнопрогрессирующую недостаточность кровоснабжения головного мозга, приводящую к развитию множественных очагов некроза в головном мозге. При собственном наблюдении за 33 больными (15 женщин и 18 мужчин) в возрасте от 41 года до 64 лет (средний возраст 52,9+5,7 года) с АГ (средняя длительность заболевания – 4,2+2,4 года) были сделаны выводы, что когнитивные расстройства (КР) являются одним из проявлений поражения головного мозга как органа-мишени артериальной гипертонии, встречаются не менее чем у 73,7% пациентов с артериальной гипертонией, в большинстве случаев являются легкими (46,7%), реже – умеренными (26,7%). Так, при I cтадии КР носят субсиндромальный характер, отмечаются нарушение концентрации внимания, трудность переключения с одной деятельности на другую, рассеянность, но интеллект не страдает. Типичны головная боль, головокружение, шум в голове, вегетативная дисфункция, астенические проявления, диапазон которых может быть от легких в виде повышенной утомляемости, слабости, раздражительности, слабодушия, снижения работоспособности до формирования астенического синдрома. При осмотре выявляется рассеянная неврологическая симптоматика в виде легкой асимметрии носогубных складок, девиации языка, анизорефлексии, нарушения конвергенции. ЦВБ имеет неуклонно прогредиентный характер. Во II стадии КР усугубляются; ухудшается мыслительная продукция, волевая активность, трудоспособность, профессиональная память; отмечается вязкость мышления, сужение круга интересов, снижение критики и изменение личности. Рассеянная неврологическая симптоматика постепенно формируется в неврологический синдром. Появляются тревожные расстройства. Нарушаются циркадианные ритмы в виде дневной сонливости и неполноценном ночном сне. Для III стадии характерно несколько неврологических синдромов, грубые КР, аффективные нарушения, протрагированные депрессивные реакции. Изменение социального статуса больного, потеря трудоспособности, психические нарушения могут приводить к развитию деменции [5, 6].
Стрессовые ситуации, травмы, инфекции, интоксикации способствуют колебанию артериального давления, ишемии головного мозга, энергодефициту, окислительному стрессу и дестабилизации ЦВБ, что определяет тип течения. При ремитирующем течении ЦВБ эпизоды декомпенсации чередуются с компенсацией, при медленнопрогредиентном – эпизоды декомпенсации редкие, при быстропрогредиентном – злокачественный тип прогрессирования [6, 7].
Диагноз ХИМ ставится на основании клинической картины с учетом результатов обследования: биохимического анализа крови, ультразвуковой допплерографии сосудов шеи, магнитно-резонансной томографии головного мозга [6, 7].
Принципы медикаментозного лечения
Сложность патогенетического механизма развития ЦВБ определяет тактику терапии. ЦВБ имеет неуклонный тип прогрессирования. Целью лечения ЦВБ является стабилизация патологических процессов, способствующих развитию ишемического каскада, оксидативного стресса, дисфункции эндотелии, а также активация саногенетических механизмов компенсации функций, терапия основных фоновых заболеваний. В задачи терапии ЦВБ входят профилактика первичного и повторного инсульта, замедление темпов прогрессирования КР. Алгоритм терапии включает несколько этапов: нормализацию перфузии мозга путем воздействия на разные уровни сердечно-сосудистой системы и влияние на тромбоцитарное звено гемостаза. Обязательными остаются лечение соматического заболевания, вызвавшего развития ЦВБ, нарушение липидного профиля, применение антиагрегантов [6, 7].
Антиагрегантная терапия – ключевая стратегия первичной и повторной профилактики ЦВБ. Рекомендуют назначать ее как можно раньше и проводить длительно, нередко – пожизненно. Существует несколько классов антиагрегантов.
Ацетилсалициловая кислота (АСК) относится к ингибиторам циклооксигеназы (ЦОГ). АСК ингибирует в тромбоцитах и мегакариоцитах ЦОГ-1 и ЦОГ-2, что приводит к подавлению синтеза простациклина и простагландинов, в т.ч. тромбоксана А2, вазоконстриктора и стимулятора агрегации тромбоцитов. Применение АСК ассоциировано с развитием побочных эффектов: гастро- и энтеропатий, образованием язв, кровотечений. Назначение высоких доз АСК ограничено сохраняющимся высоким риском развития гастропатий, кровотечений, аллергических реакций, а также наличием у 15–20% больных выраженной резистентности к АСК. В связи с необходимостью проведения длительной, а иногда пожизненной антиагрегантной терапии целесообразно назначение комбинированной терапии низких доз АСК с другим классом антиагрегантов.
Дипиридамол – эффективный антиагрегантный препарат, производное пиримидина, активатор аденилатциклазы, повышает образование простоциклина, который обладает антиадгезивными свойствами в тромбоцитах и гладкомышечных клетках сосудистой стенки. Под влиянием аденилатциклазы из АТФ синтезируется циклический аденозинмонофосфат (цАМФ), выполняющий в организме роль вторичного посредника, необходимого для внутриклеточного распространения сигналов веществами, которые не могут проходить через клеточную мембрану, например, гормонов, глюкагона или адреналина. Циклический АМФ вызывает активацию двух типов протеинкиназ в цитоплазме клетки, ведущих к фосфорилированию многочисленных внутриклеточных белков. Это повышает или снижает проницаемость мембран, активность и количество ферментов, т.е. вызывает типичные для гормона метаболические и, соответственно, функциональные сдвиги жизнедеятельности клетки [10, 11].
Антагонисты аденозиновых рецепторов, к которым относятся тиклопидин, ингибируют фосфолипазу С, что приводит к вызываемому аденозинфосфатом обратимому торможению связывания тромбоцитов с фибриногеном и подавляет агрегацию тромбоцитов. Препарат имеет ряд побочных эффектов, которые ограничивают его применение: эрозивно-язвенные поражения желудочно-кишечного тракта, кожная сыпь, нейтропения, тромбоцитопения и тромбоцитопеническая пурпура [8, 9]. Кроме этого тиклопидин может подавлять гранулоцитарный росток кроветворения, а также повышать уровень холестерина крови. Описаны единичные случаи тромбоцитопении и апластической анемии.
В настоящее время тиклопидин вытесняется препаратом клопидогрел, который дает меньше побочных эффектов и не требует контроля показателей крови.
Учитывая разные точки приложения и механизмы действия препаратов с антиагрегантным действием, для достижения большего эффекта торможения агрегации оправданно комбинированное использование антитромбоцитарных средств. Однако комбинация АСК и клопидогрела из-за высокого риска кровотечения может быть рекомендована с большой осторожностью ограниченному числу больных для профилактики инсульта.
В четырех крупных международных клинических исследованиях была подтверждена эффективность комбинации низких доз аспирина (50–150 мг/сут) с другими классами антиагрегантов, в частности с дипиридамолом. Наблюдение за 6600 пациентами с цереброваскулярными заболеваниями, которые в течение 2 лет принимали комбинированную форму дипиридамола с аспирином, содержавшую 25 мг АСК и 200 мг дипиридамола, позволило констатировать двукратное уменьшение частоты повторных цереброваскулярных эпизодов по сравнению с таковыми у лиц, принимавших лишь аспирин. Так, исследование ESPS-I (The European Stroke Prevention Study) было проведено в европейских странах в течение 2 лет с участием 2500 пациентов. Сравнили эффективность дипиридамола в дозе 75 мг 3 раза в сутки и АСК 325 мг по сравнению с плацебо. Другое исследование, ESPS-II, было проведено в европейских странах в течение 2 лет с участием 6602 пациентов. Изучались различные режимы назначения антиагрегантов: АСК 25 мг 2 раза в сутки; дипиридамол 200 мг 2 раза в сутки; АСК 25 мг+дипиридамол 200 мг 2 раза в сутки; плацебо. Исследование ESPRIT проводилось в европейских странах и в Австралии в течение 3,5 лет с участием 2739 пациентов. Изучалась эффективность монотерапии АСК 75 мг/сут и комбинации АСК 75 мг/сут и дипиридамола 200 мг 2 раза в сутки. Исследование PRoFESS проведено в 35 странах, включая Россию, Европу, США, Канаду, Южную Америку и страны Юго-Восточной Азии, в течение 2,5 лет с участием 20 332 пациентов. Сравнивалась эффективность АСК 25 мг и дипиридамола 200 мг 2 раза в сутки с клопидогрелом 75 мг/сут.
Результаты клинических исследований показали, что применение комбинации АСК и дипиридамола снизила риск транзиторной ишемической атаки на 35,9%, инсульта – на 37%, смерти от инсульта – на 24,4%.
Проведенные многочисленные исследования выявили комплексный механизм действия дипиридамола:
- Антиагрегационный – препарат нормализует соотношение простациклин–тромбоксан А2, ингибирует фосфодиэстеразу тромбоцитов и снижает в них уровень кальция, уменьшает агрегацию тромбоцитов и тормозит тромбообразование.
- Антиадгезивный – уменьшает агрегацию тромбоцитов и увеличивает их деформируемость за счет нормализации соотношения простациклина и тромбоксана.
- Ангиопротективный – стимулирует аденозиновые рецепторы, увеличивает плотность капилляров и стимулирует образование новых капилляров и коллатеральных артерий.
- Вазодилатирующий – активирует синтез простациклина эндотелием сосудистой стенки, усиливает синтез эндотелиального оксида азота (NO).
- Иммуномодулирующий – как производное пиримидина, дипиридамол является индуктором интерферона и оказывает модулирующее действие на функциональную активность системы интерферона и повышает неспецифическую противовирусную резистентность к вирусным инфекциям.
Существует многолетний опыт применения дипиридамола в разных терапевтических областях, в т.ч. в акушерской практике у беременных с высоким риском плацентарной недостаточности, гестозом, экстрагенитальными заболеваниями, а также у женщин с высоким риском тромбообразования, включая антифосфолипидный синдром. Имеются данные о применении дипиридамола для профилактики артериальных и венозных тромбозов после операции по протезированию клапанов сердца. Большим преимуществом дипиридамола является отсутствие ульцерогенного действия в отличие от АСК, механизм которого связан с ингибированием синтеза простагландинов, что особенно важно для длительного применения.
Дипиридамол выпускается в виде таблеток по 25 и 75 мг, покрытых оболочкой. Доза подбирается индивидуально. Таблетки принимают внутрь натощак, запивая небольшим количеством воды. Длительность курса терапии определяется врачом.
Таким образом, дипиридамол рекомендован для лечения и профилактики нарушений мозгового кровообращения по ишемическому типу.



