Рекомендации 2016 г. по лечению дислипидемий: что важно знать практику
Новые рекомендации по лечению дислипидемии [2] написаны в ключе, удобном для практических докторов. Для того чтобы принять решение относительно инициации гиполипидемической терапии и определить целевые уровни липопротеидов низкой плотности (ЛПНП), необходимо соотнести уровень сердечно-сосудистого риска и исходный уровень ЛПНП.
Риск ранжируется следующим образом:
- Очень высокий риск:
- Документированное сердечно-сосудистое заболевание (ССЗ). Острый инфаркт миокарда (ОИМ), острый коронарный синдром (ОКС), операция аортокоронарного шунтирования (АКШ) и другие процедуры по реваскуляризации, транзиторная ишемическая атака (ТИА), заболевание периферических артерий в анамнезе. Кроме того, к очень высокому риску относятся четкие указания на наличие признаков ССЗ, предрасполагающих к сердечно-сосудистым катастрофам (ССК), по данным методов визуализации (например, выраженное атеросклеротическое поражение коронарных артерий по данным коронарографии или сонных артерий по данным ультразвука).
- Сахарный диабет (СД) с поражением органов-мишеней (например, в сочетании с протеинурией) или в сочетании с курением или дислипидемией.
- Умеренно выраженная хроническая болезнь почек (скорость клубочковой фильтрации [СКФ] <30 мл/мин/1,73 м2).
- Десятилетний риск фатальных ССК, рассчитанный по SCORE (Systematic COronary Risk Evaluation), >10%.
- Высокий риск:
- Значительное повышение уровня одного из факторов риска, в особенности уровень холестерина >8 ммоль/л (в т.ч. при семейной гиперхолестеринемии) или уровень артериального давления ≥180/110 мм рт.ст.
- Большинство пациентов с СД.
- Умеренно выраженная хроническая болезнь почек (СКФ – 30–59 мл/мин/1,73 м2).
- Десятилетний риск фатальных ССК, рассчитанный по SCORE ≥5% и <10%.
- Средний риск:
- Десятилетний риск фатальных ССК, рассчитанный по SCORE ≥1% и <5%.
- Низкий риск:
- Десятилетний риск фатальных ССК, рассчитанный по SCORE, менее 1%.
Для того чтобы выбрать тактику лечения, нужно соотнести уровни риска и ЛПНП, воспользовавшись следующей таблицей (см. таблицу).
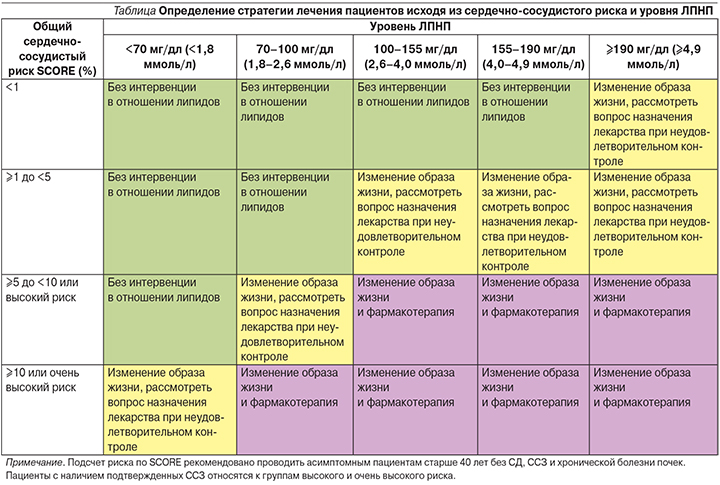
Уровень ЛПНП служит ключевым целевым показателем при определении интенсивности лекарственной терапии дислипидемии.
В отношении пациентов очень высокого риска необходимо добиваться снижения уровня ЛПНП менее 1,8 ммоль/л (70 мг/дл) или снижения уровня ЛПНП на 50% (в том случае если исходный уровень ЛПНП находится в пределах 1,8–3,5 ммоль/л).
Пациентам высокого риска необходимо добиваться снижения уровня ЛПНП менее 2,6 ммоль/л (100 мг/дл) или снижения уровня ЛПНП на 50% (если исходный уровень ЛПНП находится в пределах 2,6–5,2 ммоль/л).
Целевые показатели ЛПНП при среднем и низком рисках составляют менее 3,0 ммоль/л.
В качестве вторичной цели в рекомендациях указывается уровень холестерина, не входящего в состав липопротидов высокой плотности (ЛПВП), т.н. не-ЛПВП (рассчитывается как разность между уровнем общего холестерина и холестерина ЛПНП), который особенно удобно использовать пациентам с гипертриглицеридемией.
В рекомендациях особенно подчеркивается, что уровень ЛПНП нередко не отражает злокачественной природы дислипидемии у пациентов с СД и метаболическим синдромом, для которых характерно увеличение мелких плотных ЛПНП, снижение функциональности ЛПВП, ремнантов триглицерид-содержащих липопротеидов и проч. Поэтому при ведении пациентов с СД также желательно ориентироваться на уровни не-ЛПВП (менее 3,4 ммоль/л для пациентов высокого риска, менее 2,6 ммоль/л для пациентов очень высокого риска) или аполипопротеина В (менее 100 мг/дл [ммоль/л] для пациентов высокого риска, менее 70 мг/дл для пациентов очень высокого риска).
Фармакотерапия дислипидемий
Статины в настоящий момент остаются ключевым средством для снижения риска развития ССК. Уменьшение уровня ЛПНП на 1 ммоль/л с применением статинов обусловливает снижение риска ССК на 21% [2]. Кроме того, среди пациентов с высоким риском статины снижают общую смертность.
Для лечения дислипидемии необходимо назначать статины в качестве средства первого выбора с титрованием дозировки до максимальной рекомендованной/переносимой для достижения целевого уровня ЛПНП (класс рекомендаций IА). Статины следует назначать пожилым людям с установленными ССЗ по тем же принципам, что и более молодым (класс рекомендаций IА).
Новые классы гиполипидемических препаратов востребованы у лиц с непереносимостью статинов и у пациентов, которым при применении статинов в максимальных дозах не удается добиваться целевых уровней ЛПНП. Кроме того, даже при достижении целевых уровней ЛПНП (менее 1,8 ммоль/л) сохраняется резидуальный риск, что дополнительно определяет необходимость искать новые липидные и нелипидные мишени для новых классов препаратов.
Четкие доказательства того, что применение нестатиновых гиполипидемических средств приводит к снижению сердечно-сосудистого риска, были получены совсем недавно [1, 3].
Эзетимиб
Эзетимиб ингибирует адсорбцию холестерина в кишечнике, не влияя на всасывание жирорастворимых нутриентов. В ответ на снижение поступления холестерина в печень происходить up-регуляция рецепторов ЛПНП, способствующих удалению ЛПНП из крови.
Ключевой работой, показавшей эффективность эзетимиба, послужило двойное слепое исследование IMPROVE-IT (Improved Reductionof Outcomes: Vytorin Efficacy International Trial) [4], в котором сравнивались комбинации эзетимиба и симвастатина с монотерапией симвастатином пациентов очень высокого риска непосредственно после перенесенного ОКС.
В IMPROVE-IT в группы симвастатина (40 мг/сут) и комбинации симвастатина (40 мг/сут) и эзетимиба (10 мг/сут) были рандомизированы 18 144 пациента, перенесших ОКС, с исходными уровнями ЛПНП 1,3–2,59 ммоль/л (с опытом применения статинов) и менее 3,23 ммоль/л (ранее не получавшие статинов). Медиана периода наблюдения составила 6 лет. Среди пациентов, получавших комбинацию симвастатина и эзетемиба, двойного целевого показателя (ЛПНП<1,8 ммоль/л и ультрачувствительный С-реактивный белок – уч-С-РБ<2 мг/л) достигли 50%, в то время как в группе симвастатина – лишь 29% (р<0,001).
Применение комбинированной терапии симвастатином и эзетимибом приводило к статистически значимому снижению риска достижения первичной конечной точки (смерть от ССЗ, инфаркт миокарда, инсульт, нестабильная стенокардия, операция по реваскуляризации) на 6,4%. Число пациентов, которые должны получать терапию (NNT – Number-Needed-to-Treat) для предотвращения одной ССК, составило 50 (в течение 7 лет). Немаловажно, что применение эзетимиба не было сопряжено с ростом числа побочных эффектов, включая случаи развития онкологических заболеваний.
Достижение «двойной цели» по ЛПНП и уч-С-РБ было сопряжено с улучшением прогноза (отношение рисков достижения первичной конечной точки – 0,73; p<0,001 по сравнению с теми, кто не достиг ни целевого уровня ЛПНП, ни уч-С-РБ).
Средний уровень ЛПНП в группе комбинированной терапии симвастатином/эзетимибом составил 1,4 ммоль/л, в группе симвастатина – 1,8 ммоль/л. Улучшение прогноза пациентов очень высокого риска при более жестком контроле уровня ЛПНП было показано также в исследованиях ODYSSEY-LONG-TERM и OSLER [5] (цели ЛПНП менее 1,3 ммоль/л), что подтверждает концепцию «чем ниже, тем лучше» и поднимает вопросы относительно оптимальных целевых уровней ЛПНП.
Более выраженный регресс атеромы, по данным внутрисосудистого ультразвука, был продемонстрирован в исследовании PRECISE-IVUS [6].

Ингибиторы PCSK9
Принципиально новым классом препаратов являются ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9, или PCSK9 (proprotein convertase subtilisin/kexin type 9).
Связь PCSK9 и липидных нарушений была выявлена сравнительно недавно, в 2003 г., при анализе генетического профиля аутосомно-доминантных случаев наследственной гиперлипидемии во французских семьях [7]. При мутации, увеличивающей функциональную активность фермента, значительно снижается содержание ЛПНП-рецепторов в печени, что приводит к выраженному повышению ЛПНП в крови. При мутации, сопровождаемой выпадением функции фермента, наоборот, отмечено значительное снижение уровня ЛПНП в крови, что сопровождается уменьшением риска ССК при анализе различных популяций [8].
Фермент PCSK9 образуется в печени. После высвобождения из клетки PCSK9 или связывается с окружающими его рецепторами ЛПНП с последующим эндоцитозом образовавшихся комплексов, или попадает в системный кровоток. Циркулирующий PCSK9 влияет на переработку ЛПНП-рецепторов в печени, кишечнике, почках, легких, жировой ткани и поджелудочной железе за счет образования комплекса с рецептором, который подвергается последующей деградации.
В результате число ЛПНП-рецепторов снижается, а уровень ЛПНП в крови повышается. Таким образом, физиологический смысл фермента PCSK9 заключается в контроле системы ЛПНП-рецепторов, влияя на уровень холестерина в крови.
Данные демографических исследований и экспериментальных работ продемонстрировали значимость PCSK9 в регуляции обмена ЛПНП. В результате возникла перспектива создания нового класса липидснижающих препаратов с совершенно новым механизмом действия. Наиболее исследованный и имеющий клиническое применение в настоящее время подход заключается в использовании моноклональных антител. В 2009 г. впервые были получены моноклональные антитела, ингибирующие PCSK9 [9]. К 2012 г. было опубликовано несколько исследований 1-й фазы, несколько позже – исследования 2-й фазы, продемонстрировавшие эффективность ингибиторов PCSK9 в снижении ЛПНП как в монотерапии, так и в комбинации со статинами. Действие препаратов оказалось дозозависимым и было максимальным при введении препаратов через более частые интервалы (каждые 2 недели). Также было продемонстрировано значительное снижение уровня Apo B и Lp (a). Воздействие на триглицериды и ЛПВП оказалось минимальным. При этом исследования 2-й фазы показали хорошую переносимость препаратов. Необходимо отметить, что влияние ингибиторов PCSK9 на сердечно-сосудистые исходы не анализировались.
К 2014 г. были опубликованы исследования 3-й фазы двух препаратов: алирокумаба и эволокумаба.
В исследования включили пациентов с наследственной гиперлипидемией, высоким риском ССК и невозможностью оптимального контроля ЛПНП на максимальной терапии статинами, а также непереносимостью статинов. Исследование ODYSSEY MONO продемонстрировало снижение ЛПНП на 47% в течение 24 месяцев терапии алирокумабом, выраженность эффекта была намного больше, чем при монотерапии эзетемибом [10]. Исследования MENDEL-2 and GAUSS-2 показали практически одинаковое снижение уровня ЛПНП при использовании эволокумаба в дозировке 140 мг каждые 2 недели и 420 мг каждые 4 недели пациентами, не принимавшими статины (на 56 и 57% соответственно). При этом эффект препарата также намного превышал таковой для эзетемиба [11, 12]. В исследование DESCARTES-2 был включен 901 пациент без достижения целевых значений ЛПНП на фоне максимальной липидснижающей терапии. Пациенты получали 420 мг эволокумаба каждые 4 недели или плацебо. При этом терапия ингибитором PCSK9 проведена на фоне либо модификации диеты, либо 10 мг аторвастатина, либо 80 мг аторвастатина, либо комбинации 80 мг аторвастатина и эзетемиба. К 52-й неделе наблюдения в группе эволокумаба уровень ЛПНП был ниже на 57%. [13] В исследования LAPLACE-2 и RUTHERFORD-2 включены лишь пациенты на фоне терапии статинами, часто в комбинации с эзетемибом. Продемонстрировано снижение ЛПНП на 56–63% на фоне эволокумаба и у этих пациентов [14, 15].
Профиль безопасности ингибиторов PCSK9 достаточно высок. По данным исследований 2-й фазы, самыми частыми побочными эффектами оказались местные кожные реакции при введении препарата (2–9%), инфекции верхних дыхательных путей (4–15%) и диспепсия (4–6%). Зафиксирована одна аллергическая реакция при введении алирокумаба. Необходимо отметить, что случаев возникновения антител к ингибиторам PCSK9 не отмечено. Исследования 3-й фазы подтвердили низкую частоту побочных эффектов. Частота «мышечных» симптомов не превышала таковую у эзетемиба и составила 3,8% [8]. В исследование GUASS-2 включены лишь пациенты с миалгиями на фоне приема статинов. Частота миалгий в группе эволокумаба составила 12–13%, при этом в группе эзетимиба – 23% [12].
Таким образом, PCKS9-ингибиторы – эффективные и безопасные препараты для снижения уровня ЛПНП в крови, особенно для пациентов с возникновением побочных эффектов при применении статинов. Ограничением к их использованию являются необходимость парентерального введения и крайне высокая стоимость. Наконец, к настоящему времени не опубликовано ни одной работы о влиянии этих препаратов на риск ССК. Обнародование результатов первого исследования, FOURIER (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk), состоится в 2017 г.
Другие препараты
Секвестранты жирных кислот традиционно использовались с целью снижения уровня общего холестерина и ЛПНП в крови. Препараты продемонстрировали снижение ЛПНП на 18–25%, а также небольшое повышение уровня триглицеридов в крови. Однако практически все исследования препаратов этой группы были проведены до появления статинов, в связи с чем в настоящее время роль секвестрантов жирных кислот в коррекции липидных нарушений минимальна [16].
Никотиновая кислота в дозировке 2 г/сут снижает уровень ЛПНП в крови на 15–18%, при этом также снижает уровень триглицеридов на 20–40% и повышает уровень ЛПВП до 25%. Однако проведенные исследования как формы замедленного высвобождения никотиновой кислоты, так и фиксированной комбинации с ларопипрантом не смогли продемонстрировать клиническую эффективность препарата при значительном количестве побочных эффектов [17, 18].
В настоящее время никотиновая кислота, как и препараты группы фибратов, могут использоваться лишь для коррекции выраженной гипертриглицеридемии с целью снижения риска связанного с ней острого панкреатита.
Ниши для новых препаратов: ограничения и противопоказания к применению статинов
Основными ограничениями к применению статинов служат активный гепатит, а также побочные эффекты, в первую очередь миопатии.
Статин-ассоциированные мышечные расстройства варьируются от асимптомных форм с повышением уровня креатинфосфокиназы (КФК), миалгии (мышечной боли без повышения уровня КФК) до миозита (острой мышечной боли с повышением уровня КФК) и потенциально угрожающего жизни рабдомиолиза.
Частота развития статин-ассоциированных миопатий легкой степени достигает 1–5%, при этом выраженные миопатии/миозиты (с повышением КФК более 10 норм) развиваются примерно у 0,1% пациентов [19]. Статин-индуцированный рабдомиолиз встречается исключительно редко (1–3 случая на 100 тыс. пациенто-лет) [20].
Европейское общество по изучению атеросклероза предлагает следующий алгоритм ведения пациентов со статин-индуцированными мышечными расстройствами (см. рисунок) [21].
Незначительное повышение активности печеночных трансаминаз отмечается у 0,5–2,0% пациентов, получающих статины. Клинически значимым признается повышение уровня трансаминаз более трех норм, выявленное при повторных измерениях. При этом незначительное повышение уровня трансаминаз (менее двух норм) не ассоциируется с повреждением печени или изменением ее функции. Печеночная недостаточность на фоне применения статинов встречается исключительно редко. В связи с этим в настоящее время не рекомендуется проводить рутинный мониторинг уровней печеночных трансаминаз на фоне терапии статинами.
Особо необходимо отметить безопасность применения статинов для пациентов со стеатозом печени/стеатогепатитом с незначительным повышением уровня трансаминаз.
Алгоритм действий при незначительном повышении уровня трансаминаз на фоне применения статинов аналогичен ведению пациентов с миопатиями. Пациентам высокого риска с повышением уровня печеночных трансаминаз менее трех норм до решения об отмене статина (замене на другой класс препаратов) важно предпринять попытки смены статина, уменьшение дозировки статина.
Стратегия применения комбинации статина и эзетемиба при непереносимости высокой дозы статинов или недостижении целевого уровня ЛПНП на фоне максимальной дозы статина отражена в новых клинических рекомендациях по лечению дислипидемий ESC – European Society of Cardiology/AS – European Atherosclerosis Society от 2016 г.
Заключение
В настоящее время статины остаются краеугольным камнем гиполипидемической терапии. Эффект снижения уровня ЛПНП и повышения уровня ЛПВП на фоне применения нестатиновых препаратов далеко не всегда обусловливает улучшение клинических исходов. В связи с этим особенно важно до начала применения нестатиновых препаратов в клинической практике провести их всестороннее изучение. Сегодня доказательства снижения риска получены для эзетемиба, который может использоваться при непереносимости статинов и при недостаточной их эффективности. Многообещающими представляются также результаты ранних исследований нового класса препаратов ингибиторов PCKS9. Уже сейчас эти препараты (при доступности) рационально применять при непереносимости статинов и эзетемиба. Введение ингибиторов PCKS9 в широкую практику ожидается после завершения крупных исследований 3-й фазы.



