Поджелудочная железа (ПЖ) является ключевым органом, секреция которым гидролитических ферментов обеспечивает пищеварение. Наиболее активно гидролиз нутриентов происходит в проксимальной части тонкой кишки. Механизмам периодической секреции посвящены многие исследования. Резюмируя их, можно заключить, что к основным относятся холинергические рефлекторные (в т.ч. гастродуоденопанкреатические) механизмы, гормональные (делается акцент на гормон мотилин, концентрация которого в крови изменяется синхронно с периодикой секреции железы). Не исключается возможность интрапанкреатической генерации периодической секреции органа [1–3]. Патофизиологические изменения после резекции ПЖ приводят к изменению не только физиологии самой ПЖ, но и физиологии желудка и двенадцатиперстной кишки (ДПК). В желудке происходит нарушение фундальной релаксации из-за исчезновения антрофундального и дуоденофундального рефлюксов, нарушение нервной стимуляции панкреатической секреции из-за отсутствия фундальной релаксации. Изменение физиологии ДПК заключается в снижении холецистокининовой стимуляции панкреатической секреции и вторичных изменений из-за резекции ДПК. Резекция ПЖ и ее основное заболевание приводят как к снижению секреции, так и к нарушениям, связанным с изменением взаимоотношений с желудком и ДПК [4].
Тотальная или частичная резекция ПЖ безусловно служит фактором риска развития ее функциональной недостаточности. Между экзо- и эндокринной функциями ПЖ существует тесная взаимосвязь. Так, трипсин влияет на синтез инсулина и глюкагона. На внешнюю секрецию влияют уровень глюкозы крови и инсулин: обеспечивает поступление аминокислот и глюкозы в ацинусы. Инсулин оказывает различные эффекты на ацинарные клетки ПЖ и экзокринную функцию ПЖ. Инсулин усиливает высвобождение ферментов, особенно амилазы, в ответ на воздействие холецистокинина, секретина, ацетилхолина в экспериментальных условиях [5]. У 70% пациентов, перенесших субтотальную резекцию ПЖ, развивается сахарный диабет (СД) 3 типа [6].
Целью исследования стало выявление особенностей нарушения функции ПЖ в зависимости от объема и вида резекционных операций на ПЖ.
Материал и методы
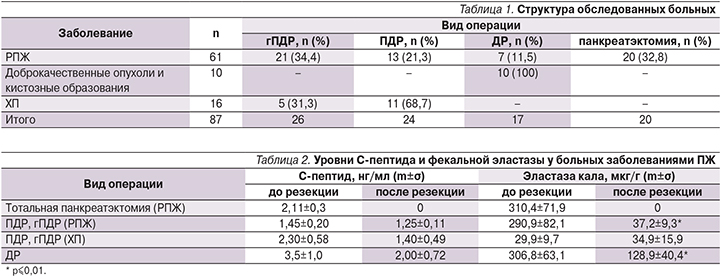
Обследованы 87 больных, которым в разные сроки и по различным причинам выполнена резекция ПЖ, из этого числа 61 больной страдал раком ПЖ (РПЖ). В зависимости от локализации и распространенности процесса больным РПЖ проведены следующие операции: гастропанкреатодуоденальная резекция (гПДР) – 21, и панкреатодуоденальная резекция (ПДР) – 13 (из них 9 мужчин и 25женщин, средний возраст – 64,53±6,97 года); дистальная резекция (ДР) – 7 больным, из которых 3 мужчин и 4 женщин, средний возраст – 63,71±8,53 года; тотальная панкреатэктомия – 20 (12 мужчин и 8 женщин, средний возраст – 62,35±6,25 года); 10 пациентам (7 женщин, 3 мужчины, средний возраст – 51,8±7,3 года) с доброкачественными опухолями и кистозными образованиями (муцинозная цистаденома – 1, серозная цистаденома – 2, нейроэндокринная опухоль – 1, постнекотические кисты – 3, внутрипротоковая папиллярно-муцинозная опухоль – 2, аутоиммунный панкреатит – 1) выполнена ДР ПЖ. Таким образом, число больных, перенесших ДР, составило 17. Кроме того, в исследование были включены 16 больных хроническим панкреатитом (ХП), которым проведены ПДР и гПДР по поводу осложнений ХП. Структура обследованных больных представлена в табл. 1.
С целью определения функционального состояния ПЖ всем больным измерялись уровни сывороточного С-пептида и фекальной эластазы (Е1) иммуноферментным методом до оперативного вмешательства и через 3 месяца после. Использованы коммерческие наборы для количественного определения содержания фекальной эластазы-1 (BioservDiagnostics, Германия), С-пептида (Monobind, США).
Результаты исследования
У больных ХП уровень эластазы кала был ниже 100 мкг/г до хирургического лечения (29,9±9,7 мкг/г), что свидетельствовало о тяжелой экзокринной недостаточности, связанной с течением заболевания. После гПДР и ПДР уровень Е1 у больных ХП составил в среднем 34,9±15,9 мкг/г и не имел достоверных различий с дооперационным. Таким образом, резекция ПЖ не усугубила внешнесекреторных нарушений у больных ХП. Уровень фекальной эластазы больных РПЖ в среднем был в пределах нормы, что свидетельствовало о сохраненной внешнесекреторной функции ПЖ до резекции. После гПДР и ПДР уровень Е1 у больных РПЖ достоверно снизился и не отличался от такового у больных, оперированных по поводу ХП. При этом объем резекции (гПДР или ПДР) не повлиял на уровень фекальной эластазы. У больных, перенесших ДР ПЖ, уровень Е1 до операции был в пределах нормы и составил в среднем 306,8±63,1 мкг/г, после операции – 128,9±40,4 мкг/г, что свидетельствовало о развитии экзокринной недостаточности средней степени тяжести.
Уровень С-пептида не имел достоверных отличий до и после хирургического лечения во всех группах исследуемых, кроме больных, перенесших панркеатэктомию. Можно отметить только тенденцию к его снижению после резекции. У больных, перенесших панкреатэктомию, уровни С-пептида и Е1 были равны нулю (табл. 2).
Таким образом, показатели фекальной эластазы у всех больных после резекционных операций на ПЖ (гПДР, ПДР, ДР) были достоверно снижены, что свидетельствовало о снижении экзокринной функции ПЖ после резекции. При этом после гПДР и ПДР развивалась экзокринная недостаточность преимущественно тяжелой степени, а после ДР – средней степени тяжести.
Тотальная панкреатэктомия стала причиной СД и тяжелой экзокринной недостаточности у всех пациентов.
Из всех больных, перенесших ПДР и гПДР, развернутая клиническая картина СД до операции была выявлена у 5, после операции СД развился еще у 6 (13,3%). Среди пациентов, перенесших ДР, 1 больной страдал СД до операции и у 3 СД развился после операции.
По данным литературы, распределение РР-клеток, секретирующих панкреатический полипептид, происходит преимущественно в головке ПЖ, α-клетки, секретирующие глюкагон, в большей степени распределяются в теле и хвосте железы [7].
С учетом полученных результатов показателей фекальной эластазы все больные, перенесшие резекцию ПЖ, в той или иной степени нуждаются в постоянной ферментозаместительной терапии.
Лечение экзокринной недостаточности ПЖ основано на пероральном восполнении панкреатических ферментов. Это позволяет оптимизировать процесс переваривания и всасывания питательных веществ [8, 9]. При этом после ДР ПЖ требуются меньшие дозы препаратов, после гПДР и ПДР – бóльшие, после панкреатэктомии, соответственно, назначаются самые высокие дозы препаратов. Среди существующих на сегодняшний день ферментных препаратов только микронизированные препараты панкреатина, покрытые кислотоустойчивой оболочкой, показали адекватную терапевтическую эффективность при тяжелых нарушениях внешнесекреторной функции ПЖ. Доза вводимых ферментов должна быть достаточной для замещения экзокринной функции ПЖ. В целом, хотя нет никаких рандомизированных исследований, сравнивающих различные дозы ферментов, исследования показали, что клиническая эффективность достигается с введением минимальной дозы 40 000–50 000 ЕД липазы на каждый основной прием пищи и половину этой дозы (20 000–25 000 ЕД) на перекусы [10].
Дозы полиферментных препаратов назначались больным в соответствии с вышеописанными рекомендациями. При этом дозы препаратов для пациентов с внешнесекреторной недостаточностью тяжелой степени (это больные, перенесшие ПДР, гПДР и панкреатэктомию) составили 180 000–250 000 ЕД липазы в сутки. Дозы препарата для больных после ДР ПЖ были несколько меньше и составили 140 000–180 000 ЕД липазы в сутки. Адекватность подобранных доз оценивалась по клиническим показателям: уменьшение вздутия живота, уменьшение частоты и объема стула, стабилизация массы тела.
Панкреатогенный СД обладает особенностями течения: отмечаются частые гипогликемические состояния, обусловленные сниженным уровнем секреции глюкагона, панкреатического полипептида, первичной внешнесекреторной недостаточностью ПЖ, нередко алкоголизмом. Кроме того, для СД 3 типа характерна повышенная периферическая и низкая печеночная чувствительность к инсулину, низкий уровень глюкозозависимого инсулинотропного полипептида, что также влияет на течение СД, обусловленного панкреатитом [11, 12].
«Хирургический» СД развивается гораздо чаще после ДР ПЖ и во всех случаях тотальной панкреатэктомии. Послеоперационный СД в исследованиях описывается как осложнение, в хирургической литературе его частота и тяжесть часто недооцениваются [7].
В большинстве исследований при лечении панкреатогенного СД помимо назначения препаратов инсулина отмечается необходимость компенсации экзокринной недостаточности ПЖ [13]. С этой целью рекомендуется назначать ферментные препараты. Важно, что при применении данных лекарственных средств улучшается углеводный обмен, повышается контроль гликемии, стабилизируются показатели гликозилированного гемоглобина, уменьшается риск развития осложнений СД, уменьшается выраженность стеатореи. В связи с этим заместительную терапию ферментными препаратами считают адъювантным методом лечения панкреатогенного СД [14].
Обязательным условием рациональной терапии ХП и СД считаются регулярный контроль уровня глюкозы в крови и его коррекция. При панкреатогенном СД нет четких показаний к назначению сахароснижающих средств, прежде всего препаратов сульфонилмочевины, с учетом их эффективности в той мере, в какой это реализовано в алгоритмах лечения СД 2 типа [13, 15].
Таким образом, полученные результаты показали, что все больные, перенесшие резекцию ПЖ, в той или иной степени нуждаются в постоянной ферментозаместительной терапии в контроле и коррекции гликемии.



