Нейроэндокринные опухоли (НЭО) поджелудочной железы составляют 12% в структуре НЭО желудочно-кишечного тракта и 2% от всех злокачественных новообразований поджелудочной железы. Частота их возникновения увеличивается [14]. В эту группу входят инсулиномы, гастриномы, редко функционирующие и нефункционирующие НЭО. Для пациентов с НЭО поджелудочной железы хирургическое лечение – основной и единственный радикальный метод, позволяющий их излечивать. Показания к хирургическому лечению и объем операции определяются в зависимости от наличия клинических симптомов опухоли, местной расспространенности, злокачественого потенциала, наличия метастазов в печени, включая оценку резектабельности поражения печени и функциональное состояние организма. Хирургическое лечение НЭО заключается в выполнении панкреатодуоденальной резекции, дистальной резекции поджелудочной железы со спленэктомией или без нее, энуклеации опухоли самостоятельно либо совмещенно с дистальной резекцией поджелудочной железы в зависимости от наличия сопутствующего наследственного синдрома МЭН1. НЭО поджелудочной железы, как правило, имеют высокий злокачественный потенциал, следовательно, необходима регионарная лимфодиссекция. По мнению абсолютного большинства авторов, не следует оперировать больных низкодифференцированными НЭО (G3) поджелудочной железы, т.к. эти опухоли на момент диагностики обычно местнораспространенные, имеют метастазы в печень и другие органы [8, 11–13].
При диссеминированной болезни и нерезектабельных опухолях показано проведение консервативной терапии (химиотерапия, таргетная терапия, аналоги соматостатина). Ключевую роль в процессе ангиогенеза НЭО поджелудочной железы играет сосудистый эндотелиальный фактор роста (VEGFR). Кроме этого опухолевые клетки поджелудочной железы широко экспрессируют тромбоцитарный фактор роста (PDGFR). К настоящему времени большую роль в лечении НЭО поджелудочной железы приобретает использование таргетных препаратов. К одним их таких средств относится сунитиниб. Сунитиниб (Сутент, SU 11248 ) – мультитаргетный препарат, антиангиогенный, низкомолекулярный ингибитор VEGFR и тромбоцитарного фактора роста (PDGFR). Мишенью Сутента служат рецепторы VEGF 1-го (flt) и 2-го (flk) типов, KIT, PDGFR-альфа и -бета (рецепторы тромбоцитарного фактора роста). Результаты использования Сутента при светлоклеточном раке почки и резистентных к Гливеку гастроинтестинальных стромальных опухолях позволяют рекомендовать его при этих заболеваниях. Получены положительные результаты использования Сутента при НЭО. В качестве средства, применяемого при терапии почечно-клеточного рака и гастроинтестинальных стромальных опухолей, сунитиниб был зарегистрирован в США в январе 2006 г. В России сунитиниб был одобрен для лечения больных раком почки в августе 2007 г., а в 2012 г. включен в Перечень жизненно необходимых и важнейших лекарственных препаратов.
Сунитиниб был зарегистрирован в Европе с 2010 г., в США – с 2011-го, в РФ – с 2013 г. в качестве препарата для лечения НЭО поджелудочной железы. В исследовании I фазы [2] было установлено, что время полувыведения препарата составляет 40 часов, а его активных метаболитов – около 80 часов. Сунитиниб метаболизируется в печени изоферментом CYP3A4 системы цитохрома-Р450. В качестве средства лечения почечно-клеточного рака и гастроинтестинальных стромальных опухолей установлена лечебная доза препарата – 50 мг в день перорально независимо от приема пищи в течение 4 недель с интервалом в 2 недели.
К основным проявлениям дозолимитирующей токсичности относятся астения и артериальная гипертензия. Также отмечена кожная токсичность, выраженная в развитии сухости кожи, отека и ладонно-подошвенного синдрома, наблюдавшаяся преимущественно при применении Сутента в дозах ≥75 мг/день. Другими проявлениями кожной токсичности были окрашивание кожи в желтый цвет, ассоциирующееся с интенсивным окрашиванием мочи вследствие выведения препарата и его метаболитов, а также депигментация волос. Эти эффекты обычно развивались при применении Сутента в дозах ≥50 мг/день и купировались после отмены препарата.
Из 22 больных раком почки в исследовании I фазы частичный эффект Сутента в дозе ≥ 50 мг/день был отмечен у троих. Стабилизация продолжительностью более 6 месяцев отмечена у пятерых больных с почечно-клеточным раком почки. Дополнительно у шестерых больных произошел некроз опухоли с образованием свищей, развитием вторичной инфекции в местах некроза метастазов в легких, летальным внутрибрюшным кровотечением у одного больного. Эти осложнения были связаны с быстрым (в течение недели после начала лечения) исчезновением сосудов внутри опухоли и высокой дозой препарата. На основании результатов I–II фаз испытаний были проведены расширенные исследования Сутента на больных Гливек-резистентными гастроинтестинальными стромальными опухолями, почечно-клеточным раком и другими опухолями.
Использование Сутента при светлоклеточном раке почки основано на том, что значительное число больных светлоклеточным раком почки имеют синдром Гиппеля–Линдау, характеризующийся повышенным неоангиогенезом, обусловленным гиперпродукцией VEGF. Это позволяет ожидать высокой эффективности при применении антиангиогенных препаратов.
Во II фазе испытаний 63 больным светлоклеточным раком почки с прогрессированием на фоне терапии цитокинами назначали Сутент по 50 мг/сут в режиме 4/2 [3]. При оценке эффективности частичный эффект отмечен у 25 (40%) больных, стабилизация более 3 меяцев – у 17 (27%). Время до прогрессирования у больных с частичным эффектом составило от 21 до 24+месяц, медиана времени до прогрессирования у всех больных – 8,7 месяца. Медиана ОВ – 16,4 месяца. Из токсичности III–IV степеней чаще всего отмечались слабость (11%), лимфопения (32%), повышение уровня липазы (21%) без признаков развития панкреатита. Также имели место нейтропения (13%), анемия (10%), повышение уровня амилазы (8%), диарея (3%), тошнота (3%), стоматит (2%), рвота (2%), снижение фракции выброса левого желудочка (2%), дерматит (2%), артериальная гипертензия (2%).
Также были проведены исследования по изучению эффективности бевацизумаба при светлоклеточном раке почки, составившей около 10%. В.I. Rini и соавт. [5] исследовали эффективность Сутента на 32 больных с прогрессированием рака почки на фоне терапии бевацизумабом. Уменьшение опухоли отмечено у большинства (81%) пациентов, а у 13% больных наблюдался частичный эффект, что подтверждает оправданность последовательного проведения антиангиогенной терапии препаратами с различными механизмами действия и разными мишенями. Таким образом, можно смело утверждать, что Сутент улучшает результаты лечения распространенного светлоклеточного рака почки.
Сутент изучали и при резистентных к Гливеку гастроинтестинальных стромальных опухолях. Известно, что Гливек (ингибитор тирозинкиназы c-kit) – единственный препарат с доказанной высокой эффективностью при этом виде опухолей. В среднем через 1–2 года на фоне приема Гливека развивается резистентность, связанная с вторичной мутацией KIT или PDGFR-альфа [6], а около 20% больных имеют первичную резистентность к препарату.
В исследование J.А. Morgan и соавт. [7] были включены 97 больных Гливек-резистентными GIST. Пациенты принимали Сутент в дозе 50 мг/сут в течение 4 недель с 2-недельным перерывом. Частичный эффект был зарегистрирован у 8% больных, стабилизация болезни более 6 месяцев – у 37%, а от 6 недель до 6 месяцев – у 32%. Медиана времени до прогрессирования составила 7,8 месяца, общая выживаемость – 19,8. Активно изучается эффективность сунитиниба при НЭО. Обнадеживающие результаты в отношении объективного эффекта для больных НЭО различной локализации послужили причиной проведения мультицентрового исследования I фазы. Препарат назначали в дозе 50 мг/день с интервалом между курсами 2 недели. Объективный эффект для 66 больных распространенной НЭО поджелудочной железы составил 16,7%, и 56,1% пациентов была достигнута длительная стабилизация (более 6 месяцев). Медиана времени до прогрессирования составила 7,7 месяца 13].
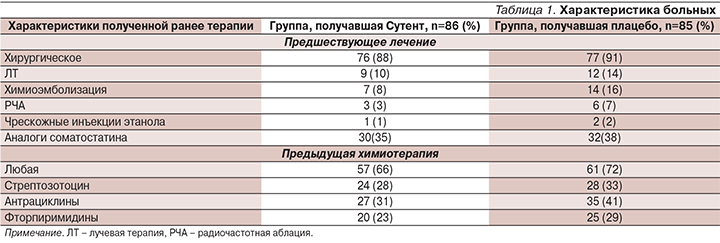
Beaumont и соавт. представлены результаты II фазы по изучению препарата на 106 больных НЭО поджелудочной железы, получавших ранее лечение. Частичный эффект достигнут 10% пациентов, стабилизация заболевания – 80%. Медиана времени до прогрессирования составила 40 недель, годичная выживаемость – 82,8% [9]. В дальнейшем Raymond и соавт. [11, 12] выполнили мультицентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы по изучению сунитиниба на больных высокодифференцированными НЭО поджелудочной железы, которым невозможно выполнить радикальное оперативное вмешательство и у которых отмечено прогрессирование болезни за последние 12 месяцев. Первичной целью была оценка выживаемости без прогрессирования, вторичной – уровня объективного ответа, общей выживаемости и токсичности. Основная характеристика больных представлена в табл. 1.
Больные принимали Сутент/плацебо в дозе 37,5 мг/сут в ежедневном непрерывном режиме. По данным проведенного исследования, медиана времени до прогрессирования в группе сунитиниба составила 11,4 месяца (95% ДИ: 7,4–19,8; р<0,001, в группе плацебо – 5,5 (95% ДИ: 3,6–7,4; р<0,001). Было получено статистически значимое увеличение общей выживаемости пациентов группы сунитиниба по сравнению с плацебо (ОР=0,409, p=0,0204). Кроме того, зарегистрировано статистически значимое увеличение частоты объективного эффекта у больных, получавших сунитиниб: 9,3 vs 0% в группе плацебо (p=0,0066).
Исследование было прекращено досрочно из-за множества смертельных исходов в группе плацебо и значительного преимущества по показателю выживаемости без прогрессирования в группе сунитиниба. В связи с этим был выполнен дополнительный анализ, который показал, что медиана времени до прогрессирования в группе сунитиниба равна 4,8 месяца, 6-месячная выживаемость составила 92,8%. В последующем был проведен перевод больных группы плацебо на сунитиниб. Общая выживаемость при дальнейшем анализе не различалась между группами, вероятно по причине применения 69% пациентов сунитиниба после прогрессирования в контрольной группе.
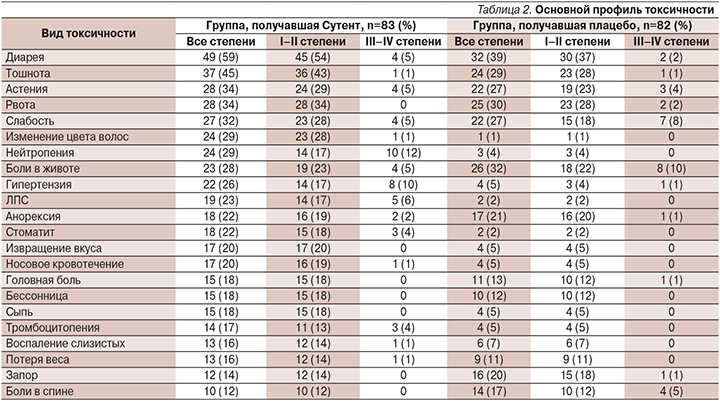
Спустя 5 лет после окончания исследования 55 (64%) больных группы сунитиниба и 58 (68%) группы плацебо умерли. Медиана времени наблюдения в группе сунитиниба составила 67,4 месяца, медиана общей выживаемости – 38,6 (95% ДИ: 25,6–56,4); в группе плацебо – 29,1 месяца (95% ДИ: 16,4–36,8) по методу Каплан–Майер, ОР – 0,73 (95% ДИ: 0,50–1,06), p=0,094. Основной профиль токсичности представлен в табл. 2.
При анализе данных зарегистрировано 9 смертельных исходов в группе, получавшей сунитиниб (10%), и 21 случай летального исхода в группе, получавшей плацебо (25%), 95% ДИ – 0,19–0,89; р=0,02. Наиболее часто в группе сунитиниба встречались диарея, тошнота, рвота и слабость. Нежелательные явления в целом хорошо контролировались путем прекращения лечения, редукции дозы и симптоматической терапии. С учетом данных представленного исследования в отделении химиотерапии была произведена оценка эффективности и токсичности сунитиниба для больных НЭО поджелудочной железы, ранее получавших лечение. В моноцентровое исследование были набраны 19 больных НЭО поджелудочной железы G1, G2. Их средний возраст составил 55 лет (4 мужчины, 15 женщин). У большинства пациентов была НЭО поджелудочной железы, у одной пациентки выявлена НЭО почки – она была включена в исследование с учетом возможного получения эффекта при НЭО данной локализации. Первично-множественное нейроэндокринное поражение почки и поджелудочной железы отмечено у двоих человек. Опухоль G1 была у 3 больных, G2 – у 15, G3 – у 1 больной. Всем больным определен индекс пролиферации Ki-67: менее 3% – у 1 больного, от 3 до 20% включительно – у 17, 35% – у 1 пациентки. Все больные получали предшествующее лечение: хирургическое – 9 пациентов, 7 больных – разнообразные режимы химиотерапии с использованием капецитабина и оксалиплатина, темозоломида, иринотекана, доксорубицина, гемцитабина. Лекарственная терапия эверолимусом была проведена 7 пациентам. Все больные получали аналоги соматостатина в различных дозах. В качестве I линии системной терапии сунитиниб назначили 4 больным, после эверолимуса – 2, в качестве последующих линий (2 и более) лечение сунитинибом получили 13 пациентов.
Несмотря на единые клинические рекомендации, доза сунитиниба варьировалась из-за отсутствия необходимого количества препарата в клинике: сунитиниб в дозе 50 мг в течение 4 недель с интервалом в 2 недели получили 6 больных, дозу 37,5 мг ежедневно получили 5 человек, а 8 – дозу 25 мг ежедневно. Редукция дозы до 25 мг ежеденевно произведена в группе 50 мг 4 пациентам из-за выраженной стойкой артериальной гипертензии. Эффективность была оценена в отношении 14 из 19 больных; 5 больных не вошли в группу по оценке эффективности по следующим причинам: смертельный исход от прогрессирования болезни на фоне 1 курса лечения, не связанный с приемом препарата (1 больная), развитие стойкой артериальной гипертензии (1 больная), кровотечение из расширенных вен пищевода (1 пациент), потеряны для наблюдения 2 больных.
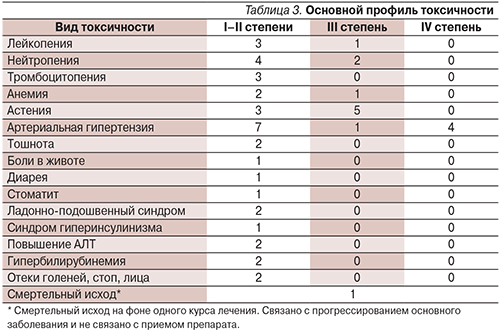
Частичный эффект отмечен у 2 (14,3%) пациентов, медиана длительности частичного эффекта на момент анализа не была достигнута при наблюдении за больными в течение 18 месяцев. Пациенты продолжают получать лечение, стабилизация отмечена у большинства (78,6%) больных, прогрессирование – у 1 (7,1%) пациента. Длительность стабилизации (медиана) равна 395 дням (162–518 дней, 95% ДИ). Различий по эффективности в зависимости от дозового режима нами выявлено не было. Профиль токсичности оценен в отношении 19 больных из 19. Сводные данные по нежелательным явлениям представлены в табл. 3.
У 13 больных отмечена токсичность различной степени выраженности, которая проявлялась лейкопенией (4 пациента), нейтропенией (6 больных); анемия 3-й ст. была отмечена у 1 больного. Повышение артериального давления IV степени наблюдалось у 4 больных, что потребовало редукции дозы препарата с 50 до 25 мг ежедневно 3 пациенткам, у 1 больной имели место стойкие гипертонические кризы на фоне 1 курса лечения (доза 37,5 мг), пациентка самостоятельно отменила прием препарата через 2 недели и, таким образом, не вошла в группу по оценке эффективности. У одного больного отмечалось кровотечение из расширенных вен пищевода (доза 50 мг), дальнейшее лечение было прекращено. Пациентка с НЭО почки получала лечение сунитинибом в течение 6 месяцев первоначально в дозе 37,5 мг ежедневно с эффектом в рамках стабилизации, далее из-за астении 3-й ст. произведена редукция дозы до 25 мг ежедневно, отмечено прогрессирование болезни. Больная переведена на терапию эверолимусом.
Предварительные данные показали, что эффективность лечения сунитинибом соответствует результатам, представленным в мировой литературе. Выявленные нежелательные явления коррелируют с известным токсическим профилем препарата. По данным консенсусных рекомендаций Европейского общества нейроэндокринных опухолей (ENETS), препарат сунитиниб одобрен в качестве антипролиферативной терапии при прогрессирующих НЭО поджелудочной железы после проведенного лечения аналогами соматостатина или химиотерапии.
В качестве 1-й линии лечения препарат может быть использован только в тех случаях, когда применение аналогов соматостатина рассматривать нельзя, а химиотерапия клинически не требуется или непереносима. В отсутствие карциноидного синдрома сунитиниб в сочетании с аналогами соматостатина использовать не рекомендуется. Также не показан он и при других, кроме НЭО поджелудочной железы, локализациях, за исключением клинических исследований (M. Pavel, 2016).
Таким образом, в серии исследований убедительно доказана эффективность Сутента, препарата с преимущественно антиангиогенной активностью, в случаях отсутствия альтернативы лечения или малой эффективности ранее применявшейся терапии. Очевидно, что при нейроэндокринных злокачественных заболеваниях Сутент имеет хорошие перспективы. Интересным представляется изучение Сутента в комбинации с химиотерапией или другими таргетными препаратами.



