Наиболее частой причиной госпитализации в детской популяции являются пароксизмальные состояния различной этиологии.
Приступ, пароксизм (attack, paroxysm) – внезапное, обычно повторяющееся возникновение или резкое усиление признаков болезни на относительно короткий срок (Энциклопедический словарь медицинских терминов, том II. М., 1985). Церебральный приступ имеет двоякое происхождение: первично-церебральное – эпилептический припадок, и вторично-церебральное – основной механизм приступа лежит вне мозга. Наиболее ярким примером первого является эпилептический приступ (ЭП), второго – синкоп, когда нарушение в системе общей циркуляции (кардиоингибирование/или вазодепрессия) приводит к олигемии мозга и вызывает соответствующую симптоматику вплоть до потери сознания и судорог [1].
По мнению самого авторитетного советского-российского невролога В.А. Карлова, термин «пароксизмальные состояния» вряд ли является удачным, т.к. он отражает статус больного (в русскоязычной медицинской лексике «состояние» означает не единичный эпизод, а именно ста-тус – эпилептический, мигренозный и т.п., рис. 1) [2].
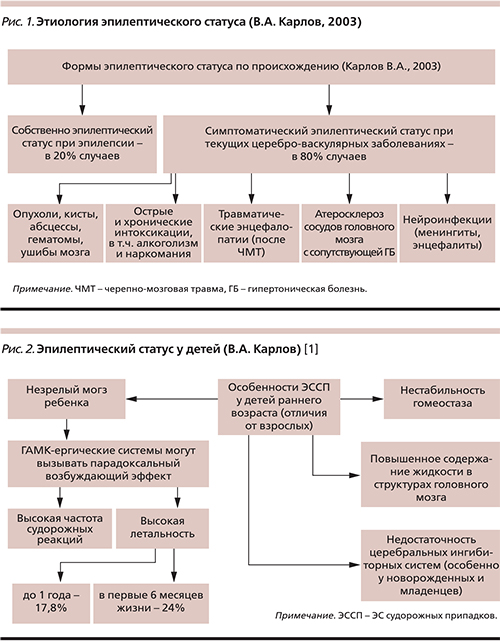
В 2010 г. В.А. Карлов предложил классификацию пароксизмальных состояний, основанную на наиболее общих критериях:
По этиологии:
- генетические, при заболеваниях центральной нервной системы (ЦНС), при соматических заболеваниях, эндокринных заболеваниях, при других заболеваниях; психогенные, ятрогенные.
По преимущественным механизмам реализации:
- нейрональные (каналопатии и др.), синаптические (миастенический криз и др.), системные (постуральный обморок и др.), органные (кардиогенный синкоп и др.), организменные (паническая атака и др.) и др.
По семиотике:
- двигательные, сенсорные, сенситивные, болевые, вегетативные, диссомнические, психические, сложные [1].
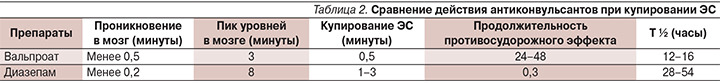
Частота встречаемости различных пароксизмальных состояний значительно выше в детском возрасте [2, 4]. Причина кроется в особенностях нервной системы детей во всех трех основных ее сферах – структурной, функциональной и биохимической. Мозг здорового ребенка принципиально отличается от такового взрослого: это пока несозревший мозг. В нем продолжаются процессы миелинизации и синаптогенеза не только новой коры, но и старой, а также субкортикальных структур, в частности неостриатума. Вследствие этого электрические процессы более диффузны, возбудимость нервных клеток повышена (рис. 2). Последнее обусловлено также и состоянием трансмиттерных и рецепторных систем [2, 3].

Симптоматические эпилептические припадки могут быть обусловлены многочисленными сопутствующими состояниями, такими как высокая температура, гипогликемия, метаболический дисбаланс или острые заболевания [4]. Почти всегда они проявляются как генерализованные судорожные припадки. Это может быть следствием таких состояний, как острое повреждение структур головного мозга вследствие травмы, метаболические расстройства или инфекции, которые могут поражать детей, не имеющих никакой предрасположенности к припадкам. Однако чаще все же существует специфическая предрасположенность к припадкам – в основном, вероятно, генетического происхождения и часто зависящая от возраста и определяющая индивидуальную чувствительность к действию специфических стимулов. Наиболее частым примером служат фебрильные судороги. Структурные нарушения гораздо чаще вызывают судороги у пациентов с наличием в семейном анамнезе случаев эпилепсии, чем среди населения в целом, то же относится и к другим причинам, например острому менингиту [4, 5].
Основные причины симптоматических эпилептических припадков (по J. Aicardi, 2013) [6]:
- Высокая температура, вызванная экстракраниальными инфекциями (фебрильные судороги).
- Внутричерепные инфекции: бактериальные (менингит, абсцесс мозга, эмпиема, септический венозный тромбоз), вирусные (менингиты, энцефалиты), грибковые и паразитарные.
- Параинфекционные энцефалопатии (синдром Рейе, острые энцефалопатии неясного генеза, геморрагический шок).
- Нарушение обмена веществ: гипокальциемия, гипомагниемия, гипонатриемия (при нарушении секреции антидиуретического гормона, водная интоксикация, неадекватная регидратация), гипернатриемия (последствия сосудистого коллапса, вызванного дегидратацией; последствия быстрой коррекции уровня натрия).
- Врожденные нарушения метаболизма (особенно в период декомпенсации).
- Интоксикации: эндогенные (уремия, почечный диализ, печеночная энцефалопатия, диабетический кетоацидоз).
- Гипертензивная энцефалопатия.
- Заболевания почек (острый нефрит, гемолитикоуремический синдром).
- Травма головы (ранние эпилептические припадки, эктрадуральные/субдуральные гематомы, контузии головного мозга).
- Острая гипоксия головного мозга (остановка сердца, утопление, острый сосудистый коллапс).
- Цереброваскулярные катастрофы (артериальные окклюзии – тромбозы и эмболии, венозные тромбозы, кровотечения из сосудистых мальформаций).
- Ожоговая энцефалопатия [6].
Как видно и приведенного выше перечня заболеваний/состояний, способных привести к симптоматическим эпилептическим припадкам, их дифференциальная диагностика и выбор адекватной терапии в педиатрической практике представляют значительные трудности [7]. Судорожный синдром при серийных приступах и эпилептическом статусе (ЭС) является тем ведущим патогенным фактором, который определяет развитие жизнеугрожающих расстройств в организме больного, поэтому он должен быть устранен в максимально короткие сроки [7].
Диагностика причин ЭП и коррекция витальных функций должны идти параллельно, что возможно в условиях многопрофильного стационара, имеющего в своей структуре отделение реанимации и интенсивной терапии (ОРИТ), круглосуточные диагностические службы.
Дети с серийными ЭП и ЭС являются одной из самых многочисленных групп пациентов, поступающих в ОРИТ. Частота данных состояний в отделениях интенсивной терапии варьируется в разных странах от 4 до 38 на 100 тыс. детей в год. Заболеваемость в развивающихся странах выше из-за высокой частоты инфекционных заболеваний [8]. Определение ЭС основывается в основном на продолжительности судорог, и большинство детей поступают в ОРИТ в состоянии, расцениваемом как ЭС.
 По мнению В.А. Карлова, при ЭС основополагающим следует считать именно тяжесть состояния больного, а не временной показатель длительности ЭС. Состояние больного расценивается как ЭС уже при нескольких припадках, если он находится в сопоре и тем более в коме [2].
По мнению В.А. Карлова, при ЭС основополагающим следует считать именно тяжесть состояния больного, а не временной показатель длительности ЭС. Состояние больного расценивается как ЭС уже при нескольких припадках, если он находится в сопоре и тем более в коме [2].
Вопрос об эффективности, переносимости и безопасности противосудорожной терапии детей и взрослых при затяжных приступах и ЭС остается по-прежнему актуальным [9–12].
Американскими эпилептологами в 2016 г. на основе обзора литературы с использованием базы MEDLINE, Embase, Current Contents и Cochrane library проанализированы рандомизированные контролируемые исследования противосудорожной терапии судорог продолжительностью более 5 минут [13]. Всего было найдено 38 рандомизированных контролируемых исследований. Только 4 из них имели 1-й класс доказательности эффективности, 2 – 2-й и 32 – 3-й класс доказательности.
Для детей внутривенный лоразепам и внутривенный диазепам эффективны при купировании судорог, продолжающихся до 5 минут (уровень доказательности А), в то время как ректальный диазепам, внутримышечный мидазолам, интраназальный и буккальный мидазолам имеют уровень В. Не отмечено значимого различия в эффективности между внутривенным введением лоразепама и диазепама как детям, так и взрослым (уровень А).
По мнению авторов, в отношении детей препараты второй линии терапии проявляют меньшую эффективность [13].
На основании проанализированных данных был предложен алгоритм лечения ЭС (табл. 1).
«Идеальный» противосудорожный препарат для лечения ЭС должен обладать следующими свойствами [1, 4, 12, 14, 15]:
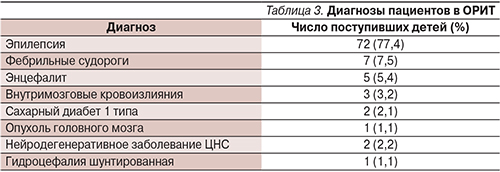
- Быстрое, за 1–3 минуты, проникновение в головной мозг и быстрое создание там терапевтической концентрации.
- Немедленное начало действия до 1 минуты.
- Воздействие на основные звенья патогенеза развития ЭС.
- Продолжительный период действия в течение 24–48 часов в зависимости от способа в/в введения (струйно, капельно).
- Не должен угнетать сознание, дыхание и ухудшать гемодинамику.
- Не должен учащать припадки, т.е. вызывать аггравацию.
- Должен быть безопасным и удобным в применении.
В федеральном руководстве по детской неврологии (под ред. В.И. Гузевой, 2016) представлены алгоритмы терапии затяжных серийных приступов и ЭС [3]. В РФ средством первой очереди выбора является диазепам (остальные отсутствуют на фармацевтическом рынке) [9, 16]. Из препаратов второй очереди выбора наиболее широко в педиатрической практике используется вальпроевая кислота в виде форм для парентерального введения [10, 15–17].
Вальпроат максимально соответствует требованиям, предъявляемым к «идеальному» противосудорожному средству из всех прописанных в Европейском протоколе лечения ЭС препаратов [1, 3, 7, 12]. Он обладает патогенетическим механизмом действия на эпилептиформную активность в ЦНС: повышает синтез и высвобождение ГАМК (γ-аминомасляная кислота) – основного тормозного медиатора ЦНС – и препятствует распространению возбуждения; уменьшает пароксизмальные разряды нейронов за счет блокады вольтаж-зависимых Na- и Ca-каналов (прямое действие на возбудимые клеточные мембраны); снижает высвобождение β-гидроксимасляной кислоты и препятствует генерации возбуждения, вызванного активацией NMDA (N-метил-D-аспартат)-рецепторов глутамата [4].
Во избежание развития тяжелого повреждающего действия ЭП на головной мозг терапия должна быть начата как можно раньше, но обязательно с учетом спектра безопасности применяемого антиконвульсанта.
Быстрота/продолжительность эффекта препаратов, внутривенно применяемых при ЭС, представлена в табл. 2 [14].
Конвулекс – готовый к применению раствор для внутривенного введения; в ампуле объемом 5 мл находится 500 мг действующего вещества.
В отличие от бензодиазепинов препараты вальпроевой кислоты не влияют на гемодинамику и дыхание, поэтому могут применяться внутривенно и при необходимости струйно пациентами любого возраста. Кроме того, они не вызывают седации, поэтому их применение не грозит усугублением расстройств сознания [3].
В Морозовскую ДГКБ в течение 2015 г. поступили 102 063 ребенка, из них по экстренным показаниям – 66 852 (65,5%). Дети по экстренным показаниям были доставлены бригадами скорой помощи в 32 743 (49%) случаях, в остальных – поступали самостоятельно («самотек»). Из всех детей, поступивших в Морозовскую ДГКБ по поводу остро возникших нарушений состояния здоровья, у 226 (0,34%) детей патологии не выявлено (реактивные состояния, нарушения поведения и др.).
Как видно, в педиатрической практике половина всех поступлений в стационар связана с экстренными состояниями, требующими неотложных диагностических и лечебных мероприятий, поэтому разработка диагностических и лечебных алгоритмов при ведении тех или иных синдромов значительно облегчает работу педиатрических специалистов.
С диагнозом эпилепсия, эпилептические синдромы и другие пароксизмальные расстройства (G40) поступили 1714 детей, из них 1146 с диагнозом «эпилепсия».
Нами были проанализированы истории болезни детей, поступивших в ОРИТ Морозовской ДГКБ с диагнозом «судорожный синдром» в течение 6 месяцев 2015 г. Критерием отбора было наличие эпилептических судорог как основного направляющего диагноза в ОРИТ. Всего таких историй болезни было 93. Возраст детей – от 6 месяцев до 7 лет (средний возраст – 8,1 года), распределение по полу мальчики:девочки – 54:39. Диагнозы пациентов в ОРИТ после обследования представлены в табл. 3.
Поступление в ОРИТ было связано с развившимися эпилептическими судорогами (впервые возникшие, затяжные), которые продолжались более 10–15 минут.
Основную группу составили пациенты с эпилепсией, из которых только у троих детей судороги возникли впервые (эти дети не имели признаков воспаления, не лихорадили, переведены в неврологическое отделение с диагнозом «эпилепсия»). Остальные 69 пациентов уже имели диагноз «эпилепсия» и получали противосудорожную терапию, при этом преобладали симптоматические и криптогенные формы эпилепсии (65 случаев), у 10 отмечено фармакорезистентное течение эпилепсии.
Ухудшение состояния этих пациентов было связано с:
- интеркуррентными заболеваниями (респираторная инфекция, бронхит, пневмония);
- нарушением приема антиконвульсантов (пропуск приема, самостоятельная отмена);
- коррекцией противосудорожной терапии;
- фармакорезистентностью при тяжелых формах эпилепсии.
Типы приступов, отмеченных у пациентов, представлены на рис. 3.
Улучшение состояния и купирование приступов отмечалось после начала симптоматической терапии (жаропонижающая, гормонатерапия, антибиотикотерапия, дегидратационная и др.). У 5/7 детей с фебрильными судорогами после однократного введения диазепама.
У подростка с сахарным диабетом 1 типа и идиопатической генерализованной эпилепсией в анамнезе генерализованный тонико-клонический приступ возник на фоне гипогликемического состояния и после самостоятельной отмены противосудорожной терапии (топирамат). После введения раствора глюкозы состояние улучшилось в течение суток, приступ не повторялся.
У ребенка с шунтированной гидроцефалией приступ был купирован введением гормонов.
У 87 пациентов использовался препарат второй очереди выбора для купирования ЭС – вальпроевая кислота (раствор Конвулекса для парентерального введения) в стартовой дозе 30 мг/кг/сут. У 41/87 (47,1%) пациента состояние было расценено как ЭС, у остальных 46 – затяжные ЭП.
Пациенты с эпилепсией, получавшие до поступления в ОРИТ вальпроевую кислоту в таблетках, переведены на парентеральное введение с коррекцией соматического статуса. В течение 30–60 минут после начала внутривенного введения вальпроата (раствор Конвулекса) судороги были купированы у 46/87 (52,8%) детей.
Увеличение дозы вальпроевой кислоты (Конвулекса) с 30 мг/кг/сут до 40–50 мг/кг потребовалось 15 детям из-за недостаточной эффективности (урежение, но сохранение приступов). После коррекции дозы Конвулекса купировать приступ удалось у 51/87 (70%) пациентов.
Монотерапия Конвулексом парентерально проводилась в 29 случаях, дуотерапия – в 37, три антиконвульсанта использовались 21 пациентом.
Комбинации парентерального введения Конвулекса с другими антиконвульсантами представлены в табл. 4.
На фоне введения вальпроата (Конвулекса) ухудшение состояния в виде учащения приступов отмечено в 2 случаях, что потребовало отмены препарата. Оба ребенка поступили в ОРИТ с диагнозом «нейродегенеративное заболевание». Дети обследовались генетиком в Центре орфанных заболеваний, исключалась митохондриальная патология.
У 8 пациентов парентеральное введение Конвулекса не привело к исчезновению судорог и потребовало коррекции противосудорожной терапии: в 3 случаях использовали γ-оксимасляную кислоту, в 5 – тиопентал. Наиболее эффективным парентеральный вальпроат (Конвулекс) оказался при купировании вторично-генерализованных и сложных фокальных приступов, при миоклонических приступах эффект отмечен на более высоких дозах – до 50 мг/кг/сут. Дети с изначально фармакорезистентным течением эпилепсии хуже отвечали на терапию, так же как и пациенты с симптоматическими формами и, вероятно, генетически обусловленными судорогами.
Средняя доза Конвулекса, вводимая в ОРИТ детям с затяжными ЭП и ЭС, составила от 30 до 50 мг/кг/сут (во всех случаях терапия Конвулексом стартовала с дозы 30 мг/кг).
Побочных эффектов со стороны крови, дыхания, аллергических реакций при использовании парентеральной формы Конвулекса, потребовавших его отмены, в нашем наблюдении отмечено не было.
Заключение
Эпилепсия и ЭП различной этиологии являются одной из наиболее частых причин госпитализации в ОРИТ педиатрических стационаров. Конвулекс имеет удобную форму выпуска (раствор для внутривенного введения), что облегчает его использование в отделениях интенсивной терапии. Данное лекарственное средство обладает благоприятным профилем безопасности, он не вызывает нарушения сердечного ритма и выраженной седациии, не угнетает функцию дыхания, не ухудшает неврологический статус, не снижает артериальное давление.
Опыт использования раствора вальпроевой кислоты (Конвулекс) для парентерального введения в ОРИТ Морозовской ДГКБ продемонстри-ровал достаточную эффективность и безопасность при его использовании как при эпилепсии, так и при ЭП на фоне соматических заболеваний.



