Введение
Расхождения в оценке стадии рака предстательной железы (РПЖ) до и после операции по данным различных исследований составляет от 30 до 60%. [1] Чаще всего стадия оказывается заниженной. Несмотря на применение всех современных методов обследования пациентов с гистологически верифицированным РПЖ, ошибки стадирования продолжают оставаться весьма актуальной проблемой. Бесспорно, точная дооперационная диагностика необходима для определения прогноза развития онкологического процесса, объема и характера хирургического вмешательства. В этом ретроспективном исследовании мы оценили диагностическую точность результатов магнитно-резонансной томографии (МРТ), сравнив полученные данные с послеоперационным гистологическим заключением [2].
Материал и методы
В клинике урологии МГМСУ им. А.И. Евдокимова на базе ГКБ-50 проведено ретроспективное исследование историй болезни 360 пациентов, перенесших радикальную простатэктомию с февраля 2009 по март 2014 г.
Выполнено сравнение предоперационных протоколов МРТ малого таза с результатами гистологического исследования операционного материала. Фиксировались такие формальные параметры, как наличие экстракапсулярного распространения опухоли и инвазия семенных пузырьков (ИСП). Все МРТ выполнялись не ранее чем через 4 недели после биопсии ПЖ. Демографические показатели пациентов представлены в табл. 1.
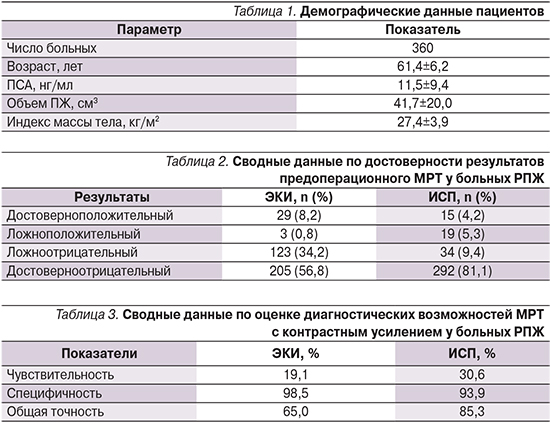
Средний возраст пациентов составил 61,4±6,2 года (от 48 до 74 лет). Объем ПЖ колебался от 11 до 120 см3 и составил в среднем 41,7±20,0 см3.
Проведено определение чувствительности, специфичности и общей точности МРТ малого таза пациентов с РПЖ отдельно по двум признакам: экстракапсулярная инвазия (ЭКИ) и ИСП опухолью традиционными статистическими методами с использованием приведенных ниже формул [3].
На первом этапе работы полученные результаты сопоставления данных по каждому признаку были разделены на 4 группы и формально озаглавлены:
Достоверноположительный (ДП) результат – распространение опухоли выявлено при МРТ и подтверждено гистологическим исследованием.
Ложноотрицательный результат (ЛО) – распространение опухоли не выявлено при МРТ, но подтверждено гистологическим исследованием.
Ложноположительный результат (ЛП), или т.н. гипердиагностика. Распространение опухоли заподозрено при МРТ и отсутствовало в заключении патоморфолога.
Достоверноотрицательный результат (ДО) – отсутствие распространения опухоли по результатам МРТ, что совпадает с гистологическим заключением.
На втором этапе исследования с использованием приведенных ниже формул выполнен расчет показателей, характеризующих диагностическую значимость МРТ: чувствительности (способности выявлять заболевание), информативности – соотношения правильных заключений к общему числу окончательных диагнозов; специфичности – способности метода отвергать заболевание, констатировать его отсутствие там, где его действительно нет; общей точности – соотношения числа ДП- и ДО-заключений к общему числу окончательных диагнозов.
Для этого использовались приведенные ниже формулы [3].

Следует отметить, что, согласно дизайну исследования, были проанализированы заключения МРТ из разных лечебно-профилактических учреждений, что выполнено нами абсолютно сознательно для максимального приближения полученных результатов к стандартам «реальной клинической практики». Выполнение МРТ в одном лечебной учреждении на одном аппарате одним специалистом существенно снизило бы возможность экстраполировать полученные результаты на реально существующую ситуацию. При этом все гистологические заключения получены из нашей собственной кафедральной патоморфологической лаборатории. Несмотря на то что стандарты выполнения МРТ больных РПЖ неоднократно подчеркивали более высокую диагностическую ценность использования эндоректального датчика и/или напряженности магнитного поля 3 Тл, высокая стоимость и малая доступность таких исследований заставили нас отказаться от такого сужения критериев включения пациентов в исследование. Подавляющему большинству пациентов (74,3%) МРТ выполнена без эндоректального датчика с напряженностью магнитного поля 1,5 Тл. Единственным обязательным условием при выполнении МРТ стало применение контрастного усиления.
Результаты
При анализе результатов МРТ 360 включенных в исследование пациентов у 32 (8,9%) из них зафиксировано наличие ЭКИ. При сопоставлении этих результатов с данными гистологического исследования выяснилось, что у 3 из 32 (т. е. у 9,4%) эти данные не подтвердились. В то же время имевшие место по данным гистологического исследования 123 случая ЭКИ не были зарегистрироапны при МРТ.
Из 360 МРТ ИСП описана в 34 случаях, из которых 19 оказались ложными и 15 подтвердились по результатам гистологического исследования. Не диагностированными оказались 34 случая. В сводной табл. 2 приведены данные по частоте ложноположительных, ложноотрицательных, достоверноположительных и достоверно-отрицательных результатов МРТ у исследованных нами больных.
В нашем исследовании МРТ малого таза зарегистрировано только 19,1% случаев ЭКИ из гистологически подтвержденных, что доказывает низкую чувствительность данного метода в отношении прогноза распространения опухоли простаты за границы пораженного органа. С другой стороны, из 32 ЭКИ, зафиксированных при МРТ, патоморфологическое исследование опровергло это утверждение только в отношении 3 пациентов. Таким образом, специфичность предоперационной МРТ в диагностике ЭКИ составила 98,5% и может быть расценана как высокая.
На рис. 1 приведены результаты МРТ пациента Ш 1947 г.р. с поражением капсулы ПЖ. Зона поражения отмечена стрелками.

Соотношение числа достоверноположительных и достоверноотрицательных заключений по ЭКИ к общему числу окончательных диагнозов (общая точность) составило 65%, что может быть расценено как приемлемое.
Анализ диагностической ценности МРТ в выявлении ИСП показал низкую чувствительность этого исследования – 30,6%. При этом, как и в случае с ЭКИ, способность МРТ «исключить» наличие распространения опухолевого процесса на семенные пузырьки была очень высокой – 93,9%.
Таким образом, можно говорить о высокой специфичности МРТ для определения поражения семенных пузырьков. Общая точность диагностики ИСП при помощи МРТ с контрастным усилением составила 85,3%.
На рис. 2 приведены результаты МРТ пациента К. 1947 г.р. с распространением опухоли на основание сменных пузырьков. Зона поражения отмечена стрелками.
В табл. 3 приведены окончательные результаты оценки специфичности, чувствительности и общей точности МРТ с контрастным усилением для определения наличия ЭКИ и поражения семенных пузырьков у больных РПЖ.
Обсуждение
Приходится признавать, что несмотря на все усилия последних десяти лет, пристальный интерес урологов всего мира к проблеме ранней диагностики РПЖ и стремительный технический прогресс, мы по-прежнему ощущаем острую нехватку в достоверных и информативных методах предоперационного обследования больных раком простаты. План лечения пациента напрямую зависит от распространенности опухолевого процесса, его локализации и прочих пространственных и качественных характеристик, способных при малейшем изменении исходных данных полностью поменять прогноз течения заболевания. Лучевая диагностика вместе с морфологическим исследованием служит основой диагностического поиска. Наиболее информативным из всех методов визуализации ПЖ, бесспорно, остается МРТ. Одним из обязательных требований к включению специалиста в рабочую группу экспертов Европейского общества урогенитальных радиологов являются его участие в исследованиях, сравнивающих результаты заключений протоколов МРТ с заключениями патоморфологов, совместная работа с урологами и т. д. [4].

В рекомендуемый протокол МР-исследования ПЖ Европейское общество урогенитальных радиологов в 2012 г. включило следующие требования: напряженность магнитного поля 3 Тл, при 1,5 Тл предпочтительно использовать эндоректальный датчик, изображение должно включать весь орган, Т2-взвешенное изображение в аксиальной, фронтальной, сагитальной плоскостях с толщиной среза 3 мм, диффузно-взвешенное изображение, динамическое МРТ с контрастным усилением [4, 5]. С другой стороны, реалии нашего здравоохранения значительно лимитируют применение столь высоких стандартов. Доступность МР-аппаратов с мощностью в 3 Тл и эндоректальных катушек является серьезной проблемой даже для жителей крупных городов РФ.
В подавляющем большинстве случаев к нам обращаются пациенты, выполнившие исследование на аппаратах 1,5 Тл без применения дополнительных датчиков.
Задачей нашего исследования было выяснить валидность таких исследований и целесообразность их рутинного выполнения. В сравнительном анализе, представленном нами ниже, мы не приводим данных отечественной литературы (процент чувствительности, специфичности и общей точности МРТ малого таза при стадировании РПЖ) по причине отсутствия подобных обзорных работ.
В мировой литературе растет количество публикаций, посвященных диагностической точности МРТ ПЖ. Обращает на себя внимание тот факт, что большая часть зарубежных исследований по данной проблеме выполнена на небольших группах пациентов, что, с нашей точки зрения, не всегда информативно (табл. 4) [6]. Другим общим недостатком всех найденных нами публикаций является, по нашему мнению, слишком академический дизайн исследований, подразумевавших выполнение всех МР-томографий на одном аппарате одним и тем же исследователем. По числу пациентов наши данные можно сравнить с полученными Cornud и соавт., но и он приводит только результаты собственных исследований [7]. К тому же он выполнял МРТ через 2–3 недели после биопсии, а не через 4, как в нашем протоколе.
Из общей картины выделяются результаты, приведенные в публикациях Ватes и Presti. Первый приводит данные о 100%-ной чувствительности при определении ИСП, второй – о 91%-ной чувствительности при ЭКИ. Эти данные значительно отличаются от полученных другими специалистами, и различия, вероятно, могут быть обусловлены небольшим количеством наблюдений.

Piotr Kozlowski и соавт. приводят убедительные аргументы в пользу применения динамического контрастного усиления. В их исследовании патоморфологические заключения сравнивались с данными МРТ (внешняя катушка на 1,5 Тл), выполненными в режимах диффузно-взвешенного изображения при его комбинации с динамическим контрастным усилением и без такового. При этом зафиксировано увеличение чувствительности метода с 54 до 87% в группе, где выполнялось контрастное усиление [8].
По данным Nicolas Bloch и соавт., МРТ с напряженностью магнитного поля 1,5 Тл высокого пространственного разрешения (воксел 1,79 мм3) в комбинации с динамическим контрастным усилением и эндоректальной катушкой дает значительные преимущества в диагностике РПЖ и может повышать чувствительность до 86%, а специфичность до 95% [9].
Несмотря на формальные различия в дизайне исследований, сохраняется некоторое единство общей картины, свидетельствующей о высокой специфичности метода при показателях чувствительности, оставляющих желать лучшего.
Выводы
На основании полученных нами данных мы утверждаем, что МРТ малого таза с применением контрастного усиления на этапе дооперационной подготовки целесообразно выполнять всем пациентам с РПЖ. Наши данные являются одним из звеньев в цепочке публикаций, посвященных стандартизации подхода к МРТ-исследованиям в онкоурологии. Чувствительность этого метода во многом зависит от опыта специалиста лучевой диагностики и технических возможностей оборудования, но полученные результаты, безусловно, обнадеживают. Общая точность применения МРТ в определении наличия ЭКИ рака простаты может быть признана как приемлемая – 65%. Общая точность применения МРТ для определения ИСП может быть оценена как высокая – 85,3%.
В случае выявления ЭКИ и поражения ИСП по результатам МРТ эти данные следует принимать в расчет при определении стадии заболевания и формировании плана оперативного вмешательства, поскольку специфичность таких изменений весьма высока – 98,5 и 93,9% соответственно.
Результаты нашей работы могут быть экстраполированы в «реальную клиническую практику», поскольку критерии включения пациентов в данное исследование можно признать соответствующими стандартам «реальной клинической практики».



