Введение
На сегодняшний день радикальная простатэктомия (РПЭ) является основным методом лечения локализованного рака предстательной железы (РПЖ). Смертность от этого заболевания в течение 15 лет с момента выполнения радикальной простатэктомии составляет 7–20%. При этом выживаемость без биохимического рецидива заболевания за аналогичный период наблюдений может достигать 75% [1, 2]. Необходимо отметить, что эти данные были получены в результате наблюдения за пациентами, перенесшими открытую радикальную позадилонную простатэктомию (РПЛПЭ), которая была выполнена в ряде крупных европейских клиник. Однако сегодня в США и странах Западной Европы большинство таких операций выполняется с помощью роботической системы DaVinci [3].
Согласно положению ВОЗ, полное здоровье – это не только избавление от заболевания, но и психическая, эмоциональная, физическая и социальная реабилитация после перенесенного лечения. Иными словами – это радикальное избавление от заболевания и высокое качество жизни. Независимо от техники ее выполнения РПЭ преследует цель избавления пациента от злокачественного процесса в ПЖ и является, по сути, онкологической операций. Именно поэтому анализ онкологических результатов операции представляет наибольший интерес для оценки эффективности хирургических методик. Существует несколько формальных критериев оценки онкологической эффективности – фиксация частоты позитивного хирургического края (ПХК), биохимический рецидив, общая и раково-специфическая выживаемость [5].
При оценке качества жизни после РПЭ учитываются такие критерии, как общая оценка пациентом результатов лечения, сексуальная реабилитация, способность удерживать мочу и т.д. Недержание мочи – одно из самых социально дезадаптирующих и поэтому крайне негативных последствий РПЭ. Проводя обязательную беседу с пациентом и его родственниками перед операцией, мы в клинике традиционно обсуждаем возможные осложнения, последствия и несостоятельность хирургического лечения. Исходя из опыта подобных бесед, не бывает пациентов, спокойно относящихся к перспективе возможного недержания мочи после операции. Даже ухудшение или утрата сексуальной функции не вызывает столько беспокойства, как недержание мочи [6].

Мы провели сравнительный анализ эффективности робот-ассистирован-ной (РА) РПЭ и РПЛПЭ c позиции достижения оптимального онкологического и функционального результатов.
Материал и методы
В настоящее ретроспективное исследование вошли две группы пациентов с верифицированным локализованным РПЖ, перенесших хирургическое лечение в период с декабря 2008 по декабрь 2013 г. в клинике урологии МГМСУ им. А.И. Евдокимова. Первую группу составили 512 пациентов, которым была выполнена РА РПЭ. Вторую группу составил 71 пациент, перенесший РПЛПЭ. Медиана наблюдения составила в группе РА РПЭ 38,9 (max 63,9), в группе РПП – 22,6 месяца (max 46). Группы были сравнимыми по возрасту, сопутствующей патологии и онкологическим характеристикам. Подробная демографическая характеристика пациентов приводится в табл. 1.
На рис. 1 представлено распределение пациентов согласно исходному баллу злокачественности по системе градации Глисона. В обеих группах подавляющее большинство пациентов до операции имели балл Глисона 3+3=6 и лишь у 6% пациентов в каждой группе суммарный балл превышал 8 при различном сочетании первичного и вторичного баллов.
Основным онкологическим показателем, отражающим распространенность опухолевого поражения, является стадия заболевания по системе TNM. На рис. 2 приведено распределение больных согласно дооперационно выставленным стадиям заболевания в процентах в обеих исследуемых группах. Не отмечено статистически достоверной разницы этого показателя между группами (р=0,013).
Желая структурировать прогноз и жалобы пациентов, мы выделили два понятия – немедленное удержание мочи (достижение полного контроля над мочеиспусканием в течение первых 3 суток после удаления уретрального катетера) и собственно удержание мочи – функцию, восстановление которой может быть пролонгировано во времени начиная с 4-го дня после удаление катетера и далее. Абсолютно идеальный результат – полное удержание сразу после удаления уретрального катетера. Под полным удержанием мочи мы понимаем состояние, которое, согласно критериям International Continence Society, определяется как отсутствие подтекания мочи в покое или при физической нагрузке с возможным использованием одной прокладки в сутки в качестве страховочной.
При наличии заинтересованности пациента в сохранении эректильной функции, сумме баллов по шкале Глисона не более 7, признаках локализованного поражения простаты по данным предварительного обследования, ПСА не более 10 нг/мл, мы обеспечили сохранение сосудисто-нервных пучков (СНП). Сохранение СНП оценивалось нами по описанию препаратов патоморфологом в зависимости от наличия структур СНП в удаленном препарате. В зависимости от формулировки заключения мы выделяли частичное сохранение, полное сохранение и отсутствие сохранения СНП.
В группе РА РПЭ сохранение СНП было выполнено 311 (60,5%) пациентам. Из них полное сохранение СНП имело место в 41,5% случаев, а частичное – в 19%. В группе РПЛПЭ сохранение СНП обеспечивалось меньшему проценту пациентов – 46,5%. При этом полное сохранение выполнено 15,3%, частичное – 31,3% больных. Очевидно, что соотношение полного и частичного сохранения СНП составило 2:1 в группе РАРП и 1:2 в группе РПП.
При оценке степени реабилитации эректильной функции кроме факта сохранения СНП нами были сформулированы дополнительные критерии включения и ограничения в технике выполнения оперативных вмешательств, общие для обеих групп.
В группы, где проводился анализ функциональных результатов, не вошли больные, которым в послеоперационном периоде проводилась дистанционная лучевая или гормональная терапия. У всех пациентов, вошедших в группы функционального анализа, исходный балл IIEF превышал 17. Мы исключили использование электрокоагуляции и всех прочих высокоэнергетических методов гемостаза в зоне прохождения СНП, снижая риск температурного повреждения нервной ткани. Сознательно увеличивая потенциальный риск кровопотери, мы использовали преимущественно острое выделение тканей в этой зоне, выполняя последующий гемостаз путем поверхностного прошивания отдельных кровеносных сосудов рассасывающимся монофиломентным шовным материалом 3/0. Во всех случаях обнаружения дополнительной срамной артерии (ДСА) мы выполняли ее сохранение, поскольку, как известно, в 70% случаев ДСА является основным источником кровоснабжения полового члена, а в 10% случае единственным.
Всем пациентам обеих групп, заинтересованным в реабилитации эректильной функции, перенесшим нервосохраняющий вариант операции, в раннем послеоперационном периоде назначался тадалафил в дозе 5 мг/сут ежедневно. Это единственный препарат группы ингибиторов фосфодиэстеразы 5-го типа, рассчитанный на длительное систематическое ежедневное применение. Части пациентов терапию начинали уже на 2-й день после операции, части – после удаления катетера. Рекомендованная продолжительности приема препаратов значилась как «не менее 12 месяцев или до достижении стойкого клинического эффекта».
Эректильная функция считалась восстановленной, если пациент на фоне приема ингибиторов фосфодиэстеразы 5-го типа или без лекарственных средств был способен достичь и поддерживать эрекцию, достаточную для проведения полового акта. При этом домен эректильной функции, согласно опроснику IIEF-5, был >17 баллов.
По истечении 12 месяцев после операции мы задавали пациентам два вопроса: удовлетворен ли он данной операцией и рекомендовал бы он данную операцию своему родственнику или другу? Удовлетворенность операцией регистрировалась при положительном ответе на оба вопроса.
Статистический анализ данных осуществлялся с использованием программы SPSS. С целью проверки корректности применения методов параметрической статистики для всего набора наблюдений рассчитавались коэффициенты асимметрии и эксцесса. При выполнении условий корректной применимости методов параметрической статистики использовались критерии Пирсона и Стьюдента, в противном случае – критерии Колмагорова–Смирнова и Манна–Уитни. Общая безрецидивная выживаемость пациентов в исследуемых группах вычислялась с применением метода Каплана–Мейера.

Результаты
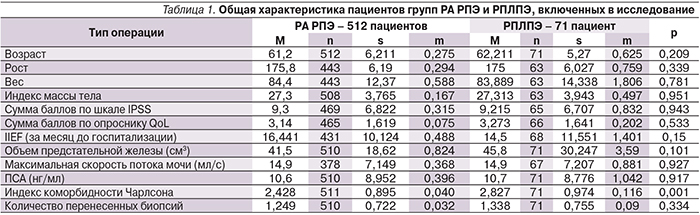
Распределение больных по стадиям заболевания, уточненным после РПЭ, приведено на рис. 3.
Сравнительный анализ послеоперационной стадии заболевания выявил тождественность данных в обеих группах. Это еще раз доказывает тот факт, что не существует формальных онкологических критериев выбора тактики хирургического лечения локализованного РПЖ. Обе сравниваемые хирургические методики могут быть предложены пациенту с РПЖ, признанным локализованным по данным предоперационного обследования. Ограничения касаются лишь пациентов с отягощенным кардиологическим статусом и выраженным спаечным процессом в брюшной полости, при которых имеются противопоказания к выполнению операций трансабдоминальным доступом в условиях пневмоперитонеума.
Из представленных в табл. 2 данных следует, что тазовая лимфаденэктомия (ТЛАЭ) была выполнена примерно трети пациентам независимо от использованной методики операции, т.к. показания к выполнению ТЛАЭ универсальны. Мы выставляем показания к этой операции на основании данных номограмм Партина и Бриганти. Если по данным номограммы вероятность поражения лимфатических узлов менее 2%, и признаки тазовой лимфаденопатии при МРТ отсутствуют, лимфаденэктомия не выполнялась. Модифицированная лимфаденэктомия (зона запирательной ямки) выполнялась всем пациентам с вероятностью поражения лимфатических узлов от 2 до 10%. Расширенная лимфаденэктомия применялась при вероятности поражения, превышающей 10%. Частота поражения регионарных лимфоузлов колебалась в пределах 1% от всех выполненных операций, что ожидаемо от пациентов с исходно локализованной формой заболевания. Статистически значимых различий в частоте поражения лимфоузлов в группах РА РПЭ и РПЛПЭ не обнаружено (p=0,33).
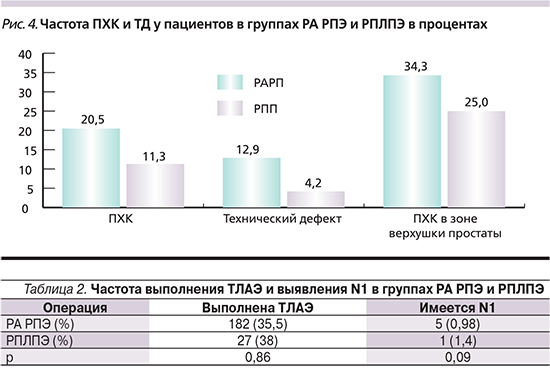
Следующий показатель, который подвергся сравнительному анализу в ходе данной работы, – частота ПХР и технических дефектов. Мы предлагаем ввести новый термин – «технический дефект» (ТД) – в список стандартно описываемых параметров патоморфологического исследования после РПЭ. Под ТД мы предлагаем понимать ситуацию, когда имеет место ПХК в отсутствие ЭПИ в зоне ПХК. При этом у того же больного ЭПИ может быть в другом месте и там может определяться или не определяться ПХК. Само понятие ПХК имеет большое значение для прогноза течения заболевания и определения необходимости последующего раково-специфического лечения. К таким вариантам лечения относится назначение гормональной и/или дистанционной лучевой терапии. Не оспаривая этот термин, мы вводим понятие технического дефекта для выявления «качества работы хирурга». Если ПХК имеет место в зоне ЭПИ – «вины хирурга» в этом нет, т. к., не имея возможности интраоперационного экспресс-определения характеристик тканей на наличие злокачественности, любой хирург имеет шанс допустить ПХК в зоне ЭПИ. Но если ПХК определяется вне зоны ЭПИ – это «вина» хирурга. В нашей клинике учет количества ТД используется с целью совершенствования собственной хирургической техники каждым отдельным специалистом. Если кто-то в своей практике допускает много технических дефектов (больше других), он должен пересмотреть свое пониманием онкологических принципов операции и более бережно выполнять выделение предстательной железы и СНП.
 На рис. 4 представлено сравнение частот ПХК и ТД в группах РА РПЭ и РПЛПЭ. Очевидна закономерность, согласно которой в группе РА РПЭ частота ПХК превышает таковую в группе РПЛПЭ в 2, а частота ТД – в 3 раза (p=0,002). Треть ПХК в группе РАРП и четверть ПХК в группе РПП располагались в зоне верхушки ПЖ. Процент апикального ПХК подсчитан относительно общего количества ПХК в каждой группе, а не относительно числа пациентов в группах.
На рис. 4 представлено сравнение частот ПХК и ТД в группах РА РПЭ и РПЛПЭ. Очевидна закономерность, согласно которой в группе РА РПЭ частота ПХК превышает таковую в группе РПЛПЭ в 2, а частота ТД – в 3 раза (p=0,002). Треть ПХК в группе РАРП и четверть ПХК в группе РПП располагались в зоне верхушки ПЖ. Процент апикального ПХК подсчитан относительно общего количества ПХК в каждой группе, а не относительно числа пациентов в группах.
Одним из основных факторов, существенно увеличивающих риск ПХК при РАРП, является необходимость сохранения анатомической целостности СНП. Мы провели анализ зависимости частоты встречаемости ПХК и степени сохранности СНП в двух группах больных. Степень сохранности СНП мы оценивали на основании заключения патоморфолога, который описывал «отсутствие», «частичное присутствие» и «полноценное присутствие» структурных элементов СНП в препарате удаленной ПЖ и семенных пузырьков.
В соответствии с этими формальными критериями мы ввели понятия частичного и полного сохранения СНП.
В табл. 3 приведены сведения о числе пациентов с признаками наличия ПХК при разной степени сохранности СНП в обеих исследуемых группах в процентах. Необходимо отметить, что общее число пациентов в этой таблице несколько меньше, чем общее количество больных в каждой из исследуемых групп. Причина в отсутствии данных о СНП в заключении патоморфолога для 37 больных группы РА РПЭ и двух – группы РПП. Очевидно, что независимо от степени сохранения пучков ПХК в 2,5 – 4,0 раза реже определялся в группе РПЛПЭ. Логично предположить, что более тщательное сохранение СНП может быть фактором риска ПХК. При этом известно, что сохранение СНП является крайне важным позитивным прогностическим фактором и приводит к существенному увеличению доли пациентов с реабилитированной эректильной функцией и быстрым восстановлением удержания мочи.
Мы изучали частоту биохимических рецидивов РПЖ, выявленных в результате ежеквартального контроля уровня ПСА сыворотки крови после операции, проведенной всем без исключения пациентам. Медиана наблюдения составила в группе РА РПЭ 38,9 (max 63,9), в группе РПЛПЭ – 22,6 месяца (max 46). Согласно решению международного консенсуса, биохимическим рецидивом после хирургического лечения считается повышение ПСА ≥0,2 нг/мл как минимум в двух последовательно выполненных измерениях.
В табл. 4 приведены данные о частоте биохимического рецидива в обеих исследуемых группах.
Последним и наиболее важным критерием, оценивающим эффективность лечения пациентов с локализованным РПЖ, включенным в наше исследование, стал анализ выживаемости. На основании анализа данных общей выживаемости и данных частоты биохимического рецидива построены оценки кривых функций выживаемости в группах РАРП и РПП за 4-летний период (рис. 5).
Визуальный анализ графического представления функций выживаемости, построенных по методу Каплана–Мейера, показывает расположение кривых выживаемости, приближающееся к параллельному, в когортах РА РПЭ и РПЛПЭ, что свидетельствует о незначимых ежегодных колебаниях уровня смертности в данных группах и идентичности онкологического результата лечения.
Общая выживаемость пациентов за период наблюдения составила 98,2% в группе РА РПЭ и 98,6% – в группе РПЛПЭ. Обращает на себя внимание, что ни у одного из пациентов причиной смерти не стал РПЖ. Наиболее частая причина летальных исходов – сердечно-сосудистые заболевания, в частности инфаркт миокарда. Нам не удалось выявить закономерности между баллом по шкале Глисона, стадией заболевания, уровнем ПСА и возрастом с причиной смерти и продолжительностью жизни после операции.
С учетом вышеизложенного раковоспецифическая выживаемость по нозологии «рак предстательной железы» за время наблюдения в обеих группах может быть признана 100%.
Оценивая немедленное удержание мочи, мы использовали три определяющих это понятие критерия – способность удержать мочу при изменении положения тела, способность прервать струю мочи при мочеиспускании и удерживать мочу в положении лежа. На рис. 6 приведен процент пациентов, у которых имело место немедленное удержание мочи в группах РА РПЭ и РПЛПЭ.
Пациентов, демонстрировавших немедленное удержание мочи после удаления катетера, было в 1,7 раза больше в группе РА РПЭ по сравнению с РПЛПЭ – 33,2 против 19,6%. (р=0,002). С целью выявления влияния демографических, интраоперационных и послеоперационных факторов на немедленное удержание выполнен корреляционный анализ с поправкой на тип операции. Таким образом, мы определили, что индекс массы тела, объем простаты, наличие средней доли, реконструкция шейки мочевого пузыря и длительность катетеризации не оказывают влияния на вероятность немедленного удержания мочи (все коэффициенты корреляции принимали значение ниже 0,2). Фактор сохранения СНП был единственным, продемонстрировавшим корреляционную зависимость (КК 0,45) с немедленным удержанием мочи.
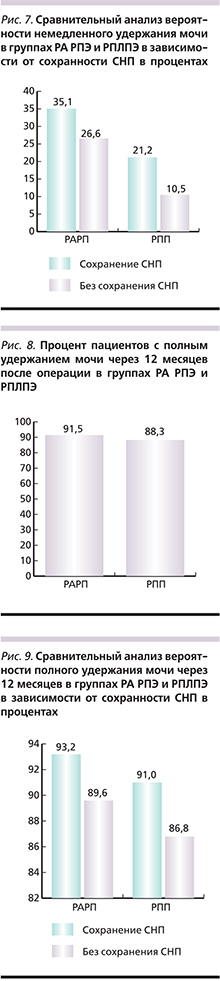
Внутри каждой из групп мы подсчитали вероятность немедленного удержания мочи у пациентов, которым выполнялось сохранение СНП, по сравнению с теми, которым этого сохранения выполнено не было. Полученные нами данные приведены на рис. 7.
Существует очевидная зависимость вероятности немедленного удержания мочи и сохранности СНП. В группе РПЛПЭ эта закономерность особенно очевидна – сохранение СНП привело к увеличению вероятности исследуемой функции в два раза (т.е. 100%-ный прирост), что статистически значимо (р<0,001).
Несмотря на крайнюю привлекательность перспективы немедленного удержания, предварительные беседы с пациентами свидетельствуют, что большинство из них относительно спокойно оценивают перспективу возможного частичного недержания мочи сразу после операции, но крайне негативно относятся к сохранению недержания в долгосрочной перспективе.
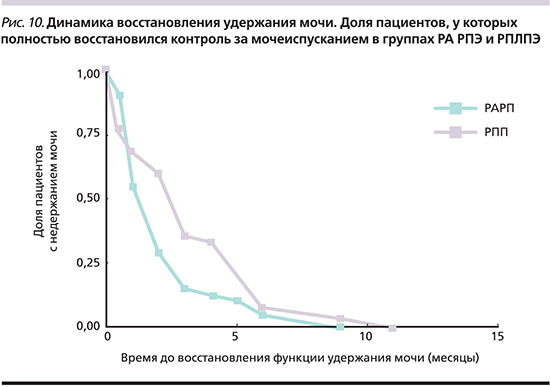
Восстановление функции удержания мочи после операции прослеживалось нами на протяжении 12 месяцев в формате ежеквартального опроса. На рис. 8 представлены результаты этого анализа в графическом отражении.
Согласно полученным нами результатам, полное удержание мочи имело место у 91,5% пациентов группы РА РПЭ и 88,3% группы РПЛПЭ (p=0,022). Очевидно преимущество техники РА РПЭ над РПЛПЭ.
Графическое отображение частоты полного удержания мочи в процентах в подгруппах приведено на рис. 9.
Проведя анализ влияния сохранения СНП внутри каждой из групп, становится очевидным, что, несмотря на несколько больший процент полного удержания мочи в группе РА РПЭ по сравнению с РПЛПЭ, результаты с учетом нервосбережения оказались более близкими. Как без сохранения СНП, так и с сохранением последних техника РА РПЭ имела значимые преимущества – 93,2 против 89,6% и 91 против 86,8% соответственно. Анализ прогностической ценности дополнительных гипотетических факторов прогноза полного удержания мочи, таких как индекс массы тела, объем простаты, наличие средней доли, реконструкция шейки мочевого пузыря и длительность катетеризации, не показали никакой зависимости с исследуемым параметром. Коэффициенты корреляции полного удержания мочи с вышеприведенными фаторами составили 0,05, 0,03, 0,14, 0,19 и 0,02 соответственно. Ведущее значение имеет именно техника выполнения операции.
Кроме абсолютных цифр представляет интерес анализ темпов восстановления удержания. На рис. 10 представлен анализ зависимости темпов восстановления полного удержания мочи от времени, прошедшего после операции в группах РА РПЭ и РПЛПЭ. В анализ не вошли пациенты, у которых отмечено немедленное удержание мочи, и те, у которых удержание мочи так и не восстановилось.
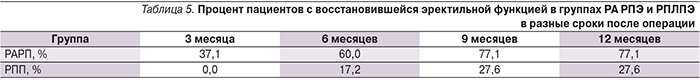
Очевидно, что несколько быстрее процесс восстановления полного удержания мочи проходит у пациентов в группе РА РПЭ по сравнению с тем же показателем в группе РПЛПЭ. Необходимо отметить, что к 6-му месяцу после операции два графика становятся практически идентичными. По Логранговому критерию р=0,008 – различия в динамике восстановлении удержания мочи между РПЛПЭ и РА РПЭ значимы.
Все пациенты группы РА РПЭ, у которых восстановилось полное удержание, достигли этого результата к отметке 9 месяцев после операции. Для пациентов группы РПЛПЭ это время было несколько большим и составило 11 месяцев.
Для большинства пациентов, у которых не отмечено немедленного восстановления полного удержания мочи, вынужденной мерой борьбы с недержанием является использование гигиенических прокладок. Мы подсчитали, что доля пациентов использовавших прокладки (1 и более) после РПЛПЭ, составляет 30,4±4,6 против 8,6±2,9% в группе РА РПЭ (р=0,0001). Надо сказать, что сравнительный анализ количества прокладок не выявил никаких статистически значимых различий между группами – 2,06±0,24 и 2,17±0,29 в группах РПЛПЭ и РА РПЭ соответственно (р=0,78). Таким образом, количество используемых прокладок примерно совпадает, но число пациентов, нуждающихся в их использовании, в группе РПЛПЭ оказалось в 4 раза больше, чем в группе РА РПЭ.
Мы провели анализ частоты восстановления эректильной функции после операции у пациентов в группах РА РПЭ и РПЛПЭ, у которых были сохранены СНП. Если сохранение пучков не проводилось, то в группе РПЛПЭ ни у одного из таких пациентов эректильная функция не восстановилась.
В группе РА РПЭ это произошло у 4,9% пациентов.
Реабилитация сексуальной функции к 12-му месяцу наблюдения после операции была признана удовлетворительной у 77,1% пациентов группы РА РПЭ и у 27,6% группы РПЛПЭ. Относительная разница полученных результатов превышает 00%. Эректильная функция считалась восстановленной, если пациент на фоне приема ингибиторов фосфодиэстеразы 5-го типа или без лекарственных средств был способен достигать и поддерживать эрекцию, достаточную для проведения полового акта. При этом домен эректильной функции, согласно опроснику IIEF-5, был >17 баллов. Темпы сексуальной реабилитации пациентов представлены в табл. 5.

Обращает на себя внимание, что с 9-го по 12-й месяц общий процент пациентов с восстановившейся эректильной функцией не изменился. Эта закономерность выявлена нами в обеих исследованных группах. Крайне демонстративным представляется нам тот факт, что в группе РА РПЭ уже через 3 месяца наблюдения эрекция отмечена у 37,1% пациентов, в то время как в группе РПП никто из больных не восстановил к тому времени эректильную функцию.
Балл IIEF пациентов групп РА РПЭ и РПЛПЭ мы привели в табл. 6. Кроме несколько более низкого послеоперационного балла в группе РПЛПЭ по сравнению с РА РПЭ обращает на себя внимание достижение дооперационного уровня эректильной функции по вопроснику IIEF-5 у 27,3% пациентов группы РА РПЭ.
При этом ни у кого из пациентов группы РПЛПЭ не зафиксировано достижения дооперационных показателей. Хочется отметить очевидно больший процент восстановления эректильной функции в группе РА РПЭ по сравнению с РПЛПЭ и больший процент «полного сохранения СНП», что является доказательством высокой точности и меньшей травматичности РА-операций. Восстановление эректильной функции после РА РПЭ происходит значительно быстрее.
Считается, что удовлетворенность пациента – очень важный показатель и в иерархии целей терапии он должен занимать место не ниже других характеристик качества жизни больного, таких как достижение полного удержания мочи, сохранение эректильной функции и т.д. На рис. 11, 12 приведены результаты анализа общей удовлетворенности лечением в группах РПЛПЭ и РА РПЭ с указанием причин неудовлетворенности, если такая имела место.
Следует отметить, что общая удовлетворенность была существенно выше в группе РА РПЭ – 93,6 против 83,1% в группе РПЛПЭ. Распределение причин неудовлетворенности довольно равномерно. Самым популярным ответом о причинах неудовлетворенности было недержание мочи. Остальные причины – стриктура УША, недостаточная эректильная функция и онкологический результат – занимают примерно равные доли внутри групп РА РПЭ и РПЛПЭ. Интересно, что процент пациентов, высказавших свою неудовлетворенность результатами лечения в связи с наличием у них эректильной дисфункции и недержания мочи, оказался меньше, чем абсолютный процент наличия этих проблем в каждой из групп. Это чуть менее очевидно в отношении недержания мочи. Это несоответствие наводит на мысль, что ценность сохранения эректильной функции как фактора удовлетворенности пациента результатом лечения не столь высока. С другой стороны, относительно «спокойное» отношение пациентов к эректильной дисфункции после операции объясняется тем фактом, что все они были неоднократно предупреждены на дооперационном этапе о возможности подобного осложнения.
Обсуждение
Данные мировой литературы, касающиеся онкологических результатов РА РПЭ, крайне скудны. Лишь в нескольких работах представлены данные о 5-летней частоте биохимического рецидива. В двух работах продолжительность периода наблюдений составила более 60 месяцев [5, 7].
В исследование Menon и соавт. были включены 1384 пациента. Частота безрецидивной выживаемости спустя 3, 5 и 7 лет наблюдения после выполнения РА РПЭ составила 90, 87 и 81% соответственно. Авторы установили, что уровень ПСА, сумма баллов по шкале Глисона, наличие периневральной инвазии и степень риска по шкале D'Amico являются независимыми прогностическими факторами биохимического рецидива. Zorn и соавт. [8] и Samadi и соавт. [9] в своих работах продемонстрировали, что риск биохимического рецидива не меняется в процессе приобретения опыта хирургом. Недостатком обеих работ является небольшой период наблюдения за больными.
Наличие ПХК – известный фактор риска развития рецидива заболевания [4]. Сторонники роботической хирургии говорят о более качественном онкологическом контроле при выполнении РА РПЭ благодаря улучшенной 3D-визуализации [10, 11], что особенно ярко проявляется при апикальной диссекции. Частота позитивного хирургического края варьировала от 6,5 до 32% со средним значением 15%. Следует отметить, что во многих исследованиях не указывается конкретный протокол, согласно которому получают гистологический материал для исследования. Между тем используемая методика изготовления препаратов является одним из тех факторов, которые влияют на частоту выявления ПХР. Среднее значение ПХР для стадии рТ2 равнялось 9% (4–23%), 37% (29–50%) – для стадии рТ3 и 50% – для стадии рТ4. На долю верхушки простаты пришлось 5% случаев (1–7%), передней поверхность простаты – 0,6% (0,2–2%), шейки мочевого пузыря – 1,6% (1–2%), заднелатеральной поверхности простаты – 2,6% (2–21%). Мультифокальный ПХК встречался в 2,2% случаев (2–9%) [10, 11, 12].
Несколько исследований посвящено предполагаемым факторам риска образования ПХК. В одном из наиболее крупных исследований, проведенном Ficcara и соавт., изучались факторы риска ПХР у группы из 322 пациентов [13]. Единственными клиническими прогностическими факторами любого варианта ПХР являлись объем простаты и стадия опухоли. Обширное исследование Patel и соавт., в которое вошли более 8000 пациентов, в т.ч. более 1200 пациентов с ПХР, подтверждает полученные Ficarra и соавт. данные [13,14].
В нескольких работах был оценен риск развития биохимического рецидива после РПЭ в течение 1–43 лет после операции. Он составил 83,5–92,2% для РА РПЭ и 84–92,4% для РПЛПЭ. Это полностью совпадает с полученными нами данными. Единственная работа, в ходе которой было отмечено различие в частоте возникновения биохимического рецидива, было исследование, проведенное Lo и соавт. [15]. Авторы обнаружили наличие биохимического рецидива в 20% случаев после РПЛПЭ (срок наблюдения – 42 месяца) по сравнению с отсутствием рецидива в группе РА РПЭ (срок наблюдения – 6 месяцев). Однако, принимая во внимание различный период наблюдения и столь короткий временной отрезок после РА РПЭ, авторы не смогли выполнить достоверную статистическую обработку результатов. Анализ сравнительных работ, посвященных изучению частоты безрецидивной выживаемости после перенесенных РА РПЭ и РПЛПЭ [12, 16], не выявил статистически значимых различий между роботической и открытой техниками резекции простаты.
Результаты последних литературных публикаций показывают, что пациенты после выполнения им РПЛПЭ удерживают мочу в 60–93% случаев в зависимости от используемого определения «удержание мочи» [17]. Применяемые в роботической системе daVinci оптическая система, трехмерная визуализация изображения, а также инструменты с семью степенями свободы позволяют хирургу осуществлять точные и аккуратные движения и таким образом уменьшать риск повреждения анатомических образований, ответственных за удержание мочи и эректильную функцию. Проанализированные нами статьи свидетельствовали об удержании мочи в 79–93,7% случаев в группе РПЛПЭ и в 74–97% случаев в группе РА РПЭ спустя год наблюдения [18–21]. Hu и соавт сообщили о повышенном в 1,3 раза риске развития недержания мочи у пациентов группы РПЛПЭ [18], тогда как восстановление способности к удержанию мочи быстрее происходит у пациентов после перенесенной РА РПЭ [19]. Анализ литературных данных сильно затрудняет тот факт, что в исследованиях использовались различные определения термина «удержание мочи».
В мировой литературе доступно достаточное количество работ, посвященных попыткам сравнить показатели сексуальной функции у больных после РПЭ. По данным проанализированных нами исследований, сексуальная функция была сохранена у 26–62,8% пациентов после РПЛПЭ и у 55–70% пациентов, перенесших роботическую РПЭ, спустя 12 месяцев наблюдения [16,18–20]. В трех исследованиях отмечена достоверная разница в исследуемом показателе между группами [16, 18,1 9]. Однако в исследование Di Pierro и соавт. [20] были включены лишь 22 пациента, имевших сексуальную активность до операции. В работе Rocco и соавт. [19] нет указаний к применению нервосберегающей методики. Авторы распределили пациентов по возрасту и, проанализировав результаты, пришли к следующему выводу: показатель послеоперационной сексуальной активности выше у пациентов моложе 65 лет. При этом в группе РПЛПЭ исследуемый показатель составил 48% по сравнению с 71% в группе РА РПЭ. В своем популяционном исследовании Hu и соавт.[18] обнаружили повышение риска развития эректильной дисфункции в 1,4 раза после перенесенной РА РПЭ по сравнению с РПЛПЭ. В исследовании, проведенном Krambeck и соавт. [16], не было обнаружено достоверной разницы в показателе сексуальной активности у пациентов после перенесенной РА РПЭ и РПЛПЭ. Обзор исследований за 1990–2005 гг. показал крайне неоднозначные результаты наблюдений за пациентами, которым была выполнена РПЛПЭ по билатеральной нервосберегающей методике. Сохранение эректильной функции наблюдалось в 31–86% случаев [22].
Анализ прогностических факторов в разных публикациях показал, что предоперационные, интраоперационные и послеоперационные различия в выборках пациентов, оказываемом им оперативном пособии и послеоперационном ведении могут оказывать существенное влияние на успех сохранения у пациента эректильной функции. [18, 22] Так, возраст пациента, наличие эректильной функции до операции, а также сопутствующие заболевания оказывают значимое влияние на достижение функционального результата в аспекте эректильной функции [6, 21]. Очевидно, нервосберегающая операция наиболее эффективна у относительно молодых пациентов, ведущих активную половую жизнь и не страдающих тяжелыми сопутствующими заболеваниями.
Выводы
РПЭ была и остается «золотым» стандартом хирургического лечения локализованного РПЖ. Появление РА-методики ее выполнения, существенно улучшившей функциональные результаты этой операции, не оказало значительного влияния на онкологические результаты. По данным анализа современной литературы и нашим собственным данным следует констатировать, что независимо от техники выполнения – позадилонной или РА, РПЭ обеспечивает высокий онкологический результат и удовлетворительные показатели безрецидивной и раково-специфической выжи-ваемости.
С другой стороны, использование РА выполнения РПЭ оказалось существенно более эффективной с точки зрения вероятности послеоперационного удержания мочи и восстановления эректильной функции в течение 12 месяцев после операции. Существенные различия наблюдаются не только в общей доле пациентов, у которых достигнут хороший функциональный результат, но и в темпах восстановления функции.
В результате многофакторного анализа причин, оказывающих влияние на восстановление сексуальной функции и удержания мочи, подтверждение прогностической значимости получено нами для двух факторов – тип операции и сохранение СНП в процессе ее выполнения (p=0,0003).
Субъективный анализ пациентами проведенного лечения показал, что РПЭ, выполненная по показаниям пациентам с локализованным РПЖ, в подавляющем большинстве случаев обеспечивает хороший результат и высокую удовлетворенность проведенным лечением. И тот, и другой показатель выше в группе РА РПЭ по сравнению с РПЛПЭ, что обеспечивается меньшей травматичностью РА-операций.



