Феномен Рейно (ФР) – эпизодическое нарушение периферической циркуляции вследствие локальной артериальной вазоконстрикции дигитальных артерий и кожных сосудов в ответ на воздействие холода или эмоциональный стресс. Он впервые описан французским врачом Морисом Рейно в 1862 г. как «локальная асфиксия конечностей». ФР – одно из самых проблемных заболеваний современной медицины. Это вызвано, с одной стороны, с тем, что традиционно его связывают только с ревматологическими проявлениями или врожденным или приобретенным вазоспазмом, с другой – с отсутствием четких данных об эпидемиологии заболевания. Распространенность ФР в разных странах колеблется от 2,1 до 16,8%. Эпидемиологические различия частично объясняются тем, что в разных исследованиях результаты получены с помощью почтовых или телефонных опросов, вопросников, распространенных случайным образом среди населения, или включением в исследование только лиц, обратившихся за врачебной консультацией по поводу субъективных ощущений, сопровождающих болезнь. В Европе ФР чаще встречается в Великобритании и во Франции, реже – в Испании и Италии. Частота ФР в Российской Федерации составляет около 5–10% [2–5]. Пик заболеваемости приходится на 2–3-ю декады жизни. Среди пациентов преобладают женщины, однако с увеличением возраста отмечается тенденция к повышению заболеваемости среди мужчин. Соотношение мужчины/женщины в возрасте до 50 лет составляет 1:5,2, а в более возрастной группе – 1:1,1 [1]. Клиническая практика свидетельствует о возрастающем числе различных заболеваний, при которых встречается ФР [6]. Этот феномен называют «вторичным синдромом Рейно» (ВСР), т.к. он ассоциируется с конкретным заболеванием.
В последние годы растет число пациентов с цереброваскулярной патологией, вызванной ассоциируемыми с ФР заболеваниями. Особое место среди них занимают хронические формы, вызванные классическими причинами развития цереброваскулярной патологии: артериальной гипертензией, атеросклерозом, курением, сахарным диабетом, употреблением гормональных препаратов (эстрогенов), антифосфолипидным синдромом, злоупотреблением алкоголем и наркотическими препаратами, синдромом апноэ, использованием нитратов и некоторых вазодилататоров (никотиновая кислота, папаверин). Пациенты с ФР наблюдаются у врачей многих специальностей, получают симптоматическое лечение в отсутствие четкого понимания природы этого феномена, т.к. в медицинской литературе применяются разные термины: ФР, синдром Рейно (СР), болезнь Рейно, что существенно затрудняет работу врача. Прежде чем заниматься проблемами диагностики и терапии данного заболевания, необходимо разобраться с терминологией.
Терминология и классификация
Термин «феномен Рейно» используется для обозначения заболевания в целом. В подростковом периоде встречается т.н. юношеский ФР, обусловленный дисрегуляцией сосудистого тонуса в пубертатном периоде. В отличие от физиологического вазоспазма (нормальной реакции сосудов на холод) ФР характеризуется побледнением пальцев без последующей стадии цианоза и быстрым восстановлением при согревании.
Болезнь Рейно (БР) следует рассматривать как самостоятельную нозологическую единицу. Очень часто встречается определение БР как первичного процесса, чему соответствует термин «первичный идиопатический синдром Рейно» (ПСР).
Синдром Рейно (СР) – проявление сосудистой или другой соматической патологии при наличии других заболеваний, называют «вторичным синдромом Рейно» (ВСР). В популяции преобладает ПСР (80–90% от общего числа больных) [7, 8], но клиническая практика свидетельствует о возрастающем числе различных заболеваний, при которых встречается ВСР.
Среди многочисленных попыток классифицировать разнообразные формы СР наиболее полной является созданная L. и P. Langeron, L. Croccel в 1959 г. этиопатогенетическая классификация, которая в современной интерпретации выглядит следующим образом [9]:
- Локальное происхождение ФР (пальцевые артерииты, артериовенозные аневризмы сосудов пальцев кистей и стоп, профессиональная и другая травматизация).
- Регионарное происхождение ФР (шейные ребра, синдром передней лестничной мышцы, синдром резкого отведения руки, поражение межпозвоночного диска).
- Сегментарное происхождение ФР (артериальная сегментарная облитерация, которая может вызывать вазомоторные расстройства в дистальных отделах конечностей).
- ФР в сочетании с системным заболеванием (артериит, артериальная гипертензия, первичная легочная гипертензия).
- ФР при недостаточном кровообращении (тромбофлебиты, травмы вен, сердечная недостаточность, ангиоспазм мозговых сосудов, спазм сосудов сетчатки).
- ФР при поражении нервной системы (конституциональная акродиния, сирингомиелия, рассеянный склероз).
- Сочетание ФР с нарушениями пищеварения (функциональные и органические заболевания пищеварительного тракта, язва желудка, колит).
- ФР в сочетании с эндокринными нарушениями (диэнцефально-гипофизарные нарушения, опухоли надпочечников, гиперпаратиреоз, базедова болезнь, климактерическая менопауза, а также менопауза в результате лучевой терапии и хирургического вмешательства).
- ФР при нарушении кроветворения (врожденная спленомегалия).
- ФР при криоглобулинемии.
- БР при склеродермии.
- Истинная БР.
Этиология патогенез
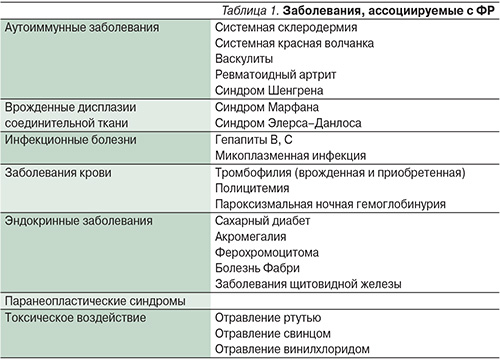
ФР является полиэтиологическим заболеванием с недостаточно ясным механизмом патофизиологических реакций. В неврологической практике чаще всего приходится иметь дело с ВСР, что обусловлено его высокой распространенностью в популяции и ассоциацией с другими, нередко угрожающими жизни больных заболеваниями. ВСР ассоциируется с аутоиммунными, паранеопластическими, дисметаболическими, инфекционными заболеваниями, гематологическими нарушениями и приемом некоторых лекарственных средств [9, 10]. Нельзя исключать как причину ВСР прием лекарственных препаратов, таких как интерферон α, противоопухолевые средства (цисплатин, блеомицин, винбластин, алкалоиды спорыньи, пероральные контрацептивы, β-адреноблокаторы, бромокриптин), кроме этого необходимо исключить токсическое воздействие мышьяка и свинца (табл. 1).
В патогенезе ФР главную роль, несомненно, играет эндотелиальная дисфункция (ЭД), приводящая к дисбалансу между вазодилататорами и вазоконстрикторами вследствие нейромедиаторного дисбаланса, с последующим развитием окислительного стресса [11].
Нарушение функции эндотелия – один из универсальных механизмов патогенеза. ЭД – патологическое состояние, возникающее в результате нарушения регионального кровообращения и микроциркуляции, приводящее к усиленному тромбообразованию и усиленной адгезии лейкоцитов. Наибольшее значение имеет продукция оксида азота, эндотелина-1, серотонина, тромбоксана и ангиотензина, уровень которых у больных СР повышается под воздействием холода [12–17]. Регуляция сосудистого тонуса также вплотную связана с нейропептидами ( связанный с геном кальцитонина пептид, нейропептид Y) и с агентами, взаимодействующими с α-адренорецепторами, что дополнительно усиливает вазоконстрикцию. ЭД может способствовать развитию атеросклероза и атеротромбоза, повышению агрегационной способности моноцитов и тромбоцитов, модуляции гиперкоагуляции и колебаниям содержания липопротеидов низкой плотности, играет важную роль в развитии артериальной гипертензии [11, 12]. Эти феномены приводят к деструкции сосудистой стенки (липогиалиноз) преимущественно в сосудах микроциркуляторного русла. Вследствие этого развивается артериолосклероз, что обусловливает изменение физиологической реактивности сосудов (в т.ч. и периферических). Нарушаются структурно-функциональные свойства эритроцитов и тромбоцитов: ухудшается их способность к деформации, повышается гематокрит, увеличивается вязкость крови, что в свою очередь приводит к нарушению микроциркуляции, дальнейшему уменьшению перфузии, развитию капиллярного стаза [13]. В результате патологических процессов, развивающихся вследствие различных факторов (артериальной гипертензии, атеросклероза, васкулитов, сахарного диабета), происходит дестабилизация ауторегуляции кровообращения, возникает все бóльшая зависимость от состояния системной гемодинамики, также оказывающейся нестабильной. В таких условиях снижение артериального давления (АД) в результате сердечной недостаточности или вследствие неадекватной антигипертензивной терапии при циркадных колебаниях АД приводит к гипоперфузии в глубинных структурах головного мозга. Хроническая церебральная гипоперфузия характеризуется низким перфузионным давлением, замедлением церебрального кровотока, уменьшением содержания кислорода и глюкозы, сдвигом метаболизма глюкозы в сторону анаэробного гликолиза, лактоцидозом и гиперосмолярностью [14]. Появляющийся недостаток кислорода мозговая ткань пытается восполнить за счет усиления поглощения кислорода из крови. Развивается гипертрофия мышечной оболочки экстрацеребральных сосудов с развитием «гипертонических стенозов» и последующей облитерацией просвета. Перекалибровка артерий приводит к редукции мозгового кровотока в корковых отделах. Поражение мелких сосудов, включающее истончение и повреждение стенки артериол (вызванные фиброгиалинозом или липогиалинозом), амилоидную ангиопатию церебральных сосудов (повреждение сосудистой стенки депозитами β-амилодного пептида), запускает целый каскад биохимических реакций, в результате которых вначале появляются функциональные расстройства кровообращения, а затем наступает необратимое морфологическое поражение всех сосудов [15]. При хорошо развитых и сохранившихся путях коллатерального кровотока возможна удовлетворительная компенсация даже при значительном поражении церебральных сосудов. Напротив, индивидуальные особенности строения сосудистой системы, признаки диспластических процессов могут быть причиной декомпенсации, усугубляющей клиническую картину ФР. Поэтому связь периферических и центральных микроангиопатий очевидна и закономерна. Следовательно, СР можно рассматривать как одно из ранних проявлений нарушений системной гемодинамики[16, 17].
Клинические проявления
Значительная часть пациентов с ФР предъявляют жалобы на сенсорные нарушения (онемение, покалывание, боль). Объективные проявления СР имеют характерное трехфазное течение с появлением участков кожи пальцев с последовательным изменением окраски: от бледной до синей и цианотично-красной. Первые две фазы отражают состояние вазоспазма и гипоксии кожи, в третьей кожа приобретает ярко-красную окраскувследствие реактивной гиперемии. В дебюте болезни изменения цвета кожи локализуются только на дистальной фаланге одного или нескольких пальцев кистей. В дальнейшем область поражения охватывает все пальцы кистей и иногда стоп, при этом большие пальцы обычно остаются интактными. Иногда наблюдаются характерные изменения окраски кончика носа, губ и ушных раковин, а также кожи над коленными суставами. У отдельных больных приступ вазоспазма протекает с вовлечением сосудов языка, что клинически проявляется дизартрией. На верхних и нижних конечностях появляется мраморный рисунок – симптом, называемый сетчатым ливедо (livedo reticularis). Частота и продолжительность эпизодов вазоспазма могут варьироваться от 15 до 20 минут и завершаться восстановлением кровотока с исчезновением необычной окраски кожи: она становится интенсивно-розовой (реактивная гиперемия). Число эпизодов изменения окраски кожи у одних и тех же пациентов варьируется в разное время года: зимой чаще, чем летом [18].
Диагностика ФР
Диагностика ФР базируется на основании жалоб и клинических симптомов заболевания.
На первом этапе пациенту задают три основных вопроса:
- Имеется ли у Вас повышенная чувствительность пальцев к холоду?
- Изменяется ли цвет пальцев под воздействием холода?
- Становятся ли пальцы белыми и/или синеватыми ?
Если все ответы положительные, диагноз ФР считается возможным. Одна ко повышенная чувствительность пальцев кистей к холоду отмечается у абсолютно здоровых людей [19]. Белая окраска пальцев – высокоспецифичный и высокочувствительный признак ФР. В медицинской литературе британской группой по исследованию склеродермии предложено следующее определение достоверного и вероятного ФР [20]:
- Достоверный ФР – повторные эпизоды двухфазного изменения окраски кожи на холоде.
- Вероятный ФР – однофазное изменение окраски кожи, сопровождающееся онемением или парестезией под воздействием холода.
- Отрицательный ФР – изменения окраски кожи под воздействием холода отсутствуют.
Всем пациентам с впервые выявленным ФР необходимо проводить специальные исследования с целью дифференциальной диагностики болезни (ПСР) и синдрома (ВСР).
Для этого необходимо в первую очередь уточнить у больного следующее:
- наличие симптомов заболеваний соединительной ткани (артриты, миалгии, лихорадка, «сухой» синдром, кожная сыпь, кардиопульмональные нарушения);
- прием лекарственных препаратов, особенно химиотерапевтических средств;
- подвергается ли он вибрации или другим механическим воздействиям, травмирующим кисти;
- есть ли связь изменения окраски кожи с определенными позиционными изменениями.
В неврологической практике дифференциальную диагностику в первую очередь следует проводить с васкулитами, антифосфолипидным синдромом и окклюзивными заболеваниями периферических сосудов, при которых в отличие от ФР вазоспазм имеет устойчивый характер и при осмотре выявляется стойкое сетчатое ливедо. Заболевания периферических сосудов, сопровождающиеся снижением кровотока и ишемией конечностей, характеризуются жалобами пациентов на замерзание конечностей, их онемение и покалывание. Для ВСР в отличие от заболеваний периферических сосудов указанные симптомы наблюдаются только во время вазоспазма и полностью проходят после восстановления исходного кровотока. Во вторую очередь врач-невролог должен думать о карпальном туннельном синдроме, рефлекторной симпатической дистрофии, синдроме верхней апертуры. Все эти синдромы связаны с механическим повреждением нервно-сосудистого пучка верхних конечностей.
Не менее важно определение клинической формы ФР. БР (или ПСР) характеризуется спазмом пальцевых артерий и терморегуляторных сосудов кожи при воздействии холода без каких-либо признаков поражения сосудов. Симптомы умеренно выражены, у 12% больных симптомы болезни выражены значительно. Средний возраст дебюта – 14 лет, в 27% случаев развитие симтомов происходит в возрасте 40 лет и старше [21]. Для четверти больных ПСР носит наследственный характер (встречается у родственников первой линии). При вторичном СР наблюдается сочетание СР с симптомами основного заболевания [22, 23]. Клинические признаки ассоциированной патологии могут развиваться по истечении нескольких месяцев или лет после появления СР.
Диагностические критерии позволяют дифференцировать ПСР от ВСР (табл. 2):
Более точные сведения о характере ФС дают дополнительные инструментальные и лабораторные методы исследования.
В клинической практике наиболее информативна капилляроскопия ногтевого ложа, которая позволяет визуально оценивать локальную капиллярную сеть ногтевого ложа, выявилять структурные изменения капилляров и нарушения капиллярного кровотока. При первичном СР структурные изменения капилляров отсутствуют на фоне выраженного снижения скорости кровотока в капиллярах или внутрикапиллярного стаза, что рассматривается как функциональные нарушения [24]. Для вторичного СР характерны изменения размеров и формы капиллярных петель, редукция капиллярной сети. В последние годы стал широко использоваться метод лазерной допплеровской флоуметрической оценки кожного кровотока: при применении провокационных тестов регистрируется повышенный вазоспазм и снижение вазодилатационного потенциала. Термография также не утратила актуальности в диагностике ФР [25]. Различия температуры между подушечкой пальцев и тыльной поверхностью кисти более 1°С при температуре 30°С имеет положительную и негативную прогностическую ценность (70 и 82% соответственно) для выявления СР, вторичного по отношению к системной склеродермии (ССД). Плетизмография базируется на измерении давления крови в пальцевой артерии. Снижение давления на 70% и больше после локального охлаждения характерно для вторичного СР (чувствительность – 97%); у пациентов с системной склеродермией регистрируется падение давления до 0 при 30°С (специфичность – 100%). Кроме вышеописанных методов применяются цветное допплер-УЗ-сканирование, ангиография, ультразвуковое исследование щитовидной железы Особое место занимают лабораторные исследования. Всем пациентам с клиническими проявлениями ФР необходимо провести общий и биохимический анализы крови, анализ мочи, исследование АНФ, тесты на выявление специфических аутоантител и ревматоидного фактора, тесты, патогмоничные для АФС. При необходимости (подозрение на врожденную тромбофилию) проводят генетические исследования. После детального обследования рекомендуется консультация смежных специалистов: ревматолога, эндокринолога, гинеколога.
Терапия ФС
Терапия, как правило, начинается с беседы с больным. Пациенту рекомендуется избегать длительного пребывания на холоде. Ему нужно объяснить необходимость защиты рук, головы от холода (носить рукавицы, головной убор, теплое нижнее белье), отказаться от курения, потребления кофе и кофеинсодержащих напитков. По возможности обучить приемам, с помощью которых можно уменьшить длительность эпизодов вазоспазма (согревание кистей в теплой воде или подмышечной области, быстрые круговые движения кистей и др.). Соблюдения этих простых рекомендаций часто бывает достаточно для лечения больных первичным СР [1].
Дигитальные артерии и терморегуляторные сосуды кожи находятся преимущественно под симпатическим адренергическим контролем. Эмоциональный стресс может спровоцировать дигитальный вазоспазм, а состояние тревоги часто усиливает индуцированные холодом атаки Рейно. В таких случаях бывает полезным применение седативных средств. Важно избегать применения препаратов, которые могут вызывать вазоконстрикцию (симпатомиметики, клонидин, эрготамин, агонисты серотониновых рецепторов и др.). Курение может редуцировать пальцевой кровоток, вследствие чего больным СР следует отказаться от этой привычки.
В случаях частых и продолжительных эпизодов вазоспазма при первичном СР и больным вторичным СР необходима лекарственная терапия, которая в первую очередь направлена на снятие патологического вазоспазма и улучшение трофики поврежденных тканей.
С учетом современных представлений о патогенезе ФР следует проводить следующие мероприятия:
- нормализация тонуса сосудистого русла;
- устранение лейкоцитарной агрессии и воспаления;
- коррекция микроциркуляторных расстройств;
- увеличение емкости венозного русла.
Вследствие наличия массы патогенетических механизмов не существует единого и стандартизированного метода лечения данной категории больных. Профилактика изменений в малых, диффузно распространенных и недоступных церебральных сосудах не может быть такой же (хирургическое вмешательство, эндоваскулярные процедуры), как при патологии крупных сосудов. Лечение, вероятно, должно быть направленно на защиту микрососудистого церебрального русла от повреждения. Потенциальными мишенями ангиопротективной терапии являются ангиотензин II, оксид азота, свободные радикалы, а также коллаген IV типа, которые играют значительную роль в процессах поражения стенки мелких сосудов [26].
С целью профилактики поражения мелких сосудов проводится коррекция сосудистых факторов риска (в первую очередь артериальной гипертензии и атеротромбоза) [27–31]. Первой линией базовой терапии являются ангиопротекторы – лекарственные средства, основное действие которых направлено на восстановление тонуса сосудов и их проницаемости. Как правило, они обладают полимодальным механизмом действия.
Антигипертензивные препараты и статины являются лекарственными средствами, влияние которых на функциональное состояние эндотелия изучено наиболее полно. Препараты данных групп продемонстрировали свое положительное влияние на ЭД во многих работах, в т.ч. и в крупных многоцентровых исследованиях (RECIFI, TREND, QUASAR и др.). Способностью восстанавливать функцию эндотелия обладают, в частности, эналаприл, спираприл, периндоприл и фозиноприл [30], а выраженность их воздействия на эндотелий зависит, вероятно, от степени сродства к тканевому АПФ. При ассоциации с СР более эффективными считаются лекарственные средства, обладающие выраженным вазодилатирующим действием, например блокаторы рецепторов I типа ангиотензина II. Эффект от препарата у пациентов с СР заключается в уменьшении частоты приступов вазоспазма.

Статины помимо своего основного гиполипидемического действия обладают множеством плеотропных эффектов на сосудистый эндотелий: способствуют восстановлению барьерной функции эндотелия, обладают вазодилатирующим и антиишемическим действиями, благоприятно влияют на систему гемостаза, снижая показатели агрегации тромбоцитов, а также активизируя систему фибринолиза [31, 32]. Они обладают антипролиферативным действием на гладкомышечные элементы сосудистой стенки, противовоспалительным и иммунодепрессивным эффектами и способствуют стабилизации атеросклеротической бляшки. Среди вазодилататоров эффективными средствами терапии являются блокаторы кальциевых каналов, которые считаются средством первой линии при СР. Они обладают наибольшим вазодилатационным потенциалом. Препаратами выбора являются дигидропиридиновые производные — нифедипин, амлодипин, исрадипин и фелодипин. Обладающий кратковременным действием нифедипин в разовой дозе 10–20 мг при 3-кратном ежедневном приеме значительно уменьшает частоту и выраженность, а в некоторых случаях и продолжительность эпизодов вазоспазма [1]. Однократный прием 5–20 мг препарата достаточно эффективно предупреждает индуцированный холодом вазоспазм при приеме за 15–20 минут до воздействия холода. У некоторых больных могут наблюдаться побочные эффекты: рефракторная тахикардия, головная боль, гиперемия лица, отеки лодыжек и др., в связи с этим возможно назначение других блокаторов кальциевых каналов, относящихся к длительно действующим препаратам, однако их терапевтический эффект несколько ниже [17].
При наличии противопоказаний или непереносимости блокаторов кальциевых каналов для лечения СР применяются вазодилататоры других лекарственных групп. Использование симпатолитических препаратов обосновано тем, что адренергическая стимуляция играет важную роль в вазоконстрикции. Простагландины оказывают комплексное физиологическое воздействие, в частности речь идет о вазодилатации, антиоксидантном действии, подавлении агрегации тромбоцитов и др. Алпростадил при ежедневных внутривенных инфузиях 20–40 мкг препарата в 200 мл изотонического раствора NaCl в течение 15–20 дней достоверно уменьшает как частоту, так и интенсивность вазоспазма у больных первичным и вторичным СР [1].
Использование антиагрегантов также улучшает функции поврежденного эндотелия. Особую роль данный тип фармакологических средств приобретает в связи с высоким уровнем доказательной базы в терапии вторичного СР [33, 34]. Они улучшают реологические свойства крови, снижают вязкость. Главное правило их использования – пожизненное применение, однако длительное применение ацетилсалициловой кислоты может приводить к развитию тяжелых гастротоксических осложнений, кроме этого 20% населения планеты толерантны к действию аспирина. В связи с вышеизложенным все большее значение приобретают препараты, лишенные этих отрицательных свойств, обладающие выраженным эндотелиокорригирующим действием. В клинической практике с этой целью широко используется дипиридамол в дозе 75 мг/сут, который воздействует на эндотелий сосудов, повышая синтез простациклина (обладающего сосудорасширяющим и антиагрегантным действиями), оксида азота способствует усилению кровотока по артериям и имеющимся коллатералям, реализуя тем самым свои ангиопротективные свойства. Препарат инициирует кровоток в старых коллатералях и стимулирует образование новых, ингибирует фермент, участвующий в разрушении аденозина, в результате повышается концентрация аденозина в тромбоцитах и в эндотелии с развитием вазодилатирующего и антиагрегантного эффектов [34].
В последние годы идет поиск идеального препарата для лечения расстройств микроциркуляции, который должен воздействовать на как можно большее количество патогенетических звеньев, иметь минимальное число побочных эффектов и высокую биодоступность.
Одним из таких фармакологических средств является Актовегин – препарат, активирующий обмен веществ в тканях, улучшающий трофику и стимулирующий процессы регенерации. Особое значение в его механизме действия придают активирующему влиянию на энергетический метаболизм клеток различных органов [18]. Это связано прежде всего со способностью повышать захват и утилизацию глюкозы и кислорода, приводя к улучшению аэробной продукции энергии в клетке и оксигенации в микроциркуляторной системе. Одновременно улучшается анаэробный энергообмен в эндотелии сосудов, сопровождающийся высвобождением эндогенных веществ (простациклина и оксида азота) с мощными вазодилатирующими свойствами. В результате улучшается перфузия органов и снижается периферическое сопротивление. Этот механизм обеспечивает стабилизацию функционального метаболизма тканей в условиях временно индуцированного стресса и гипоксии при периферических артериальных расстройствах. Улучшение процессов утилизации тканями кислорода и глюкозы сопряжено с изменениями функционального состояния как путей притока крови к капиллярам (артериолы) и путей ее оттока (посткапиллярные венулы), так и с изменениями параметров гемодинамики на уровне капилляров [35].
К структурной особенности прекапиллярных артериол относится следующее: в их стенке эластические элементы полностью отсутствуют, количество гладкомышечных элементов минимально, а соседние мышечные клетки, спирально обвивающие эндотелиальную трубку, располагаются на значительном расстоянии друг от друга [36]. Вследствие этого на протяжении прекапиллярных артериол имеются участки, в которых сосудистая стенка состоит только из эндотелиальных клеток, снаружи от которых располагается базальная мембрана, что позволяет их сопоставлять с венозными сосудами. Таким образом, изменения функционального состояния микрососудистого русла как неотъемлемой части сердечно-сосудистой системы оказывает влияние на параметры центральной гемодинамики, в частности на часть ее венозной системы. Вероятно, существуют и корреляционные зависимости между функциональным состоянием тонус-формирующих звеньев модуляции микрокровотока и уровнем АД. Незначительное, но достоверное снижение диастолического (p<0,03) и среднего АД (p<0,04) связано со снижением тонуса прекапиллярных артериол. Учитывая тесную взаимосвязь метаболических и гемодинамических процессов на уровне микроциркуляторного русла, изменение функциональной активности всех трех тонус-формирующих механизмов модуляции кровотока, в исследованиях последних лет доказана роль Актовегина как корректора микроциркуляции [37, 38]. На фоне приема Актовегина получено однонаправленное изменение функциональной активности всех трех тонус-формирующих механизмов модуляции кровотока, достоверное увеличение амплитуды (снижение тонуса) миогенного ритма в среднем по группе на 54% (p<0,03) и амплитуды нейрогенного ритма на 50% (p<0,003), а следовательно, действие препарата имеет выраженную вазомоторную составляющую. Показателем метаболической активности микрососудистого эндотелия является уменьшение размера перикапиллярной зоны, что отражает степень гидратации интерстициального пространства. Существенное уменьшение размеров этой зоны на фоне действия препарата подтвердило, что в фильтрационно-реабсорбционном механизме обмена преобладают процессы реабсорбции. Фильтрационно-реабсорбционный механизм обмена напрямую связан с гемодинамическими параметрами кровотока, т.к. основан на разности гидростатического и коллоидно-осмотического давления крови. Процессы фильтрации сопряжены непосредственно с амплитудой пульсовых колебаний, которая отражает гемодинамические параметры притекающей к микроциркуляторному руслу артериальной крови, а процессы реабсорбции – с амплитудой венулярного ритма. Полученные в ходе исследования результаты продемонстрировали тесную взаимосвязь процессов метаболизма и микрогемодинамики и, как конечный результат, возможность использования Актовегина как средства базовой терапии у пациентов с ФР. Рекомендованная схема применения: 200 мг 2–3 раза в сутки внутрь длительно – от 3 до 6 месяцев. Курсы можно проводить два раза в год – лучше весной и осенью.В условиях стационаров возможно применение препарата парентерально. Клинический эффект обычно достигается постепенно (в течение 3–4 недель), в связи с чем средняя длительность применения составляет от 3 до 6 месяцев. Рекомендуются повторные курсы лечения.
При неэффективности консервативной терапии с целью уменьшения проявлений ФР возможно хирургическое лечение — локальная дигитальная симпатэктомия. Однако продолжительность и ожидаемая выраженность лечебного эффекта симпатэктомии до сих пор не уточнены, в связи с чем их трудно прогнозировать.
Заключение
В большинстве случаев ФР представляет собой заболевание, характеризующееся благоприятным прогнозом и стабильным течением. В дебюте заболевания, особенно при наличии факторов риска вторичного характера СР, все больные подлежат диспансеризации и врачебному осмотру один раз в год. Пациенты должны быть предупреждены о необходимости дополнительного визита к врачу при появлении новых симптомов, указывающих на возможное развитие заболеваний, с которыми наиболее часто ассоциируется ФР, прежде всего системных заболеваний соединительной ткани.
Несмотря на широкую распространенность ФР в неврологической практике, вопрос медикаментозной терапии до конца не решен, что, вероятнее всего, связано с развитием толерантности и побочных эффектов лекарственных средств при длительном применении. Приведенные выше данные при всей их фрагментарности свидетельствуют о сложности рассматриваемой проблемы, решение которой с учетом ее несомненной социальной значимости требует проведения дальнейших разносторонних исследований.



