По данным Международной ассоциации исследования рака (International Agency for Research on Cancer, IARS), рак желудка занимает 4-е место в структуре онкологической заболеваемости и 2-е – в структуре онкологической смертности в мире. В 2008 г. данные показатели составили 988 тыс. новых случаев заболевания и 736 тыс. случаев летальных исходов [1]. Заболеваемость раком желудка у мужчин в два раза выше, чем у женщин. Самый высокий уровень заболеваемости зарегистрирован в странах Азиатско-Тихоокеанского региона (Япония, Китай, Корея), Центральной и Южной Америки, Западной Европы, на Среднем Востоке. Россия относится к странам с высоким уровнем показателей заболеваемости и смертности от этого заболевания. В 2011 г. зарегистрировано 36 528 новых случаев раком желудка, из них 67,7% приходилось на III–IV стадии. Что связано с тем, что диагностика рака желудка на ранних стадиях затруднительна в связи с длительным бессимптомным течением болезни [2]. В настоящее время основным методом лечения рака желудка остается хирургическое вмешательство. Но, к сожалению, у большинства пациентов на момент выявления заболевания имеются отдаленные метастазы, что приводит к необходимости на первом этапе проводить системное лекарственное лечение.
В лечении рака желудка свою эффективность показали препараты платины, фторпиримидины, ингибиторы топоизомеразы, таксаны и антрациклины. Несмотря на то что существуют различные комбинации цитостатиков, их эффективность и показатели общей выживаемости не превышают одного года. Активный поиск новых таргетных препаратов направлен на изучение молекулярно-генетических характеристик опухоли, таких как семейство рецепторов к эпидермальному фактору роста, которое включает четыре представителя: EGFR, HER2, HER3 и HER4. Сигнал в клетки с этих рецепторов поступает по двум основным сигнальным путям – RAS-RAF-MEK-ERK и PI3K-AKT-mTOR [3]. За последние 5 лет мы стали свидетелями появления двух новых препаратов: трастузумаба и рамуцирумаба, которые показали свою высокую эффективность в увеличении общей выживаемости как препараты 1-й и 2-й линий терапии диссеминированного рака желудка. Оценка гиперэкспрессии HER2 производится методом иммуногистохимии (ИГХ) и флуоресцентной гибридизации in situ (FISH). Из-за различий в методе частота HER2-положительного рака желудка значительно варьируется от 6,0 до 29,5% [4].
В 2010 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) зарегистрировало трастузумаб в сочетании с цисплатином и фторпиримидинами в качестве стандартной терапии больных метастатическим раком желудка и желудочно-пищеводного перехода при гиперэкспрессии HER2 в опухоли. Основанием послужили результаты исследования ToGA, в котором медиана продолжительности жизни пациентов с гиперэкспрессией HER2 (IHC 3+ или 2+ с подтверждением амплификации по FISH) при добавлении к химиотерапии трастузумаба составила 16,1 мес по сравнению с 11,8 мес при обычной химиотерапии [5]. При изучении 3803 образцов опухоли в рамках данного исследования в 810 случаях была выявлена гиперэкспрессия HER2. Были рандомизированы 594 пациента, из них 584 прошли полный курс лечения и попали в анализ. Пациенты были разделены в две однородные группы, в первую группу были включены 294 пациента, которые получили лечение, включившее трастузумаб и химиотерапию с добавлением цисплатина и фторпиримидина, во вторую – 290 пациентов, получавших только химиотерапию теми же препаратами. Оценка общей выживаемости стала главной целью данного исследования. К другим параметрам оценки эффективности лечения относились время до прогрессирования, частота объективного ответа, выживаемость без прогрессирования болезни, продолжительность ответа на проводимое лечение и переносимость терапии. Показатели общей выживаемости в первой группе составили 13,5 мес против 11,1 мес во второй группе. В анализе двух групп было отмечено, что показатели общей выживаемости были выше среди пациентов с показателями гиперэкспрессии HER2 3+, 2+/FISH+, чем в группе 0, 1+/FISH+, и составили 16,1 против 11,8 мес. Также было отмечено, что частота объективного ответа и медиана выживаемости без прогрессирования были достоверно выше в первой группе и составили 47 против 35% и 6,7 против 5,5 мес соответственно. Токсичность в обеих группах была практически одинаковой. Нежелательные явления 3-й и 4-й степеней отмечены в 68% и включали тошноту, рвоту, нейтропению и анемию. Бессимптомное снижение фракции выброса левого желудочка отмечено у 4,6% пациентов первой группы и 1,1% – второй [6].
В настоящее время проводятся клинические исследования эффективности и токсичности высоких доз трастузумаба (HELOISE), комбинации пертузумаба и трастузумаба в первой линии HER-позитивного рака желудка (JACOB), сравнение нового агента трастузумаба-эмтанзина против таксанов (GATSBY), трастузумаба-эмтанзина против трастузумаба-эмтанзина в комбинации с капецитабином в любой линии химиотерапии (TRAXHER) [7–11].
Представляемое ниже клиническое наблюдение демонстрирует еще более перспективные результаты комбинированного лечения диссеминированного рака желудка с использованием трастузумаба.
Больная С. 35 лет в январе 2007 г. отметила появление болей в эпигастрии, усиливающихся при приеме пищи, снижение массы тела более 10 кг, тошноту, рвоту, периодические кровянистые выделения из половых путей.
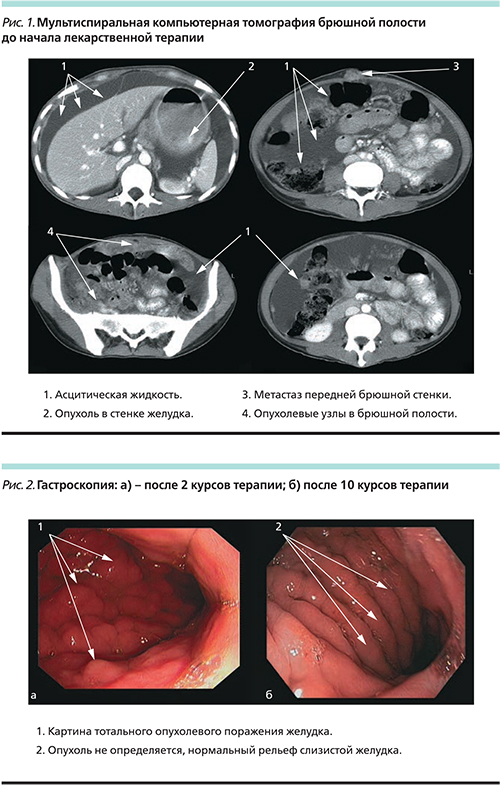
В октябре 2007 г. обратилась в РОНЦ им. Н.Н. Блохина в связи с нарастающими болями в животе. При обследовании по данным компьютерной томографии брюшной полости и малого таза, ультразвукового исследования регионарных лимфоузлов, брюшной полости, забрюшинного пространства, малого таза, эзофагогастродуоденоскопии и рентгенологического исследования желудка выявлен тотальный стенозирующий инфильтративно-язвенный рак желудка с подслизистой инфильтрацией розетки кардии и пилорического канала, компенсированный стеноз, метастазы в яичниках, шейке матки, в околопупочную область передней брюшной стенки, канцероматоз брюшины, асцит. 13.11.07 в РОНЦ им. Н.Н. Блохина экстренно было выполнено оперативное вмешательство по поводу маточного кровотечения в объеме паллиативной экстирпации матки с придатками, иссечение имплантационного метастаза передней брюшной стенки. Интраоперационно: в брюшной полости около 1000 мл асцитической жидкости, стенки желудка инфильтрированы опухолью с переходом на луковицу двенадцатиперстной кишки, селезеночный угол поперечно-ободочной кишки; большой сальник опухолево изменен; по париетальной и висцеральной брюшине брюшной полости множественные метастазы размером до 2–2,5 см; в малом тазу – париетальная брюшина инфильтрирована с опухолевыми диссеминатами до 2 см, матка несколько увеличена, плотная; правый яичник 4×5 см бугристый, плотный, метастатически изменен; левый яичник подобной структуры 5×5 см. Гистология операционного материала: фиброзно-жировая ткань с разрастанием низкодифференцированной аденокарциномы с единичными перстневидноклеточными элементами, в кусочках из тела и шейки матки, а также в яичниках и перитубарно разрастание аналогичной опухоли с распространением по лимфатическим щелям. Опухоль соответствует метастазам рака желудка во всех указанных органах (шейка матки и тело матки, яичники, имплантационный метастаз в передней брюшной стенке). ЭГДС от 19.12.07: пищевод визуально не изменен на всем протяжении, розетка кардии инфильтрирована по правой полуокружности, стенка ее плотная, не перестальтирует, слизистая в этой области бледно-розовая, дистальнее инфильтрация распространяется по малой кривизне и задней стенке, в средней трети циркулярно; в средней трети стенка плотная, мелкобугристая, перистальтика отсутствует; складки большой кривизны перестроены, инфильтрированы; в нижней трети тела желудка по большой кривизне, переходя на заднюю и частично переднюю стенки отмечается язвенный дефект с дном, покрытым фибрином и некротическим налетом, тромбированным сосудом в дне размером до 2х3 см; дистальнее антральный отдел циркулярно стенозирован за счет опухолевой инфильтрации; пилорический канал также циркулярно инфильтрирован, стенозирован, в связи с чем провести аппарат в луковицу двенадцатиперстной кишки не представляется возможным. Гистология № 29530/07: низкодифференцированная аденокарцинома. Результаты компьютерной томографии от 19.12.07: утолщение стенок желудка до 2 см, множественные метастазы по брюшине, наибольший размер – 14,1×2,0 см. В жировой клетчатке области пупка опухолевый узел размером 3,0×1,6 см. Асцит (рис. 1).
Таким образом, перед началом лекарственной терапии пациентке установлен диагноз: тотальный рак желудка с переходом на луковицу двенадцатиперстной кишки T4NхM1. Врастание опухоли в поперечно-ободочную кишку и большой сальник. Канцероматоз париетальной и висцеральной брюшины. Асцит. Метастазы Крукенберга и сестер Джозеф. Субкомпенсированный стеноз выходного отдела желудка. Состояние после паллиативной экстирпации матки с придатками от 11.2007. Анемия смешанного генеза.
С 24.12.07 начато лечение в рамках исследования TOGA в режиме цисплатин 80 мг/м2 в 1-й день, капецитабин 2000 мг/м2 с 1-го по 14-й день, трастузумаб 8 мг/кг нагрузочная доза, дале 6 мг/кг 1-й день каждые 21 день. Токсичность оценивалась по CTCAE v3.0, оценка эффекта производилась по критериям RECIST 1.0.
Состояние пациентки до начала лечения ECOG 2. Жалобы на выраженную слабость, боли в эпигастрии, усиливающиеся после приема пищи, быстрое чувство насыщения, отрыжку, метеоризм, отсутствие аппетита, периодически возникающую рвоту, запоры и на периодическое затруднение прохождения твердой пищи (дисфагия 1–2-й степеней). С целью коррекции анемии в процессе проведения первого курса неоднократно проводились гемотрансфузии. Ко второму курсу отмечено улучшение состояния в виде регресса слабости, отсутствия боли в эпигастральной области, отрыжки, улучшения аппетита, прекращения рвоты и запоров, увеличения массы тела на 4 килограмма.
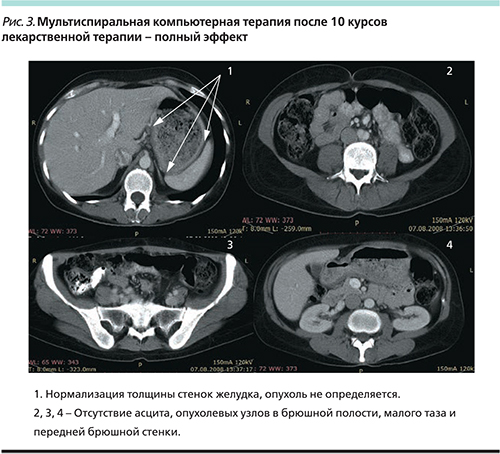
После двух курсов, по данным компьютерной томографии от 01.02.08: уменьшение метастазов по брюшине до 0,7 см, опухолевый узел в жировой клетчатке области пупка перестал определяться. Уменьшение инфильтрации стенок желудка. Исчезновение асцита. По данным ЭГДС от 05.02.08, уменьшение размеров опухоли и опухолевой инфильтрации по большой кривизне желудка (рис. 2а).
Во время проведения первых трех курсов химиотерапии нежелательных явлений отмечено не было. Клинически значимой токсичностью после проведения четвертого курса явилось развитие почечной токсичности 2-й степени (снижение клиренса креатинина до 47 мл/мин), сохраняющейся на протяжении всего последующего лечения и потребовавшей редукции дозы цисплатина более чем на 25%. По данным контрольного обследования, после четырех курсов сохранялся частичный регресс. Глобальная сократительная функция миокарда сохранена. ЭГДС от 24.03.08: опухолевая инфильтрация не определяется. При ЭГДС выполнена биопсия. По данным цитологического исследования № 5234/08 преобладают элементы грануляции и воспаления. Шестой и седьмой куры химиотерапии были проведены с редукцией дозы капецитабина на 25% в связи с развитием диареи 2-й степени более семи дней, ладонно-подошвенного синдрома 2-й степени. При обследовании после шести курсов отмечена явная тенденция к полному эффекту – ЭГДС от 13.05.08: плоский язвенный дефект, с рубцовой конвергенцией складок.
С 06.06.08 начата поддерживающая терапия трастузумабом.
После десятого курса, по данным компьютерной томографии от 07.08.08: отсутствие утолщения стенок желудка, метастазы по брюшине, метастаз в жировую клетчатку в области пупка и асцит не определялись (рис. 3). ЭГДС от 06.08.08: опухоль и опухолевая инфильтрация не определяются. Биопсия из гипертрофированных складок и с язвенного рубца. По данным гистологического исследования материала, взятого при ЭГДС № 2446/08 мелкие фрагменты гиперплазированного покровно-ямочного эпителия с отеком, фиброзом и активным хроническим воспалением в собственной пластинке (рис. 2б).
Всего проведено пятнадцать курсов монотерапии трастузумабом. С учетом выраженной положительной динамики, длительностью эффекта более года решено провести хируругическое лечение проявлений болезни. 20.05.09 было выполнено оперативное вмешательство в объеме гастрэктомии, спленэктомии с лимфодиссекцией D2. Интраоперационно: при ревизии брюшной полости асцита нет, в желудке, печени, поджелудочной железе, в малом тазу, по брюшине опухолевых изменений не выявлено. Париетальная и висцеральная брюшина гладкая, блестящая. Гистология № 17901/09: в пульпе селезенки метастатического роста не обнаружено. В сальнике выраженное полнокровие сосудов, гиперплазия лимфоидных фолликулов. В 20 лимфоузлах явления гиперплазии. В стенках желудка из разных отделов, включая кардио-эзофагеальную область и двенадцатиперстную кишку: в слизистой оболочке явления атрофии, в собственной пластинке диффузный выраженный инфильтрат из мелких лимфоидных клеток, плазматических клеток и эозинофильных лейкоцитов, элементов опухолевого роста нет. Явления лечебного патоморфоза 4-й степени.
Пациентке было предложено и получено разрешение компании продолжить монотерапию трастузумабом в рамках протокола. Пациентка отказалась (!) от дальнейшего лечения трастузумабом, но дала свое согласие наблюдаться в рамках протокола. Далее динамическое наблюдение.
При контрольном обследовании в ноябре 2010 г. выявлено прогрессирование заболевания за счет появления множественных метастазов в паховые лимфоузлы с обеих сторон, метастаз в послеоперационный рубец передней брюшной стенки. Цитология № 19388-89/10 (пункция паховых лимфоузлов и послеоперационного рубца) – рак. Пациентке рекомендована терапия трастузумабом, оксалиплатином и капецитабином, от предложенного лечения пациентка отказалась. Таким образом, пациентка на протяжении 18 месяцев до прогрессирования заболевания и далее до 26 месяцев лечение не получала.
В июле 2011 г. отмечено дальнейшее увеличение метастазов в паховых лифоузлах и рост рецидива в области послеоперационного рубца. 20.07.11 выполнена операция в объеме двусторонней паховой лимфаденэктомии, иссечение рецидива в области послеоперационного рубца. С августа 2011 по ноябрь 2012 г. пациентка постоянно получала трастузумаб и несколько линий химиотерапии с включением препаратов платины, таксанов, фторпиримидинов. В дальнейшем больная полностью отказалась от лекарственной терапии. Заболевание постепенно прогрессировало, и 20.12.13 наступила смерть.
Таким образом, у пациентки с исходно неблагоприятными прогностическими признаками (молодой возраст, низкодифференцированная форма злокачественного образования с перстневидноклеточными элементами, наличие отдаленных метастазов, диссеминация по брюшной полости, асцит, кровотечение из распадающейся опухоли, стеноз выходного отдела желудка) общая продолжительность жизни составила 72 месяца! Достигнут полный эффект как первичной опухоли, так и ее метастазов, продолжительность которого составила 27 месяцев, из которых последние 18 месяцев (до рецидива) пациентка лечение не получала, а продолжительность времени до прогрессирования составила 35 месяцев.
Данный случай ярко демонстрирует целесообразность комбинированного подхода к лечению больных диссеминированным раком желудка. Рациональное использование таргетных препаратов и цитостатиков позволило неоперабельную и нерезектабельную пациентку перевести в хирургическую категорию в интервале полного эффекта, что несомненно повлияло на общую продолжительность жизни. Это в очередной раз нас убеждает, что лечение подобных пациентов должно проходить при тесном взаимодействии химиотерапевтов, хирургов, морфологов и радиологов. Мультидисциплинарный подход – залог успешного лечения данной категории больных.



