Колоректальный рак (КРР) в настоящее время занимает 3-е место в структуре заболеваемости злокачественными опухолями в мире, причем заболеваемость данной онкопатологией имеет тенденцию к росту [1, 2]. В Ростовской области за 10 лет (с 2001 по 2010 г.) заболеваемость КРР увеличилась на 20,2% – с 18,3 до 22,0 случаев на 100 тыс. населения [3, 4]. Спектр противоопухолевых агентов, активных при данной нозологии, весьма ограничен. Появление таргетных препаратов, а именно моноклональных антител к EGFR (Epidermal Growth Factor Receptor), значительно расширило терапевтические возможности в отношении метастатического колоректального рака (мКРР) при наличии дикого типа гена RAS [4–7]. Из анти-EGFR-антител в настоящее время доступны два препарата: цетуксимаб и панитумумаб. Ген RAS служит одним из звеньев сигнального пути EGFR–RAS–BRAF–MEK–MAPK, регулирующего клеточную пролиферацию, ангиогенез, апоптоз и др.
В случае мутации гена RAS результатом возникающей активации данного сигнального пути является нейтрализация эффекта блокирующих EGFR таргетных препаратов [8, 9]. По данным мета-анализа, обобщившего данные о влиянии мутаций генов RAS и BRAF на эффективность терапии цетуксимабом, в который были включены данные 22 клинических исследований (2188 пациентов), клиническая эффективность применения моноклональных антител к EGFR у пациентов с диким типом гена RAS значительно возрастает в сочетании с химиотерапией как в 1-й, так во 2-й и последующих линиях терапии мКРР, в то время как при наличии мутации не получено никакого клинического преимущества [6, 7, 10, 11]. Отсутствие мутации RAS является основным на настоящий момент предиктором эффективности анти- EGFR-терапии.
При этом показано, что анти-EGFR-препараты целесообразно применять именно в 1-й линии терапии мКРР с диким типом RAS [12], а не после блокаторов ангиогенеза, поскольку в этом случае значительно снижается их эффективность [13]. В ряде исследований констатированы равная эффективность и идентичный специфический спектр кожной токсичности панитумумаба и цетуксимаба, что позволяет данные об их применении объединить в один анализ [4, 14, 15]. Проявления кожной токсичности блокаторов EGFR коррелируют с эффективностью терапии [9, 11, 16, 17], а применение превентивных и лечебных мер позволяет контролировать данные осложнения и проводить лечение в запланированном режиме [18].

С появлением эффективных противоопухолевых препаратов меняются тактические подходы к лечению мКРР. В частности, в настоящее время обсуждаются вопросы длительности анти-EGFR-терапии и целесообразности ее продолжения при прогрессировании процесса. Представлены данные рандомизированного исследования 2-й фазы CAPRI–GOIM об эффективности цетуксимаба в комбинации с FOLFOX в качестве 2-й линии терапии пациентов, которые ранее получали цетуксимаб в 1-й линии терапии.
В группе пациентов с отсутствием мутаций в генах RAS, BRAF и PIK3CA комбинация цетуксимаба и химиотерапии приводила к достоверному повышению выживаемости без прогрессирования (ВБП) [19].
Нами проанализированы данные о 87 пациентах, получавших лечение моноклональными антителами к EGFR в 1–4-й линиях по поводу мКРР в 2010–2015 гг. Все пациенты имели патоморфологически подтвержденный первично-метастатический или генерализованный после радикального лечения КРР с отсутствием в опухоли мутации гена RAS. Также в числе критериев отбора для анти-EGFR-терапии были возраст пациентов 18 лет и старше, отсутствие в анамнезе терапии моноклональными антителами, наличие измеримых очагов опухоли в соответствии с критериями RECIST 1.0 при использовании спиральной компьютерной томографии или магнитно-резонансной томографии, функциональный статус по шкале ECOG≤2, адекватная функция костного мозга, адекватные функции печени и почек, отсутствие метастазов в головной мозг. Не включались в группу лечения блокаторами EGFR пациенты с наличием любых медицинских состояний, препятствующих проведению противоопухолевой лекарственной терапии. Панитумумаб вводился 40 пациентам в дозировке 6 мг/кг в/в капельно 1 раз в 2 недели, цетуксимаб – 47 пациентам 1 раз в неделю в начальной дозе 400 мг/м2 (первая инфузия), затем еженедельно 250 мг/м2. Препараты применялись в сочетании со стандартными режимами химиотерапии. В 1-й линии анти-EGFR-терапия сочеталась со стандартными режимами химиотерапии FOLFOX-6 и FOLFIRI, при этом комбинация с иринотеканом использовалась преимущественно теми пациентами, которые имели генерализацию процесса после комплексного лечения, включившего адъювантную химиотерапию одним из оксалиплатин-содержащих режимов, в сроки до 6 месяцев.
Во 2-й линии терапии были использованы комбинации цитостатиков FOLFIRI, XELOX, XELIRI, в 3-й – капецитабин, иринотекан, комбинация фторпиримидинов с митомицином, в ряде случаев – с бевацизумабом, в 4-й линии – те же варианты терапии и моноклональные EGFR-антитела в монорежиме. Контрольное обследование для оценки эффективности лечения, согласно RECIST 1.0, проводилось после каждых 2–3 циклов противоопухолевого лечения. Токсичность лечения оценивалась согласно критериям CTCAE 3.0.
Статистическая обработка данных осуществлялась с помощью пакета программ STATISTICA 6.0. При изучении общей выживаемости (ОВ) и ВБП использовали метод Kaplan–Meier. Статистические различия между актуриальными кривыми выживаемости оценивали с помощью логарифмического рангового критерия. В качестве переменных рассматривали линию лекарственной терапии по поводу мКРР, в которой были использованы блокаторы EGFR, продолжение анти-EGFR-терапии со сменой линии химиотерапии при прогрессировании процесса.
В анализируемую группу вошли 87 пациентов в возрасте от 34 до 78 лет, средний возраст – 54,2±2,4 года, из них 45 (51,7%) мужчин, 42 (48,3%) женщины. Гистологически преобладала аденокарцинома G2 у 75 (86,2%) пациентов, аденокарцинома G3 у 12 (13,8%) больных. Распределение больных по локализации опухоли было следующим: слепая кишка – 6 (69%), ободочная кишка – 21 (24,1%), сигмовидная кишка – 20 (22,9%), ректосигмоидный отдел – 10 (11,5 %), прямая кишка – 30 (33,5%). Исходно мКРР (T2-4N0-1M1) имел место у 56 (64,4%) пациентов, у 31 (35,6%) больного зарегистрирована генерализация опухолевого процесса после радикального хирургического или комплексного лечения (в зависимости от стадии заболевания). Время генерализации после радикальной операции от 3 месяцев до 10 лет, в среднем – 24,5±3,5 месяца. По локализации метастазов пациенты распределились следующим образом: изолированные метастазы в печень – 21 (24,1%), изолированные метастазы в легкие – 16 (18,4%), изолированное поражение отдаленных лимфоузлов – 2 (2,3%), сочетание метастазов в печень с метастазами в яичники – 4 (4,6%), надпочечник – 2 (2,3%), кости – 10 (11,5%), отдаленные лимфоузлы – 2 (2,3%), поражение печени и легких – 30 (33,5%), в т.ч. с метастазами в кости – 10 (11,5%), надпочечники – 2,3% (2), отдаленные лимфоузлы – 5,7% (5).
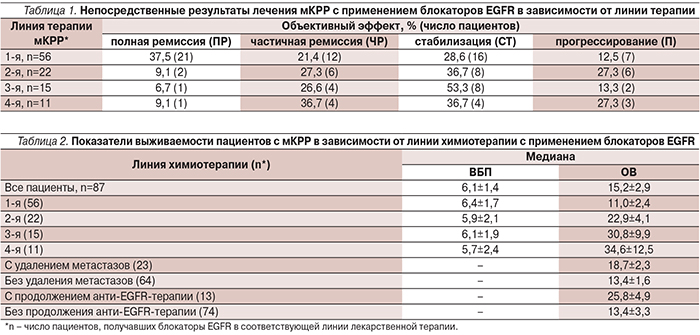
Таргетные препараты применялись в большинстве случаев в сочетании с химиотерапией. В 1-й линии терапии по поводу метастатического процесса блокаторы EGFR были впервые назначены 56 (64,4%) пациентам, во 2-й – 13 (14,9%), в 3-й – 12 (13,8%) и в 4-й линии – 6 (6,9%). Присоединение к лекарственной терапии мКРР блокаторов EGFR со 2-й и последующими линиями было обусловлено сроками получения анализов на мутацию гена KRAS и наличием препаратов в клинике. Ряд пациентов получали данные препараты на протяжении 2–3-й линий терапии (со сменой цитостатиков). С учетом этого обстоятельства в 1-й линии терапии по поводу метастатического процесса блокаторы EGFR были назначены всего 56 пациентам, во 2-й – 22, в 3-й – 15, в 4-й линии – 11.
Хирургические вмешательства по поводу резектабельных отдаленных метастазов были выполнены 23 (26,4%) пациентам. Непосредственный противоопухолевый эффект лекарственной терапии мКРР с применением блокаторов EGFR в зависимости от линии терапии представлен в табл. 1.
При оценке эффекта лечения пациенты с удаленными после лекарственного лечения резектабельными метастазами и отсутствием данных за другие метастатические поражения были отнесены к группе полного ответа. В результате проведения 1-й линии терапии с блокаторами EGFR объективный противоопухолевый эффект (ПР+ЧР) был достигнут 33 (58,9%) пациентами, 49 (87,5%) достигли контроля над опухолью (ПР+ЧР+СТ). Для 2-й линии терапии данные показатели были достигнуты 8 (36,7%) и 16 (72,7%) больными, для 3-й – 5 (33,3%) и 13 (86,6%), для 4-й – 5 (45,5%) и 9 (81,1%) пациентами соответственно.
Данные о выживаемости по группе пациентов в целом и в зависимости от группы стратификации приведены в табл.2 и рис. 1–2.
Для всей группы пациентов независимо от линии терапии, в которой применялись блокаторы EGFR, медиана ВБП составила 6,1±1,4 месяца, медиана ОВ – 15,2±2,9. Данные безрецидивной выживаемости (табл. 1, рис. 1, 2) достоверно не отличались как в подгруппах в зависимости от линии терапии с применением блокаторов EGFR, так и от результата по группе в целом. ОВ пациентов по подгруппам увеличивалась в зависимости линии терапии. Данные отличия клинически не значимы и связаны с тем, что 3-ю и 4-ю линии терапии по поводу мКРР смогли получить наиболее сохранные и чувствительные к лекарственному лечению пациенты с более благоприятным прогнозом заболевания.
Мы выделили группу из 13 пациентов (14,9%), которым после прогрессирования процесса на фоне химиотерапии и анти-EGFR-терапии была изменена линия химиотерапии, но продолжена терапия блокатором EGFR, и сравнили показатели ОВ с остальными пациентами, которым лечение блокатором EGFR после прогрессирования было прекращено. Выявлено достоверное увеличение медианы ОВ почти в 2 раза при продолженной терапии блокаторами EGFR: 13,4±3,3 и 25,8±4,9 месяца соответственно; р=0,04447 (табл. 2, рис. 3).

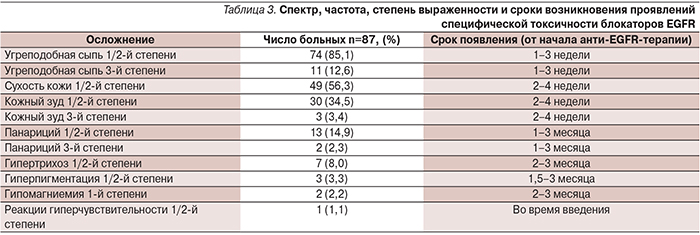
Проявления гематологической и негематологической токсичности были стандартными для использованных химиотерапевтических режимов. Среди всего комплекса нежелательных побочных эффектов лекарственной терапии мы выделили те, которые были непосредственно связаны с применением блокаторов EGFR. Спектр и частота проявлений специфической токсичности блокаторов EGFR, а также время их возникновения представлены в табл. 3.
У подавляющего большинства пациентов специфические для блокаторов EGFR осложнения поддавались медикаментозной коррекции, проводимой согласно рекомендациям RUSSCO, и не являлись причиной для отмены соответствующей терапии. У 3 пациентов в 1-й линии терапии мКРР лечение блокаторами EGFR было прекращено в связи с проявлениями кожной токсичности, у 1 из них – возобновлено в 4-й линии.
Таким образом, применение блокаторов EGFR для лекарственного лечения мКРР с диким типом RAS как на ранних, так и на более поздних этапах обеспечивает удовлетворительные показатели ОВ и ВБП как в первой, так и в последующих линиях терапии мКРР. Наиболее значимым среди результатов проведенного анализа является выявленное достоверное увеличение показателей ОВ у тех пациентов, которым была продолжена терапия блокаторами EGFR со сменой линии химиотерапии при прогрессировании процесса. Подобный подход существенно расширяет терапевтические возможности при мКРР без дополнительных лекарственных агентов и увеличения токсичности проводимого лечения.



