Введение
Остеоартроз (ОА) – заболевание, которое клинически проявляется болью в суставах и неуклонным прогрессированием функциональных нарушений. ОА является основной причиной инвалидизации среди взрослого населения. В возрасте 60 лет и старше распространенность системного ОА коленных суставов составляет около 10% у мужчин и 13% у женщин. Общепризнанным считается факт влияния сопутствующих заболеваний на развитие и прогрессирование ОА с последующей инвалидизацией [1].
 У лиц старших возрастных групп, как правило, одновременно прогрессируют и требуют лечения два и более хронических заболеваний [2–4]. Наиболее часто у больного ОА развиваются ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет. В настоящее время модель лечения хронического заболевания предполагает персонифицированный подход, когда выбор лекарственного средства учитывает коморбидность и не ухудшает течение любого из сопутствующих заболеваний. Безопасность лечения принципиальна, поскольку множественная лекарственная терапия увеличивает риск как побочных эффектов, так и лекарственного взаимодействия [2]. Международные рекомендации по лечению ОА ориентированы на безопасность терапии [5].
У лиц старших возрастных групп, как правило, одновременно прогрессируют и требуют лечения два и более хронических заболеваний [2–4]. Наиболее часто у больного ОА развиваются ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет. В настоящее время модель лечения хронического заболевания предполагает персонифицированный подход, когда выбор лекарственного средства учитывает коморбидность и не ухудшает течение любого из сопутствующих заболеваний. Безопасность лечения принципиальна, поскольку множественная лекарственная терапия увеличивает риск как побочных эффектов, так и лекарственного взаимодействия [2]. Международные рекомендации по лечению ОА ориентированы на безопасность терапии [5].
Эффективность хондроитина сульфата при лечении ОА доказана как в экспериментальных, так и в клинических исследованиях. За последние десятилетия проведено более 20 контролируемых исследований эффективности хондроитина сульфата (ХС) при ОА, в которых было продемонстрировано, что симптоматический эффект лечения этим препаратом аналогичен эффекту нестероидных противовоспалительных средств и других анальгетиков; при этом их безопасность не отличалась от плацебо.
По результатам нескольких многоцентровых двойных слепых плацебо-контролируемых исследований отмечено уменьшение болевого синдрома на фоне приема ХС, что позволило снизить потребность в нестероидных противовоспалительных препара-тах [6].
Уровень доказательности лечебного действия ХС наиболее высок для препаратов с хондропротективной активностью (1А), что нашло свое отображение в рекомендациях Международного общества по исследованию остеоартроза (OARSI)-2008, -2010 [7, 8]. Структурно-модифицирующее (хондропротективное) действие препарата связывают с повышением вязкости синовиальной жидкости, повышением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща металлопротеиназ – 3, 9, 13, 14, эластазы, катепсина-бета, ингибиции медиаторов воспаления – интерлейкина-1, циклооксигеназы-2, простагландина-Е2 (ПГЕ2), NF-kB, снижении апоптоза, концентрации оксида азота и свободных радикалов [9]. В терапии первичного ОА крупных суставов актуальна проблема подбора безопасного и эффективного симптом-модифицирующего препарата для пациентов старшей возрастной группы с коморбидными заболеваниями. Наиболее оптимальным по безопасности, эффективности и переносимости представляется применение парентеральной формы ХС.
Целью проведенного исследования стала оценка эффективности, безопасности и переносимости парентеральной формы ХС (Хондрогард) в терапии первичного гонартроза и коксартроза у пациентов старше 50 лет с коморбидными заболеваниями.
Материал и методы
Для оценки эффективности и переносимости парентеральной формы ХС было проведено открытое рандомизированное клиническое исследование, в которое были включены 125 пациентов с первичным ОС коленных и тазобедренных суставов.
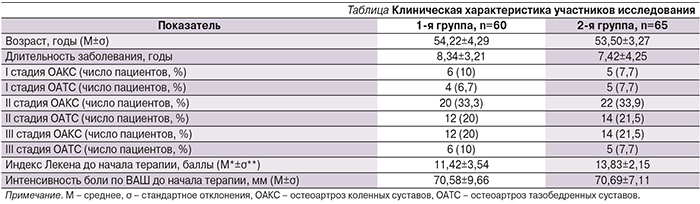
Пациенты были рандомизированы на 2 группы случайным методом. Пациенты 1-й группы (46 женщин и 14 мужчин) в возрасте 54,22±4,29 года получали Хондрогард внутримышечно в дозе 200 мг ежедневно (20 инъекций на курс). Группу контроля (2-я группа) составили пациенты (45 женщин и 20 мужчин) в возрасте 53,50±3,27 года, получавшие комбинированную симптоммодифицирующую терапию (ХС 1000 мг+глюкозамина сульфат 1000 мг) перорально в течение трех месяцев. Для пациентов 2-й группы допускалось применение селективного ингибитора циклооксигеназы-2 в режиме «по потребности» при интенсивном болевом синдроме (мелоксикам перорально в суточной дозе 7,5 мг в течение не более 5 дней подряд). Пациенты в обеих группах имели сопутствующие заболевания: сахарный диабет 2 типа, ишемическая болезнь сердца, гипертоническая болезнь, дискинезия желчевыводящих путей. У пациентов 1-й и 2-й групп исследовался суммарный индекс Лекена, индекс боли по визуально-аналоговой шкале (ВАШ), терапевтический эффект, по мнению пациента и врача, качество жизни (в соответствии с опросником качества жизни SF-36); оценивались побочные эффекты терапии. Клинические показатели определялись до начала терапии и после ее окончания.
 Рентгенография коленных суставов выполнена по методике Buckland–Wright в условиях весовой нагрузки в прямой проекции. Рентгенологическая стадия ОА коленных суставов устанавливалась согласно классификации I, J.H. Kellgren и Lawrens J.S. (1957) [10]. Для определения стадии коксартроза проведена стандартная рентгенография таза и тазобедренных суставов [11]. По возрасту, длительности заболевания, показателям индекса Лекена, интенсивности боли, определяемой по ВАШ до начала терапии, и рентгенологической стадии ОА коленных и тазобедренных суставов обе группы пациентов были полностью сопоставимыми (табл. 1).
Рентгенография коленных суставов выполнена по методике Buckland–Wright в условиях весовой нагрузки в прямой проекции. Рентгенологическая стадия ОА коленных суставов устанавливалась согласно классификации I, J.H. Kellgren и Lawrens J.S. (1957) [10]. Для определения стадии коксартроза проведена стандартная рентгенография таза и тазобедренных суставов [11]. По возрасту, длительности заболевания, показателям индекса Лекена, интенсивности боли, определяемой по ВАШ до начала терапии, и рентгенологической стадии ОА коленных и тазобедренных суставов обе группы пациентов были полностью сопоставимыми (табл. 1).
Критерии включения в исследование: подписанное пациентом информированное согласие, наличие первичного ОА коленных и тазобедренных суставов I–III стадии, наличие боли в целевом суставе от 40 мм по ВАШ, индекс Лекена от 4 до 12 баллов.
Критерии исключения из исследования: язвенная болезнь желудка или двенадцатиперстной кишки в стадии обострения, наличие у пациента помимо первичного ОА воспалительной артропатии или системного заболевания соединительной ткани, предшествующее внутрисуставное введение глюкокортикоидов.
Статистическая обработка материала проведена с использованием программы Statistica Base 6.0. Применены методы описательной статистики, непараметрические методы. Статистическая значимость показателей была определена как р<0,05. Для сравнения диапазонов значений нескольких переменных использоваланы диаграмма размаха и коэффициент ранговой корреляции Спирмена. При сравнении зависимых групп по количественному признаку использован Т-критерий Стьюдента.
Результаты и обсуждение
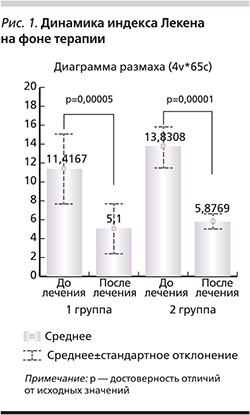
При оценке индекса Лекена у пациентов 1-й группы, получавших внутримышечные инъекции Хондрогарда, по окончании курса терапии было выявлено статистически значимое снижение интенсивности боли, увеличение максимальной дистанции при ходьбе, повышение функциональной активности: с 11,42±3,54 до 5,1±2,68, (p=0,00005) (рис. 1). Во 2-й группе эффективность проводимой симптоммодифицирующей терапии была сопоставимой с 1-й группой: отмечено снижение индекса Лекена с 13,83±2,15 до 5,87±0,86, (p=0,00001) (рис. 1).
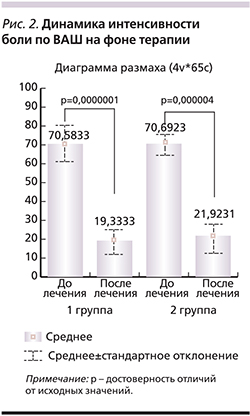
У пациентов 1-й группы, получавших в качестве монотерапии ХС парентерально, было отмечено статистически значимое снижение интенсивности боли по ВАШ: с 70,58±9,66 до 19,33±6,79%; r=0,8897, p=0,0000001 (рис. 2). Эффект обезболивающего воздействия Хондрогарда сравним со 2-й группой пациентов: отмечено снижение индекса боли по ВАШ с 70,69±7,11 до 21,92±6,29; r=0,6169, p=0,000004 (рис. 2).
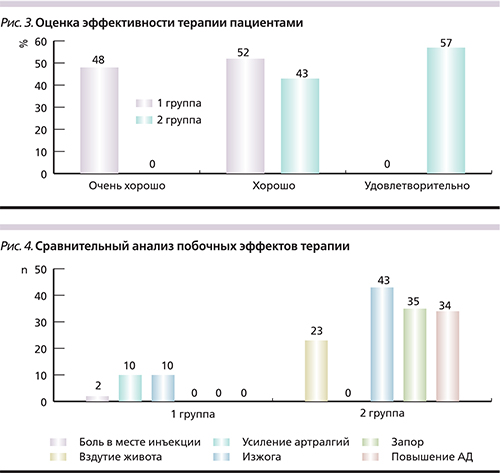
Стойкий обезболивающий эффект был достигнут к 10-му дню терапии Хондрогардом и к 7-й неделе терапии пациентов 2-й группы. Оценка эффективности терапии Хондрогардом пациентами 1-й группы имела прямую корреляционную зависимость с оценкой терапии врачом (p=0,0005): 48% пациентов оценили терапию Хондрогардом как «очень хорошо», 52% как «хорошо» (рис. 3). Пациенты 2-й группы оценили проводимую терапию как «хорошо» в 43 и в 57% как «удовлетворительно» (рис. 3).
По результатам исследования было отмечено значительное улучшение качества жизни всех участвовавших пациентов: увеличение физической активности, включая самообслуживание, ходьбу, подъем по лестнице; повышение показателей по шкале Role Physical; повышение показателей шкалы жизнеспособности (p<0,0001).
В 1-й группе у 22 (13%) больных были отмечены нежелательные реакции (побочные эффекты терапии) по типу кратковременной болезненности в месте инъекции ХС, вздутия живота и усиления артралгий. Все нежелательные реакции были купированы назначением симптоматической терапии и не требовали отмены препарата. Во 2-й группе у 43 (28%) пациентов была отмечена изжога, у 35 (23%) – запор, у 23 (15%) – вздутие живота, у 34 (22%) пациентов – стойкое повышение артериального давления (рис. 4).
Выводы
ХС для внутримышечного введения (Хондрогард) является эффективным симптоммодифицирующим препаратом в терапии первичного ОА крупных суставов, позволяющим расширять функциональные возможности и улучшать качество жизни у пациентов.
Доказан выраженный обезболивающий эффект Хондрогарда при минимальном количестве побочных проявлений, что позволяет повысить безопасность терапии ОА и уменьшить риск нежелательного лекарственного взаимодействия у пациентов старше 55 лет с коморбидно-стью.
Наличие сопутствующих заболеваний у пациентов старшей возрастной группы предполагает применение в терапии ОА именно парентеральной формы ХС ввиду ее более высокой биодоступности и отсутствия характерных для пероральных симптом-модифицирущих препаратов и побочных эффектов, характерных для нестероидных противовоспалительных средств.



