Основное проявление мигрени – повторяющиеся интенсивные, чаще односторонние, приступы головной боли (ГБ), которые могут возникать с различной частотой – от одного приступа в год до 15 и более в месяц. Мигренозная боль, чаще пульсирующего и давящего характера, обычно захватывает половину головы и локализуется в области лба, виска и вокруг глаза; иногда может начинаться в затылочной области и распространяться в область лба.
У некоторых пациентов за 5–20 минут до приступа возникает мигренозная аура – комплекс неврологических, чаще зрительных симптомов, возникающих непосредственно перед или вначале мигренозной ГБ. По этому признаку различают мигрень без ауры и мигрень с аурой [1, 4, 15, 26].
Приступ, как правило, сопровождается тошнотой, повышенной чувствительностью к дневному свету (фотофобия), звукам (фонофобия) и запахам (осмофобия). Боль при мигрени усиливается от обычной физической активности, например при ходьбе или подъеме по лестнице. Приступы могут вызываться эмоциональным стрессом, изменением погоды, менструацией, голодом, духотой, физической нагрузкой, недосыпанием или избыточным сном, некоторыми пищевыми продуктами (шоколад, цитрусовые, бананы, жирные сыры), приемом алкоголя.
Чаще всего приходится дифференцировать мигрень с ГБ напряжения (ГБН). Последняя в отличие от мигрени, является, как правило, двусторонней, менее интенсивной, носит не пульсирующий, а сжимающий характер по типу «обруча» или «каски», никогда не сопровождается всеми типичными для мигрени симптомами, иногда может отмечаться лишь один симптом, например легкая тошнота или фотофобия. Пациенты с сочетанием мигрени и ГБН, как правило, способны отличать эти болевые эпизоды друг от друга [10, 30].
Традиционная терапия мигрени включает три основных компонента: поведенческую терапию, купирование уже развившегося приступа и профилактическое лечение, направленное на снижение частоты болевых эпизодов [1, 4, 6, 11].
Большое значение для успеха лечения мигрени имеет поведенческая терапия, направленная на разъяснение пациенту доброкачественной природы заболевания, модификацию образа жизни (советы по избеганию мигренозных провокаторов, применению немедикаментозных методов и психологической релаксации, соблюдению правильного режима труда, сна и бодрствования), перспектив и реальных целей лечения. Пациента следует информировать о том, какие препараты способны быстро и эффективно купировать боль, разъяснить правила их приема, обсудить возможные побочные эффекты, а также сообщить о перспективе существенно уменьшить частоту болевых эпизодов с помощью адекватной профилактической терапии.
Лечение приступа направлено на уменьшение интенсивности и длительности болевого эпизода, купирование сопутствующих симптомов (тошнота, рвота, общая слабость, анорексия и т.д.) и на восстановление работоспособности и общего состояния пациента.
Медикаментозную терапию следует назначать в зависимости от интенсивности приступа и степени дезадаптации пациента: легкий приступ – пациент в состоянии выполнять привычную домашнюю и профессиональную работу; приступ средней тяжести – не может выполнять привычную домашнюю или профессиональную работу; тяжелой приступ – пациент вынужден соблюдать постельный режим [5, 7, 10, 16].
1-й этап. При приступах легкой и средней тяжести показаны простые анальгетики (нестероидные противовоспалительные средства – НВПС), при необходимости – противорвотные средства [6, 11, 18, 21]. В табл. 1 суммированы данные по эффективности применения анальгетиков в купировании приступа мтгрени.
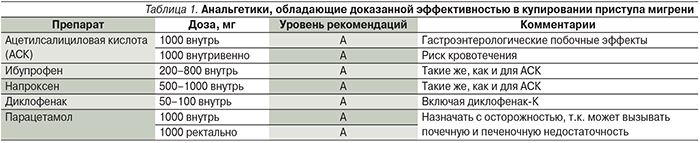
При назначении лечения необходимо предупредить пациентов о возможном риске привыкания и развития лекарственно-индуцированной (абузусной) ГБ, связанной с избыточным применением обезболивающих препаратов (ЛИГБ – лекарственно индуцированная ГБ). Особенно высок этот риск у больных с большой частотой атак мигрени – более 6 приступов в месяц. Во избежание развития ЛИГБ не следует использовать анальгетики более 14 дней в месяц [10, 26, 27]. Наибольшим потенциалом вызывать ЛИГБ обладают комбинированные анальгетики, содержащие кофеин, кодеин и барбитураты. В связи с риском агранулоцитоза применение метамизола натрия (анальгина) и комбинированных анальгетиков, содержащих его в составе, также не рекомендовано [8].
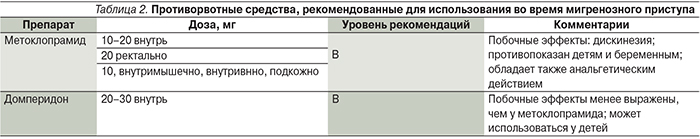
При выраженной тошноте и рвоте целесообразно использование противорвотных средств, которые также уменьшают гастростаз и улучшают всасывание обезболивающих препаратов (табл. 2) [1, 6, 19]. Антиэметики назначают за 10–15 минут до приема анальгетиков.
2-й этап. При неэффективности простых анальгетиков при тяжелых приступах мигрени и значительной дезадаптации показаны специфические препараты, к которым относятся триптаны и эрготаминсодержащие средства (алкалоиды спорыньи).
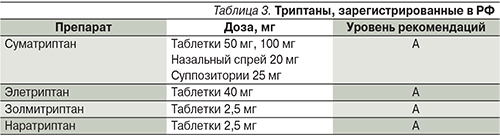
В связи с риском серьезных побочных эффектов производные эрготамина в последнее время применяются редко. Наибольшей эффективностью в купировании приступов мигрени обладают агонисты серотониновых рецепторов типа 5НТ1 – триптаны (табл. 3) [7, 12, 15, 21].
Обладая агонистическим действием в отношении постсинаптических серотониновых 5-НТ1В-рецепторов гладкомышечных элементов сосудистой стенки, триптаны подавляют выделение алгогенных нейропептидов, что сопровождается уменьшением нейрогенного воспаления, нормализацией тонуса сосудов твердой мозговой оболочки и прекращением мигренозной боли. Триптаны обладают высокой селективностью в отношении интракраниальных кровеносных сосудов и незначительной – в отношении коронарных и периферических сосудов [1, 26, 30]. Кроме того, триптаны обладают и центральным механизмом действия – активируют центральные 5-НТ1D-рецепторы, расположенные в стволе головного мозга на чувствительных ядрах тройничного нерва. Эти препараты ингибируют выделение алгогенных нейропептидов из центральных окончаний тройничного нерва, тем самым тормозя проведение боли на уровне чувствительных ядер ствола. Предполагается, что центральный механизм действия обусловливает продолжительность действия 5-НТ1-агонистов, способствует уменьшению рецидивов приступов мигрени и обеспечивает эффективность триптанов в отношении сопутствующих тошноты, рвоты, фоно- и фотофобии.
Первым препаратом из группы триптанов, эффективность и безопасность которого были подтверждены в многочисленных клинических исследованиях, был суматриптан [5, 7, 14, 21]. Один из наиболее доступных в России и эффективных форм суматриптана — препарат Сумамигрен. Эффективность и переносимость Сумамигрена (таблетки 50 мг) были изучены на 30 пациентах с мигренью (4 мужчины и 26 женщин; средний возраст — 39,4±10,5 года, длительность заболевания – 23,1±10,3 года; Г.Р. Табеева, Ю.Э. Азимова, 2007) [14]. Пациенты обследовались на протяжении трех приступов, таким образом, в исследовании проанализированы результаты лечения 90 приступов мигрени. Характеристики приступа (время начала, продолжительность, выраженность ГБ, тошноты, фото- и фотофобии) до и после приема Сумамигрена (через 30 минут, 1, 2, 6 и 24 часа) оценивали с помощью дневника ГБ.
Достоверное уменьшение ГБ (с 7,1±1,7 до 4,9±2,1 балла по визуальной аналоговой шкале – ВАШ; p<0,05) и сопутствующих симптомов отмечалось уже через 1 час после приема препарата; через 2 часа интенсивность цефалгии в исследуемой группе в среднем составила 2,7±1,3 балла, а через 6 часов – всего 1,3±1,4 балла.
У большинства пациентов (53,3%) Сумамигрен был эффективен в двух приступах из трех, примерно у трети (26,7%) – во всех трех приступах, у 7% – в одном приступе из трех; для 13,3% препарат не был эффективен ни в одном из приступов. Наибольшая эффективность Сумамигрена отмечена у пациентов с медленным нарастанием интенсивности боли (в течение 2–3 часов); у пациентов с быстрым нарастанием боли (в течение 30 минут) препарат обладал существенно меньшей эффективностью.
Было также показано, что достоверно больший регресс ГБ через 1 час (на 2,5±0,3 балла) и через 2 часа (на 2,3±0,4 балла) после приема препарата отмечен у пациентов, которые принимали Сумамигрен рано, т.е. в первые 30 минут приступа. У пациентов с поздним приемом препарата (через 60 и более минут) эффективность Сумамигрена была достоверно меньше. У пациентов, которые не затягивали с приемом Сумамигрена (по сравнению с теми, кто принимал препарат спустя 1 час и более от начала приступа) рецидив ГБ в течение 24 часов отмечался достоверно реже (7,8 и 20,5% соответственно), а в течение суток, когда отмечался приступ мигрени, наблюдалось достоверно более высокое качество жизни.
Показано, что раннее купирование приступов мигрени позволяет избегать развития центральной сенситизации, которая лежит в основе хронизации мигрени [22–24, 28].
Последующий анализ показал, что большинство пациентов из «неэффективной» группы отмечали быстрое нарастание ГБ и/или поздно принимали исследуемый препарат.
Таким образом, эффективность Сумамигрена гораздо выше при его раннем применении у пациентов с медленным нарастанием интенсивности ГБ. Клиническим ориентиром для назначения Сумамигрена является легкая или умеренная интенсивность ГБ (не более 7 баллов по ВАШ).
Следует остановиться на общих принципах назначения триптанов [1, 2, 5, 16]:
- Ранний прием триптанов (в первые 30 минут приступа) способствует более эффективному купированию приступа.
- Повторное использование триптана возможно через 2 часа после приема первой дозы; не следует использовать более 2 доз триптанов в сутки.
- При неэффективности одного триптана следует пробовать другие препараты этого класса.
- Сочетанное применение триптана и НПВС (например, суматриптан+напроксен) может быть более эффективным, чем монотерапия.
- Перед началом лечения следует предупредить пациента о возможности побочных эффектов после приема триптана; в числе наиболее частых — неприятное чувство сжатия в грудной клетке, обусловленное незначительным констрикторным действием триптанов на коронарные артерии (именно поэтому триптаны противопоказаны пациентам с ишемической болезнью сердца – ИБС).
- Триптаны показаны только для купирования мигренозной ГБ и неэффективны при других разновидностях цефалгий, например при ГБН. Поэтому при наличии у пациента нескольких форм ГБ чрезвычайно важным является способность пациента отличать приступ мигрени от других типов боли.
- Пациенты, страдающие мигренью с аурой, должны принимать триптаны не в начале, а в конце фазы ауры.
- При назначении триптанов пациентам с частыми приступами мигрени необходимо предупредить их о возможном риске лекарственного абузуса и развитии ЛИГБ (при регулярном приеме одного или более триптанов ≥10 дней/мес в течение ≥3 мес).
В целом триптаны хорошо переносятся, а противопоказания к их назначению редко встречаются у пациентов с М.
Основными противопоказаниями к назначению триптанов являются ИБС (в т.ч. инфаркт миокарда и постинфарктный кардиосклероз), окклюзионные заболевания периферических сосудов, инсульт или транзиторная ишемическая атака (в т.ч. в анамнезе), неконтролируемая артериальная гипертензия. В связи с наличием противопоказаний и побочных эффектов перед началом приема триптанов пациент должен внимательно ознакомиться с инструкцией по применению препарата.
Профилактическая терапия позволяет не только существенно снизить частоту, продолжительность и силу приступов, но и уменьшить выраженность коморбидных нарушений, значительно повысить качество жизни пациента и, что наиболее важно, предотвратить хронизацию мигрени [3, 4, 9, 13]. Наиболее эффективны в профилактике мигрени β-адреноблокаторы (пропранолол, метопролол и др.), сартаны (кандесартан), антидепрессанты (амитриптилин, венлафаксин), антиконвульсанты (вальпроевая кислота, топирамат) и ботулинический токсин типа А [11, 18 20, 21].
Важнейшими составляющими ведения пациента с мигренью также являются лечение коморбидных нарушений (тревога, депрессия, другие болевые синдромы, сопутствующая ГБН, нарушение ночного сна, напряжение мышц шеи и затылка – мышечно-тонический синдром и др.), а также преодоление факторов, приводящих к учащению приступов, т.н. факторов хронизации (в первую очередь коррекция эмоциональных расстройств и профилактика лекарственного абузуса – избыточного применения обезболивающих препаратов) [10, 15].
У многих пациентов заметный эффект оказывают и методы нелекарственной терапии: биологическая обратная связь, иглоукалывание, иглорефлексотерапия, гирудотерапия, методы магнитной стимуляции [9, 25]. В последние годы в мире у пациентов с тяжелой мигренью, устойчивой ко всем видам терапии (т.н. рефрактерная мигрень), все шире и с успехом применяются методы нейростимуляции, в т.ч. инвазивной (в частности, стимуляция большого затылочного нерва) [29, 31].
В заключение следует отметить, что эффективное и своевременное купирование приступов мигрени, адекватное профилактическое лечение, сочетающееся с нелекарственными подходами и модификацией образа жизни пациента, позволяют значительно облегчить течение мигрени, улучшить социальную адаптацию и предотвратить хронизацию заболевания у большинства больных мигренью.



