Во многих развитых странах мира проблема дифференциальной диагностики болезней предстательной железы остается одной из наиболее актуальных до настоящего времени. Во многом это связано с прогрессивным ростом и широкой распространенностью воспалительных, доброкачественных и злокачественных заболеваний у мужчин как пожилого, так и трудоспособного возраста [1]. Особое внимание при этом уделяется вопросу выявления рака предстательной железы (РПЖ) на ранних стадиях онкопроцесса, который в большинстве случаев развивается на фоне уже имеющейся доброкачественной гиперплазии предстательной железы (ДГПЖ) и хронического простатита (ХП). Следовательно, раннее выявление локализированных форм рака сопряжено с возможностью эффективного лечения [2].
Несмотря на определенную прогностическую значимость ультразвуковых методов исследования, результатов магнито-резонансной томографии и определения фракций простат-специфического антигена в сыворотке крови, у больных РПЖ течение болезни существенно различается [3]. Следовательно, изучение дополнительных биологических характеристик первичной опухоли имеет как важное теоретическое значение для понимания процессов канцерогенеза в предстательной железе, так и практическое значение для прогнозирования течения болезни и улучшения результатов лечения. Не вызывает сомнений, что развитие злокачественной опухоли, в т.ч. и в предстательной железе, процесс мультифакторный, сопряженный с нарушением или перестройкой большей части внутриклеточных механизмов. В связи с этим прогнозирование течения процесса лишь по одному маркеру невозможно [4].
Одна из основных функций теломер заключается в сохранении целостности и стабильности хромосом: теломеры препятствуют нуклеазной деградации хромосомных концов, а также предотвращают их слияние. В клетках человека идентифицирован теломер-связывающий белковый фактор TRF1, способный связываться с теломерными повторами in vitro. Данный белок присоединяется к двухнитевым участкам теломер и препятствует работе фермента теломеразы. Этот фермент отвечает за восстановление теломер, концевых участков хромосом, которые укорачиваются при каждом делении. Активация теломеразы в обычной соматической клетке приводит к стабилизации длины теломер, что в свою очередь ведет к нарушению запрограммированной гибели клеток, которые приобретают возможность неограниченного роста (иммортализация) [5]. Уменьшение количества TRF1 в цитоплазме ведет к постепенному удлинению теломер, поскольку открывается доступ для работы теломеразы [5]. Показана диагностическая значимость TRF1 при разных онкопатологиях, например при раке желудка [6], однако литературные данные по использованию этого маркера в диагностике рака предстательной железы отсутствуют.
Опухолевые клетки в процессе ангиогенеза продуцируют фактор роста эндотелия (VEGF), стимулируют деление и ускоряют формирование капилляров в опухоли [7, 8]. Помимо этого клетки опухолей продуцируют ферменты семейства матрикс-металлопротеиназ (MMP), например MMP-7 (матрилизин), которые разрушают внеклеточный матрикс, упрощая инвазию клеток эндотелия и образование капилляров в опухолевой ткани. Инвазия сосудов в опухоль и способность опухолевых клеток с помощью металлопротеиназ растворять базальные мембраны обеспечивают им проникновение в кровоток и метастазирование в различные органы и ткани [9]. В физиологических условиях и при доброкачественных и воспалительных процессах сохраняется функция биологических механизмов по предотвращению протеолиза тканей, таких как секреция клетками стромы тканевых ингибиторов металлопротеаз (tissue inhibitor of metalloproteinases, TIMP) [10].
В связи с этим целью настоящего исследования явилось определение уровней продукции мРНК VEGF и рецепторов к нему KDR и FLT-1, TRF1, MMP-1, MMP-7 и TIMP-2 в биоптатах предстательной железы пациентов с ДГПЖ, РПЖ, ХП и простатической интраэпителиальной неоплазией (ПИН).
Материал и методы
Факторы роста исследованы у 263 больных. При этом в зависимости от диагноза пациентов разделили на 4 группы. Группа пациентов с ХП состояла из 11 мужчин (средний возраст – 66,1±0,8), группа больных с ДГПЖ из 38 человек (средний возраст – 68,4±1,0), группа пациентов с ДГПЖ+ПИН из 32 пациентов (средний возраст – 68,7±0,9 года), группа больных с верифицированным РПЖ из 58 пациентов (средний возраст – 68,8±1,2 года). Статистически достоверных различий между группами по возрасту выявлено не было (р>0,05).
РНК выделяли методом, предложенным Р. Chomczynski, с некоторыми модификациями [11]. Концентрацию полученных растворов РНК измеряли c помощью спектрофотометра «GeneQuant pro» («Amersham Pharmacia Biotech», Великобритания) по поглощению при длине волны 260 нм.
Для оценки качества выделенной РНК проводили электрофорез образцов (по 1 мкг) в 1,5%-ном агарозном геле. После электрофореза гель окрашивали с помощью красителя SYBRGreen II («Sigma», США): 8 мкл на 40 мл геля с экспозицией 40 минут. Целостность РНК оценивали визуально при облучении геля на ультрафиолетовом трансиллюминаторе по наличию двух субъединиц (28S и 18S) рибосомальной РНК. Уровни продукции мРНК VEGF, KDR, FLT-1, TRIF-1, MMP-1, MMP-7 и TIMP-2 оценивали полуколичественным методом после выполнения совмещенных реакций обратной транскрипции и полимеразной цепной реакции (ПЦР).

Обратную транскрипцию проводили в 25 мкл реакционной смеси, приготовленной на обработанной DEPC деионизированной стерильной воде и содержащей 67 мM Tris-HCl (pH 8,8), 16,6 мM (NH4)2SO4, 0,01% Tween-20, 4 мM MgCl2, 1 мM каждого дезоксирибонуклеозидфосфата (dNTP), 3,2 мкг гексамерных праймеров со случайной последовательностью, 10 мM дитиотреитола, 10 ЕД ингибитора рибонуклеаз («Fermentas», Литва), 30 ЕД рекомбинантной обратной транскриптазы M-MLV («Sigma», США), 1 мкг РНК. Смесь инкубировали при 42°С в течение часа. Реакцию останавливали путем денатурации обратной транскриптазы, выдерживая смесь при 94°С в течение 10 минут. Полученную кДНК амплифицировали методом ПЦР с использованием специфических праймеров на исследуемые РНК-матрицы. Количество циклов ПЦР подбирали для исследуемых кДНК на основании экспоненциальных кривых выхода ПЦР-продукта.
Продукты ПЦР разделяли методом электрофореза в 2%-ном агарозном геле и 0,1 M TBE буфере. Образцы вносили в лунки геля в объеме 10 мкл. Визуализацию разделенных продуктов проводили на ультрафиолетовом трансиллюминаторе после выдерживания геля в высокочувствительном красителе SYBRGreen I («Sigma, США): 8 мкл на 40 мл геля с экспозицией 40 минут. Гель снимали на цифровую фотокамеру Kodak с выдержкой 1 секунда и проводили анализ изображения на компьютере с помощью программы «ImageJ». Для полуколичественной оценки уровня продукции мРНК VEGF, KDR, FLT-1, TRIF-1, MMP 1-го и 7-го типов, TIMP-2, а также фрагмента β-актина измеряли интенсивность свечения в геле ПЦР-продуктов, после этого определяли отношение интенсивности свечения исследуемого фрагмента к интенсивности свечения фрагмента β-актина.
Пример электрофоретического разделения ПЦР-продуктов фрагментов генов, кодирующих TRF1, MMP-7 и β-актин, представлен на рис. 1. Ген, кодирующий β-актин, является конститутивным и его продукция в клетках осуществляется на определенном постоянном уровне. В связи с этим исследования были направлены на определение отношений уровней продукции мРНК вышеуказанных факторов к уровню продукции мРНК гена, кодирующего β-актин, что позволило понять, при каких заболеваниях простаты и в какой степени меняется уровень продукции исследуемых факторов относительно стандартного показателя продукции конститутивного гена.
Результаты и обсуждение
При оценке относительного уровня продукции VEGF было выявлено отсутствие статистически значимых различий между группами пациентов с ХП, ДГПЖ, ПИН и РПЖ (p>0,05, рис. 2). Так, у пациентов с верифицированным РПЖ средний уровень продукции сосудистого фактора выше в 1,3; в 2,4 и 1,4 раза, чем у больных групп ПИН, ДГПЖ и ХП соответственно. Следовательно, неоангиогенез наблюдается при воспалительных, доброкачественных заболеваниях предстательной железы и РПЖ, но при злокачественной трансформации уровень продукции сосудистого фактора несколько выше.
При оценке показателей уровней продукции соотношения KDR/β-актин выявлено, что у пациентов с верифицированным РПЖ средний уровень указанного фактора в 1,3; 3,3 и 1,2 раза выше, чем у пациентов групп ПИН, ДГПЖ и ХП. Следовательно, пролиферативные процессы наблюдаются при доброкачественных и злокачественных новообразованиях предстательной железы, но при ДГПЖ выражены в меньшей степени. Однако также все эти соотношения признаны статистически не достоверными (p>0,05, рис. 3).
При анализе процессов дифференцировки эндотелиоцитов посредством определения уровней продукции FLT-1/β-актин выявлено, что у больных РПЖ данное соотношение было в 1,3 раза выше, чем у пациентов с ХП.
В то же время уровень продукции FLT-1/β-актин был в 1,8 и 3,9 раза ниже, чем у пациентов групп ПИН и ДГПЖ соответственно. Таким образом, последовательно в группах ДГПЖ–ПИН–РПЖ происходит снижение активности процессов дифференцировки эндотелиоцитов (p>0,05; рис. 4).
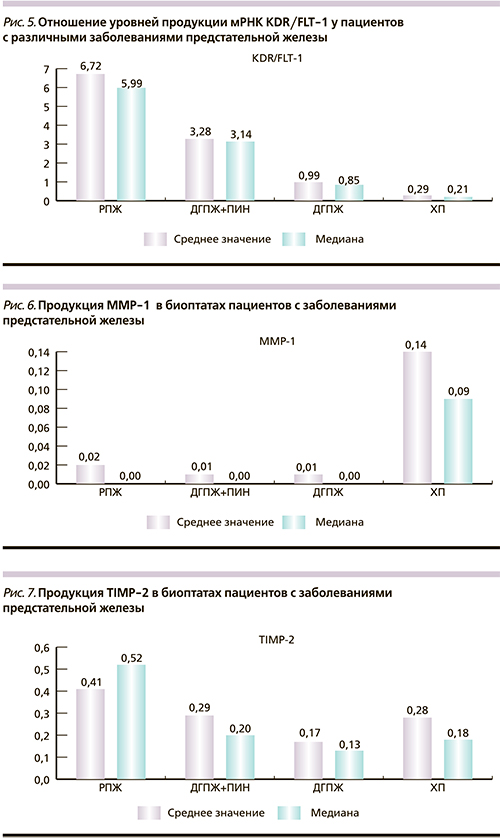
При одновременном анализе процессов пролиферации и дифференцировки эндотелиоцитов выявлено, что статистически достоверными признаны различия в средних значениях отношения уровней продукции мРНК KDR/FLT-1 у пациентов с РПЖ, ПИН, ДГПЖ и ХП (p<0,05). Как демонстрирует рис. 5, от группы пациентов с РПЖ к группе пациентов с ХП наблюдается последовательное уменьшение значений уровней продукции KDR/FLT-1. Так, в группе пациентов с РПЖ среднее значение отношения уровней продукции мРНК KDR/FLT-1 в 2, 7 и 23 раза превышает данное значение по сравнению с группами ПИН, ДГПЖ и ХП соответственно.
Последовательное уменьшение значений отношения уровней продукции KDR/FLT-1 от группы РПЖ к группе ХП происходит в связи со снижением активности процессов пролиферации при одновременном усилении процессов дифференцировки. Рост новых сосудов детерминирован балансом между процессами пролиферации процессами дифференцировки. При низком значении соотношения пролиферации к дифференцировке активность неоангиогенеза резко падает, напротив, при высоких значениях соотношения происходит активный запуск неоангиогенеза с формированием новой системы кровоснабжения, дающую возможность роста опухоли за пределы ее первоначальных размеров и возможность метастазирования.
Таким образом, процессы ангиогенеза наблюдаются при воспалительных, доброкачественных и злокачественных заболеваниях предстательной железы. Раздельный анализ уровней продукции сосудистого фактора роста и рецепторов пролиферации и дифференцировки капилляров не позволяет достоверно дифференцировать РПЖ. Определение уровней продукции соотношения KDR/FLT-1 является ценным диагностическим маркером для достоверного отличия всех исследуемых заболеваний предстательной железы (РПЖ, ПИН, ДГПЖ и ХП).
Анализ уровней продукции ММР-1 показал, что у пациентов с ХП данный уровень выше, чем у пациентов РПЖ в 7 раз, и определялся у пациентов группы ДГПЖ и ПИН на низком уровне. Следовательно, у пациентов с ДГПЖ и ПИН продукция MMP-1 резко снижена (p>0,05; рис. 6).
Таким образом, уровень экспрессии ММР-1 ниже у больных РПЖ, ПИН и ДГПЖ по сравнению с пациентами с ХП. Можно предположить, что исследуемый тип металлопротеиназы не играет существенную роль в процессах неоангиогенеза при злокачественных и доброкачественных новообразованиях предстательной железы и встречается при воспалительных процессах в простате.
При анализе чувствительности и специфичности определения продукции ММР-1 выявлено, что данные показатели составили соответственно 18 и 83%.
Исследование уровней продукции TIMP-2 (рис. 7) показало, что у пациентов с верифицированным РПЖ продукция данного фактора в 2,4 раза выше, чем у пациентов с ДГПЖ, в 1,4 выше, чем у пациентов с ПИН, и в 1,5 раза выше, чем у пациентов с ХП. Однако у пациентов групп ХП, ДГПЖ, ПИН и РПЖ не было выявлено достоверного отличия в уровнях продукции исследуемого маркера (p>0,05). Чувствительность и специфичность определения продукции TIMP-2 составили соответственно 54 и 81%. Уровень продукции ингибитора металлопротеиназ TIMP-2 существенно выше у пациентов с верифицированным РПЖ, однако дифференцировать злокачественное новообразование от ДГПЖ и ХП по данному маркеру не представляется возможным.
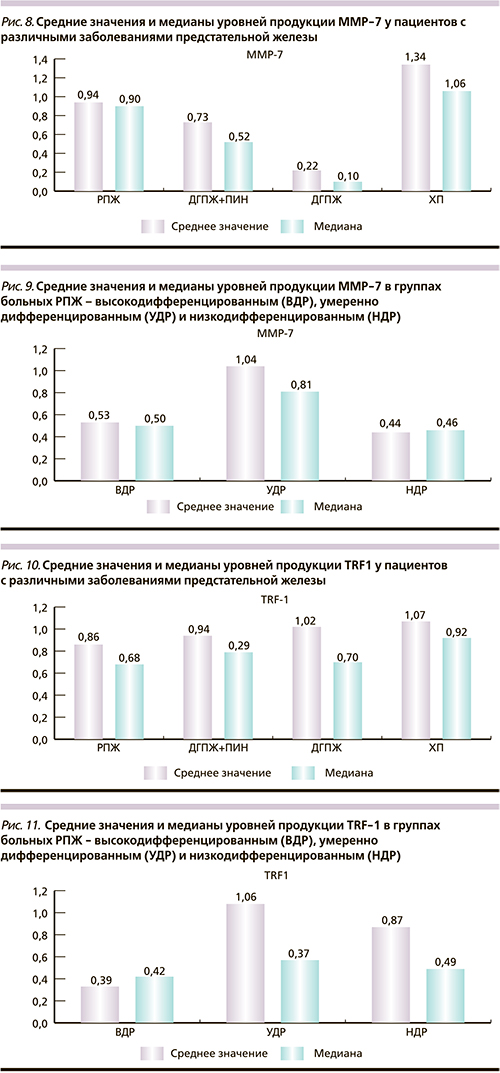
Анализ уровней продукции MMP-7 (рис. 8) показал, что у пациентов с верифицированным РПЖ продукция данного фактора в 4,2 раза выше, чем у пациентов с ДГПЖ, в 1,3 выше, чем у пациентов с ПИН, и в 1.4 раза ниже, чем у пациентов с ХП. Выявлено достоверное отличие уровней продукции MMP-7 между групп ХП–ДГПЖ и ХП–РПЖ (p<0,05). Между группами ДГПЖ, ПИН и РПЖ не было выявлено достоверного отличия в уровнях продукции исследуемого маркера (p>0,05).
Кроме того, у пациентов с умереннодифференцированным РПЖ продукция ММР-7 в 2 раза выше, чем у больных с высоко- и низкодифференцированным РПЖ (p<0,05; рис. 9).
Чувствительность и специфичность определения продукции ММР-7 составили соответственно 62 и 81%.
Продукция теломерсвязывающего белкового фактора TRF-1 выявлена во всех группах, причем несколько выше у больных ДГПЖ и ХП. Однако статистически значимых отличий между группами пациентов выявлено не было (p>0,05; рис. 10). Анализ уровней продукции TRF1 показал достоверное отличие между пациентами с высокодифференцированным РПЖ и умеренно- и низкодифференцированным РПЖ (p<0,05, рис. 11). Чувствительность и специфичность определения продукции TRF-1 составили соответственно 61 и 84%.
Полученные результаты указывают на диагностическую ценность TRF-1 и MMP-7 в отношении определения степени дифференцировки рака, но не позволяют дифференцировать доброкачественные, злокачественные и воспалительные процессы в предстательной железе. Таким образом, внедрение в клиническую урологию результатов анализа уровней продукции VEGF и рецепторов к нему (KDR, FLT-1), взаимосвязи металлопротеиназ и их ингибиторов, продукции теломерсвязывающего белкового фактора TRIF-1 позволяют расширить возможности верификации и дифференцировки воспалительных, доброкачественных, предраковых и злокачественных заболеваний предстательной железы.



