Введение
N. Ghosh и соавт. выявили в 2011 г. отсутствие рандомизированных контролируемых исследований по данной проблеме [1], проанализировав с 1950 по 2010 г. 38 работ, касающихся лечения пароксизмальных тахикардий у беременных. Таковых исследований не появилось и за последние годы. Целью настоящей статьи стала попытка обобщения данных литературы и собственного опыта работы в специализированном акушерском стационаре с точки зрения оптимизации подходов к медикаментозной коррекции пароксизмальных суправентрикулярных тахикардий у беременных.
Суправентрикулярная пароксизмальная тахикардия (СВПТ) определяется как внезапно возникающая и прекращающаяся с частотой сердечных сокращений более 120 в минуту [2]. Наиболее часто ее источником служит атриовентрикулярный узел (АВ-узловая реципрокная пароксизмальная тахикардия). Морфологической основой СВПТ могут быть и синдромы предвозбуждения миокарда (синдром Вольфа–Паркинсона–Уайта – WPW [Wolff-Parkinson-White] и Клерк–Леви–Кристеско – CLC [Clerc-Levy-Cristesco]). В такой ситуации СВПТ отмечается в 1,2 случая на 1 тыс. населения. У половины пациентов возникновение СВПТ сопровождается определенными жалобами и объективными симптомами (сердцебиение, одышка, гипотония, головокружение, синкопальные состояния) [3].
При беременности СВПТ встречается у 1 из 8000 женщин [3]. Наличие беременности обычно усиливает симптомы и утяжеляет ее течение, что отмечается в 20% наблюдений [4–6]. Развитие СВПТ может возникать при постуральном синдроме, связанном с синкопальными состояниями и тахикардией, возникающими в ортостазе из-за автономной дисфункции [7]. Прогноз при развитии постуральной тахикардии благоприятный. Прогноз неосложненной СВПТ также достаточно благоприятен, хотя данные о течении беременности у таких пациенток крайне скудны. Описано лишь 2 летальных исхода, связанных с СВПТ у беременных [8, 9]. Проводимое у таких пациенток кесарево сечение может приводить к увеличению риска в отношении матери, а в случаях недоношенности – для плода. Наличие пароксизмальной тахикардии до беременности и ее возникновение в дальнейшем ухудшает перинатальный прогноз независимо от других факторов риска [10].
Диагностика
Диагноз СВПТ верифицируется при регистрации электрокардиограммы (ЭКГ) или суточном мониторировании ЭКГ по Холтеру.
Беременность служит определенным фактором риска для возникновения СВПТ [5]. В основе этого лежат гемодинамические и гормональные изменения, свойственные беременности. Увеличение объема циркулирующей крови, характерное для беременных, может усиливать возбудимость миокарда, а учащение синусового ритма –
инициировать механизм re-entry («повторного входа»), лежащего в основе рассматриваемого нарушения ритма.
Кроме того, увеличение содержания эстрогенов, отмечаемое при беременности, усиливает возбудимость не только мышцы матки, но и миокарда [11, 12]. Эстрогены обладают способностью повышать чувствительность миокарда к катехоламинам, увеличивая число α-адренергических рецепторов [13]. Применение окситоцина, развитие гипоксии и болевого стресса могут потенцировать СВПТ при синдроме WPW [14].
Лечение
Лечение СВПТ у беременных может представлять определенные трудности. Во-первых, большинство антиаритмических препаратов и их метаболиты обладают способностью проходить плацентарный барьер и воздействовать на плод. Использование ряда антиаритмических препаратов до 8-й недели беременности потенциально тератогенно. Во-вторых, ряд физиологических эффектов, отмечаемых при беременности, таких как увеличение сердечного выброса и объема циркулирующей крови, гипопротеинемия, нарушение секреторной и моторной функции желудочно-кишечного тракта, гормональная стимуляция ферментов печени, могут влиять на абсорбцию, биодоступность и выведение большинства препаратов, в т.ч. антиаритмиков.
Купирование СВПТ осуществляется проведением наиболее эффективных из вагусных проб (проба Вальсальвы, массаж синокаротидной зоны) (Класс рекомендаций I, уровень доказательности IC) [15]. В отсутствие эффекта хорошо зарекомендовало себя использование аденозина, являющегося нуклеотидом пурина и обладающего угнетающим действием на синусовый узел, что способствует купированию тахикардии. Несмотря на увеличение объема циркулирующей крови при беременности, концентрация аденозиндеаминазы, фермента, ответственного за деградацию аденозина, снижается, поэтому внутривенного введения 6–12 мг препарата в большинстве случаев достаточно для купирования тахикардии. Препарат довольно быстро метаболизируется с периодом полувыведения около 10 секунд, он безопасен и эффективен для купирования СВПТ у беременных [6, 16, 17]. В литературе не описано серьезных осложнений после использования аденозина, однако имеется одно сообщение о развитии брадикардии у плода. Это свидетельствует о проходимости плацентарного барьера для этого препарата и необходимости мониторирования частоты сердечных сокращений у плода [18].
Антагонист кальция верапамил является столь же эффективным препаратом, как и аденозин, для перевода СВПТ в синусовый ритм [18] (Класс рекомендаций IIb, уровень доказательности IC). Однако периферическая вазодилатация и отрицательный инотропный эффект являются нежелательными побочными эффектами верапамила, поэтому отношение практикующих врачей к его использованию весьма различно [19, 20]. Привлекает токолитическое действие, свойственное препаратам этой подгруппы, что делает их предпочтительными в случаях угрозы преждевременных родов [21, 22]. Необходимо помнить, что верапамил противопоказан при СВПТ, являющейся следствием существования синдрома WPW, в связи с возможностью ускорения проведения возбуждения по дополнительным путям и увеличения частоты тахикардии.
Бета-адреноблокаторы относятся к препаратам, риск применения которых во многих случаях меньше риска продолжения СВПТ. Они хорошо переносятся и зарекомендовали себя с положительной стороны при лечении артериальной гипертензии у беременных [23]. Бета-адреноблокаторы являются препаратом выбора для пациенток с тахикардией, обусловленной синдромом WPW.
На любых сроках гестации могут назначаться сердечные гликозиды [24].
Хорошим купирующим эффектом обладает кордарон, однако пероральное использование препарата токсично для плода [25]. Тем не менее появились сообщения о безопасном использовании кордарона беременными [26].
При необходимости (развитие выраженной гипотензии, потеря сознания) на любых сроках гестации без побочных эффектов для матери и плода может быть использована электрическая кардиоверсия разрядом 50–100 Дж [27] (Класс рекомендаций I, уровень доказательности IC) или чреспищеводная кардиостимуляция [28]. Больным с рецидивирующей и тяжело протекающей СВПТ может потребоваться консультация кардиохирурга для решения вопроса об аблации дополнительных АВ-путей.
Постоянная антиаритмическая терапия показана беременным с постоянно возвратной СВПТ, протекающей с высокой частотой сердечных сокращений (более 150 в минуту), выраженными субъективными симптомами (сердцебиение, одышка при любом положении тела), существенной гипотензией (систолическое артериальное давление – АД менее 70 мм рт.ст.), пресинкопальными и синкопальными состояниями, синдромом задержки развития плода.
В 2003 г. опубликованы рекомендации Американского и Европейского обществ кардиологов по лечению СВПТ у беременных (см. таблицу) [29].
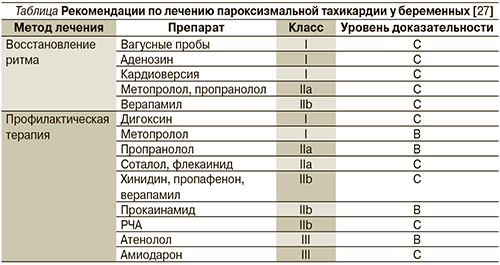
В соответствии с этими и более новыми рекомендациями Европейского общества кардиологов 2011 г. [15] препаратами первой линии являются дигоксин и β-адреноблокаторы, прежде всего пропранолол и метопролол.
Наиболее безопасен препарат дигоксин [30], однако его эффективность для профилактики СВПТ в больших рандомизированных исследованиях еще не доказана.
Использования β-адреноблокаторов лучше избегать в I триместре беременности из-за опасности развития внутриутробной задержки развития плода, что описано в случаях использования пропранолола [30] и атенолола [31]. Из побочных эффектов описаны случаи развития брадикардии и метаболические изменения у плода, гипогликемия у матери и преждевременные роды. Однако в проспективных рандомизированных исследованиях не доказано увеличения частоты этих осложнений на фоне применения β-адреноблокаторов по сравнению с плацебо. Теоретически более предпочтительным выглядит использование кардиоселективных β1-адреноблокаторов (метопролол) из-за возможности развития периферической вазодилатации и снижения тонуса матки (класс рекомендаций I, уровень доказательности IC). Атенолол не должен использоваться при лечении любых форм аритмий (класс рекомендаций III, уровень доказательности IC).
Препаратом, обладающим, по нашим данным, хорошим профилактическим эффектом при СВПТ, является соталол (класс рекомендаций IIa, уровень доказательности IC). Относясь к группе кордарона, но не имея в своем составе йода, соталол является неселективным без внутренней симпатомиметической активности β-адреноблокатором, безопасность использования которого беременными доказана [32]. Соталол обладает способностью проходить плацентарный барьер, накапливается преимущественно не в тканях плода, а в амниотической жидкости. Использование соталола не приводит к развитию синдрома задержки развития плода [33]. Препарат назначается в начальной дозе 20 мг 2 раза в сутки с постепенным увеличением до 80 мг 2 раза в сутки до прекращения или существенного урежения эпизодов СВПТ.
Наблюдение за 64 беременными с СВПТ, причиной которых у 27 (42,1%) пациенток был манифестирующий синдром WPW, показало высокую эффективность профилактического использования соталола. У всех пациенток соталол вызывал снижение АД, что требовало титрования дозировки или приема небольших дозировок препарата. Применение препарата в 23,4% позволило купировать пароксизмы тахикардии, а еще в 65,6% отмечено уменьшение длительности пароксизмов или лучшая переносимость последних (отсутствие синкопальных состояний, облегчение субъективных ощущений сердцебиения). Лишь у 7 (10,9%) пациенток не было отмечено эффекта от лечения. В этих случаях в терапии использовали конкор или рекомендовали только купирование длительных пароксизмов по «03» внутривенным введением АТФ или верапамила. У двух женщин с непрерывно рецидивирующей СВПТ, продолжавшейся на фоне антиаритмической терапии (β-адреноблокаторы и соталол), отмечено преждевременное развитие родовой деятельности на сроке 32–36 недель.
Сведения об использовании флекаинида, пропафенона, хинидина и прокаинамида крайне ограничены. Тем не менее в случае неэффективности применения дигоксина или β-адреноблокаторов для профилактики СВПТ наряду с соталолом рекомендовано использование флекаинида (класс рекомендаций IIa, уровень доказательности IC) [15]. При использовании хинидина отмечается развитие тромбоцитопении у плода и токсичность в отношении 8-й пары черепно-мозговых нервов [30].
При неэффективности профилактической медикаментозной терапии или наличии противопоказаний к ее проведению может выполняться, желательно со II триместра беременности, радиочастотная аблация (РЧА) дополнительных путей проведения [34].
Развитие СВПТ при постуральном синдроме обычно имеет благоприятное течение, не требует постоянной антиаритмической терапии, а приступы тахикардии купируются вагусными пробами и приемом аденозина.
Непрерывно рецидивирующая и устойчивая СВПТ с высокой частотой сердечных сокращений (более 150 в минуту), как правило, сопровождается субъективными симптомами и требует профилактической антиаритмической терапии, которая должна проводиться с учетом соотношения риск/польза.
Ведение родов
Ведение родов у пациенток с синдромом WPW в отсутствие приступов СВПТ осуществляется через естественные родовые пути с использованием любого вида обезболивания под наблюдением кардиолога в специализированном роддоме (3-го уровня). При оперативных родах по акушерским показаниям особенностей в проведении анестезии нет. Более предпочтительным в этих случаях выглядит использование эпидуральной или спинально-эпидуральной, нежели только спинальной, анестезии вследствие лучшего гемодинамического контроля [35]. Применение атропина во время анестезии при синдроме WPW приводит к его устранению и нормализации комплекса QRS примерно в 30% случаев.
У пациенток высокого риска с синдромом WPW, протекающим с СВПТ (потери сознания в анамнезе, недостаточная эффективность медикаментозной терапии, рецидивирующий характер пароксизмальной тахикардии), показано мониторное ЭКГ-наблюдение в родах. При возникновении СВПТ его купирование проводят по тем же принципам, что и во время беременности.
С целью контроля состояния плода при рецидивирующей или резистентной к терапии СПВТ, а также на фоне используемых антиаритмических препаратов необходимо осуществлять кардиомониторное наблюдение. Первый период родов целесообразно вести в положении на левом боку с целью исключения аортокавальной компрессии. Зарубежные авторы рекомендуют ведение всех этапов родов в положении роженицы на боку [36].
Ведение второго периода родов осуществляется без ограничения потуг. Более того, задержка дыхания во время потуг часто способствует прекращению приступа СВПТ.
Оперативное родоразрешение по кардиологическим показаниям проводится крайне редко (в нашей практике не встречалось) в случаях СВПТ с крайне высокой частотой (более 200 в минуту), требующих повторных электрических кардиоверсий или протекающих с гемодинамической нестабильностью [37].
Послеродовой период
Послеродовой период у женщин с синдромом WPW и СВПТ протекает без осложнений. Особенности ведения и необходимость в медикаментозной коррекции определяются частотой возникновения и стойкостью пароксизмов СВПТ.
Таким образом, информация, представленная в настоящем обзоре и основанная на современных рекомендациях Российского, Европейского и Американского обществ кардиологов по профилактике и купированию СВПТ у беременных, должна служить своеобразной «дорожной картой» для практикующих кардиологов акушерских стационаров 3-го уровня. Оптимизация профилактической антиаритмической терапии, критичный и объективный подход к оценке тяжести тахикардии позволяют избегать необоснованного оперативного родоразрешения, в т.ч. на ранних сроках беременности.


