Физические, психологические и социальные последствия злоупотребления алкоголем остаются важной проблемой общественного здоровья и связаны с большими прямыми и непрямыми экономическими затратами системы здравоохранения и общества в целом [1]. Высокое потребление алкоголя ассоциируется с повышенным риском инвалидности и смертности вследствие цирроза печени, некоторых видов рака, сердечно-сосудистых заболеваний и травм [2, 3]. В настоящее время выявлена связь между высоким потреблением алкоголя и более чем 200 заболеваниями, включая ВИЧ-инфекцию, туберкулез и пневмонию [4]. По данным ВОЗ, в 2012 г. около 3,3 млн смертей (5,9% всех смертей, 7,6% смертей среди мужчин и 4,0% – среди женщин) и 5,1% глобального бремени заболеваний в мире были связаны со злоупотреблением алкоголем [4]. Наиболее высокая смертность наблюдается в европейском регионе [4], где более двух третей всех случаев преждевременной смерти (15–64 года) обусловлены алкоголизмом [5]. Преждевременная смертность, а также вызванные алкоголизмом потери производительности труда, криминальная активность и аварии приводят к значительным экономическим затратам [2, 6]. Стоимость чрезмерного потребления алкоголя в мире превышает 200 млрд долл. в год [6], во многих странах достигая 2–3% от валового национального продукта [7]. Кроме того, алкогольная зависимость связана с существенными неосязаемыми затратами (переживания пациента и его близких, семейные проблемы, снижение качества жизни и др.). [8, 9].
Потребление алкоголя и в Европе, и в США продолжает расти по мере повышения доходов населения [10]. ВОЗ указывает, что «как правило, страны с высоким доходом имеют более высокий уровень потребления алкоголя на душу населения и более высокую распространенность эпизодов употребления большого количества алкоголя среди лиц с алкогольной зависимостью» [4]. Например, в Европе число лиц с алкогольной зависимостью достигло примерно 15 млн человек [1]. Россия по состоянию на 2010 г. занимала в списке ВОЗ 4-е место в мире по показателю потребления алкоголя на душу населения (15,1 л/год), уступая по данному показателю лишь трем другим бывшим республикам СССР – Беларуси (17,5 л), Молдавии (16,8) и Литве (15,4) [4].
Несмотря на серьезные медицинские и социально-экономические последствия алкоголизма для пациента и общества, существенных успехов в его лечении до сих пор не достигнуто. Более того, значительная часть больных вообще не обращаются за медицинской помощью. В Европе и США доля пациентов, получающих адекватное лечение, не превышает 8–10% [11–13], а в России, по-видимому, еще ниже. Причины этого многообразны: стигма заболевания и чувство стыда у пациента обращаться за помощью по поводу алкоголизма, неприятие самой идеи полного воздержания от приема алкоголя, сомнения в своей способности поддерживать абстиненцию и способности врача оказать помощь в этом и ряд других причин [14, 15]. Причем нежелание и неспособность поддержания полного воздержания от приема этанола относятся к числу наиболее важных причин. В эпидемиологических исследованиях показано, что около половины лиц, страдающих алкогольной зависимостью, предпочитают полному воздержанию умеренное потребление спиртного [16, 17]. Это вызвало необходимость пересмотра классических подходов к лечению алкоголизма, разработанных 30–40 лет назад, направленных на достижение полной абстиненции и предотвращение рецидивов потребления алкоголя. В качестве альтернативного подхода предложено снижение количества потребляемого этанола и, соответственно, снижение риска развития алкоголь-обусловленных заболеваний, связанной с ними смертности и других неблагоприятных последствий. Эксперты Европейского агентства по лекарственным средствам рассматривают такой подход как промежуточный этап на пути к полному воздержанию [18], а в некоторых странах, например Швейцарии и Австралии, контролируемое потребление алкоголя считается основной целью лечения [19]. Эксперты Национального института здоровья и качества медицинской помощи (NICE) Великобритании рассматривают контролируемое потребление алкоголя в качестве цели лечения для пациентов, не желающих соблюдать режим полного воздержания [2].
В 2013 г. в Европейском Союзе был зарегистрирован первый препарат – Селинкро (налмефен), позволяющий осуществлять данный терапевтический подход. Селинкро показан для снижения потребления алкоголя взрослыми пациентами с алкогольной зависимостью, которые имеют высокий уровень риска, связанного с вредным воздействием алкоголя, без физических симптомов отмены и не требующими немедленной детоксикации. [20]. Его рекомендуют применять только в сочетании с постоянной психосоциальной поддержкой, направленной на повышение приверженности лечению и снижение потребления алкоголя.
Препарат уже поступил на рынки Великобритании, Норвегии, Финляндии, Португалии и прибалтийских стран. Его регистрация в РФ ожидается в 2015 г.
Фармакологические свойства налмефена
По химической структуре и механизму действия налмефен близок к другому препарату, одобренному для лечения алкогольной зависимости, – налтрексону. Однако в отличие от последнего, являющегося относительно «чистым» антагонистом опиоидных мю- и каппа-рецепторов, налмефен оказывает антагонистическое действие в отношении мю- и дельта-рецепторов и частичное агонистическое – в отношении каппа-рецепторов [20–22].
Алкоголь стимулирует выделение эндогенных опиоидов, связывающихся с мю- и дельта-рецепторами, приводя к увеличению высвобождения в nucleus accumbens дофамина, играющего важную роль в подкрепляющем (наркогенном) эффекте психоактивных веществ [23]. Налмефен, блокируя опиоидные рецепторы, способствует снижению этого эффекта и как следствие – снижению уровня потребления алкоголя. Снижение выделения дофамина также наблюдается при стимуляции каппа-рецепторов [24, 25], Исследования in vivo позволяют считать, что налмефен снижает потребление алкоголя за счет модулирования кортико-мезолимбических функций [26].
У человека препарат медленно диссоциирует из связи с мю-рецепторами. [27]. Спустя 3 часа после введения однократной и многократных доз налмефена в дозе 20 мг здоровым добровольцам степень связи с мю-рецепторами составляла 87–100%, спустя 74 часа – 12–32% при однократном применении и 13–46% – после повторных введений. Налмефен не вызывал синдром абстиненции и, по-видимому, не обладает потенциалом вызывать зависимость [20, 28].
Таблетки налмефена хорошо растворяются в желудочно-кишечном тракте, и действующее вещество быстро всасывается. Абсолютная биодоступность при приеме внутрь составляет около 40% [20, 27]. Пиковые плазменные концентрации создаются примерно через 90 минут после приема. Степень связывания с белками плазмы низкая (около 30%). Метаболизм происходит в печени преимущественно с участием ферментов UGT2B7, UGT1A3 и UGT1A8, в связи с чем следует соблюдать осторожность при одновременном применении ингибиторов (например, диклофенака, меклофенамовой кислоты, флуконазола, медроксипрогестерона) и индукторов этих ферментов (например, дексаметазона, фенобарбитала, рифампицина, омепразола) [20]. Основной метаболит налмефен-3-O-сульфат обладает сопоставимой с налмефеном фармакологической активностью, однако в связи с тем что его концентрации составляют менее 10% концентраций налмефена, его вклад в терапевтический эффект препарата представляется невысоким [20]. Выделение неизмененного препарата и его метаболитов из организма происходит с мочой. Период полувыведения из плазмы составляет примерно 12 часов [29].
Эффективность налмефена
В эксперименте налмефен уменьшал потребление этанола крысами без алкогольной зависимости, с алкогольной зависимостью и предпочитающих алкоголь [30–34]. Результаты первого исследования налмефена на людях при применении с целью снижения потребления алкоголя были опубликованы еще в 1994 г. [35]. В этом 12-недельном двойном слепом плацебо-контролируемом рандомизированном исследовании принял участие 21 пациент с алкогольной зависимостью. Пациенты были рандомизированы в 3 группы по 7 человек в каждой – первая получала налмефен в суточной дозе 10 мг, вторая – 40 мг, третья группа получала плацебо. У пациентов, получавших активный препарат, было зарегистрировано существенное снижение числа дней потребления алкоголя и числа приемов этанола в сутки.
Во втором исследовании, проведенном тем же коллективом авторов, участвовали 105 амбулаторных пациентов с алкогольной зависимостью, находящихся в момент включения в состоянии абстиненции [36]. Участники получали налмефен в дозах 20 или 80 мг/сут или плацебо в течение 12 недель. В дополнение к лекарственной терапии пациентам проводили еженедельные сессии когнитивно-поведенческой терапии. Рецидив заболевания достоверно чаще наблюдался в группе плацебо (отношение шансов – 2,4; 95% ДИ – 1,05–5,59).
В третье исследование были включены 270 пациентов с недавно достигнутой абстиненций, рандомизированных в 1 из 4 групп, – налмефена в дозах 5, 20, 40 мг или плацебо [37]. Лекарственная терапия сочеталась с терапией, направленной на усиление мотивации. В течение 12 недель наблюдения все пациенты снизили потребление алкоголя, но достоверной разницы между четырьмя группами не было выявлено. Недостатками первых клинических исследований налмефена было небольшое число участников и короткий период наблюдения (12 недель). С учетом противоречивости их результатов было проведено большое многоцентровое двойное слепое плацебо-контролируемое исследование с участием 403 пациентов [38].

В этом исследовании в течение 28 недель пациенты принимали налмефен в дозах 10–40 мг (n=242) или плацебо (n=161) в режиме «по требованию», т.е. только в те дни, когда ощущали повышенную потребность в приеме спиртного. Спустя 28 недель 57 участников группы налмефена с благоприятным терапевтическим ответом при оценке по шкале общего клинического впечатления (CGI) были включены в 24-недельное двойное слепое исследование, где были рандомизированы в группу активного препарата или плацебо. Наряду с фармакотерапией пациентам также предлагали психосоциальное вмешательство, основанное на мотивационном интервью, сконцентрированном на нуждах пациентов и выявлении факторов, снижающих приверженность пациента лечению [39, 40]. Среднее число массивной алкоголизации в течение 12-недельного периода до включения составляло в группе налмефена 15,5 (SD 6,9) дней, в группе плацебо – 16,2 (SD 6,9); в период лечения – 8,6–9,3 и 10,6–12,0 дней соответственно (p=0,0065). У пациентов, получавших налмефен, также достоверно снизились уровни аланинаминотрансферазы (p=0,0088) и гамма-глутамилтрансферазы (p=0,0023). В течение 24-недельного продолжения исследования пациенты, рандомизированные в группу плацебо, быстро возвращались к более частому злоупотреблению алкоголем, в то время как получавшие активный препарат, оставались на уровне потребления алкоголя, достигнутом в первые 28 недель исследования. В дальнейшем эффективность налмефена в режиме «по требованию» при совместном применении с психосоциальным вмешательством, изучалась в трех исследованиях [41–43], результаты которых послужили основанием для его одобрения в Евросоюзе.
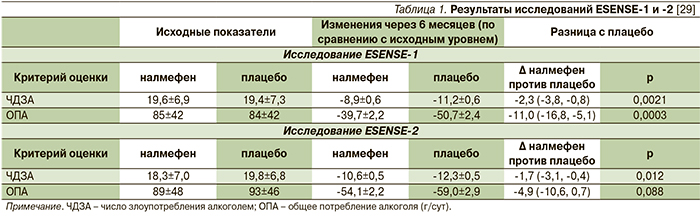
Исследования ESENSE-1 и ESENSE-2 имели сходный дизайн и проводились в европейских странах: первое – в Германии, Австрии, Финляндии и Швеции, второе – в Испании, Франции, Португалии, Италии, Бельгии, Польше и Чехии.
В ESENSE-1 участвовали 604 пациента с алкогольной зависимостью, 306 из которых получали активный препарат [41], в ESENSE-2 – 718 пациентов, 358 из которых получали налмефен [42]. Критериями включения в исследования были 6 и более дней злоупотребления алкоголем в течение 4 недель, предшествовавших скринингу; среднее потребление чистого алкоголя, превышающее 60 г в сутки у мужчин и 40 г – у женщин. Пациенты получали налмефен в дозе 18 мг в режиме «по требованию» или плацебо. За 24-недельным периодом лечения следовала 4-недельная двойная слепая фаза завершения (run-out phase), в период которой реципиенты налмефена были рандомизированы в группу налмефена или плацебо, а реципиенты плацебо продолжали получать плацебо. Первичными конечными точками было изменение через 6 месяцев числа дней злоупотребления алкоголем и общего потребления алкоголя по сравнению с исходным уровнем. Оба исследования продемонстрировали превосходство налмефена над плацебо в достижении обеих первичных точек (табл. 1).
Согласно результатам объединенного анализа обоих исследований ESENSE в течение 6 месяцев участники принимали налмефен в среднем в течение 52,8% дней, плацебо – 64,5% [44]. Достоверная разница между налмефеном и плацебо также наблюдалась при оценке по шкале CGI-S – разница в баллах составила (-) 0,4 (p=0,0004) в ESENSE-1 и (-) 0,2 (p=0,029) в ESENSE-2 [41, 42]. Число ответивших на терапию налмефеном в подгруппах пациентов с наиболее высоким риском потребления алкоголя приведено в табл. 2.
Третьим исследованием, результаты которого стали основанием для регистрации налмефена, было исследование SENSE, исходно спланированное для оценки переносимости и безопасности налмефена при применении в режиме «по требованию» в течение года [45]. Первичные точки оценки эффективности были такими же, как в исследованиях ESENSE. К 13-му месяцу обе конечные точки достоверно различались между группами сравнения в пользу активного препарата. Спустя 6 месяцев лечения достоверной разницы между группой налмефена и плацебо в целом выявлено не было, однако анализ результатов в отдельных подгруппах пациентов показал, что у лиц с высоким/очень высоким риском злоупотребления алкоголем налмефен при оценке обеих конечных точек достоверно превосходил плацебо по эффективности. Существенное превосходство налмефена над плацебо было выявлено и при оценке по шкале CGI-S.
Безопасность
В клинических исследованиях налмефен получали более 3000 пациентов. Побочные эффекты несколько чаще встречались в группе налмефена (81 и 68% в исследованиях ESENSE-1 и ESENSE-2 соответственно), чем в группе плацебо (67 и 59% соответственно) [29]. Наиболее частыми побочными эффектами были тошнота, головокружение, бессонница и головная боль. Большинство побочных эффектов носили легкий или умеренный транзиторный характер и, как правило, наблюдались в начале терапии. Частота серьезных нежелательных реакций достоверно не различалась между группами. В редких случаях отмечались спутанность сознания и еще реже – галлюцинации и другие психические симптомы. Число пациентов, выбывших из исследования вследствие нежелательных явлений, было несколько выше в группе налмефена, чем в группе плацебо (23 и 6,7% против 7 и 5,9% в исследованиях ESENSE-1 и -2 соответственно).
Согласно объединенным данным трех исследований (n=1123 в группе налмефена и 824 – в группе плацебо), связанные с лечением нежелательные явления (нежелательные реакции) наблюдались у 74,7% пациентов, получавших налмефен, и у 62,7% получавших плацебо, серьезные нежелательные реакции – у 4,4 и 5,0% соответственно [46]. Вследствие нежелательных реакций из исследований выбыли 47 (5,9%) участников в группе плацебо и 149 (13,0%) в группе налмефена. Большинство нежелательных реакций в обеих группах развивались в начале терапии и носили транзиторный характер. Безопасность и переносимость налмефена не различались при прерывистом и ежедневном режимах лечения. Налмефен не ассоциировался с повышенным риском суицидального поведения. Переносимость налмефена всеми исследователями была оценена как хорошая [29, 46, 47]. Противопоказания к применению Селинкро: гиперчувствительность к налмефену или другим компонентам препарата. Его не следует применять пациентам, принимающим опиоидные анальгетики, пациентам с опиоидной зависимостью в настоящем или недавнем прошлом, пациентам с острыми симптомами отмены опиоидов или если подозревается их недавнее применение ими. Его также не следует назначать лицам с острыми симптомами отмены алкоголя (включая галлюцинации, судороги и тремор) в недавнем анамнезе, а также больным с тяжелым нарушением функции печени или почек. Однако пациентам с легкой и умеренной дисфункцией печени или почек коррекции дозы препарата не требуется [29, 47].
Таким образом, имеющиеся доказательные данные подтверждают, что налмефен является эффективным препаратом для снижения потребления алкоголя пациентами с алкогольной зависимостью, не желающими полностью прекратить потребление этанола. Его принципиальным отличием от других препаратов, применяемых для лечения алкоголизма, является дозирование в режиме «по требованию», позволяющем принимать препарат только в ситуациях, когда потребление алкоголя представляется пациентам неизбежным. Однако для определения точного места налмефена в терапии алкогольной зависимости необходимы его дальнейшие сравнительные исследования с другими препаратами, применяемыми для лечения этой патологии, и прежде всего с налтрексоном [29].


