Ишемический инсульт (ИИ) – проблема чрезвычайной медицинской и социальной значимости вследствие высоких показателей частоты его развития, смертности и инвалидизации [1]. Новые технологии лечения ИИ включают применение высокоэффективных методов реперфузии вещества головного мозга в первые часы заболевания, направленных на восстановление кровотока в пораженном сосуде, что позволяет предотвращать развитие необратимого повреждения вещества головного мозга либо уменьшать его объем, т.е. минимизировать степень выраженности остаточного неврологического дефицита.
Внутривенный (системный) тромболизис с использованием рекомбинантного тканевого активатора плазминогена (rt-PA) служит наиболее эффективным методом терапии ИИ в первые 4,5 часа от начала развития симптоматики в соответствии с рекомендациями Европейской инсультной организации (ESO) и Американской Ассоциации сердца и инсультной ассоциации (AHA/ASA – American Heart Association/American Stroke Association) (класс доказательности 1, уровень А) [2, 3]. Эффективность и безопасность rt-PA при инсульте показаны в ряде крупных многоцентровых рандомизированных плацебо-контролируемых клинических исследований (NINDS, ECASS 1, 2, 3, ATLANTIS A, В) [4–8].
С учетом наибольшей эффективности тромболитической терапии (ТЛТ) по сравнению с другими методами лечения в острейшем периоде инсульта, а также исходя из фармакоэкономических данных [9, 10], в настоящее время значительные усилия прилагаются к увеличению числа пациентов, в отношении которых может использоваться тот или иной метод реперфузии [11].
В Российской Федерации (РФ) методы системного и селективного внутриартериального тромболизиса впервые были внедрены в клинике НИИ цереброваскулярной патологии и инсульта ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России в 2005–2006 гг. [12, 13], однако до 2008–2009 гг. тромболизис применялся только в отдельных центрах – преимущественно в университетских или академических клиниках [14, 15]. В соответствии с постановлениями Правительства РФ с 2008 г. в нашей стране была начата реализация мероприятий, направленных на совершенствование медицинской помощи больным сосудистыми заболеваниями. В составе региональных сосудистых центров и первичных сосудистых отделений созданы подразделения для лечения пациентов с острыми нарушениями мозгового кровообращения (ОНМК), в которых внедряются современные методы диагностики, лечения, реабилитации и вторичной профилактики инсульта, в т.ч. реперфузионная терапия [16].

По данным федерального госпитального регистра стационарного больного ОНМК, в процессе реализации программы совершенствования медицинской помощи сосудистым больным наблюдалось существенное увеличение абсолютного числа процедур системной ТЛТ (453 процедуры в 2009 г., 5515 – в 2014 г., см. рисунок). Таким образом, в течение последних 6 лет возникла отчетливая положительная тенденция к увеличению числа больных, которым был выполнен системный тромболизис (более чем в 10 раз). Частота процедур системной ТЛТ, по данным за 2014 г., составила 1,9% от всего числа пациентов с ИИ. Данный показатель существенно меньше аналогичного в развитых западных странах, где частота выполнения процедур реперфузии может достигать 5–10% [17, 18]. Необходимо отметить, что достижение аналогичного (2–3%) показателя, например, в США заняло около 10 лет (с момента одобрения rt-PA в качестве метода рутинной терапии в 1996 г.) [19], при этом ТЛТ внедрялась в действующих инсультных центрах, тогда как в РФ в достаточно сжатые сроки (2008–2012) была реализована программа по созданию центров, их оборудованию, обучению специалистов и внедрению современных методов диагностики и лечения, в т.ч. и тромболизиса.
При анализе эффективности и безопасности ТЛТ при помощи метода регрессионного анализа (табл. 1) выявлено, что с летальным исходом были ассоциированы такие факторы, как возраст (отношение шансов [ОШ]=1,029, 95% доверительный интервал [ДИ] –1,002–1,056), уровень систолического артериального давления (АД) при поступлении (ОШ=1,009, 95% ДИ – 1,001–1,016), выраженность неврологического дефицита по шкале NIHS – National Institutes of Health Stroke Scale (ОШ=1,121, 95% ДИ – 1,062–1,184).
На вероятность благоприятного функционального восстановления оказывали влияние такие факторы, как уровень диастолического АД при поступлении (ОШ=1,012, 95% ДИ – 1,001–1,023), тяжесть инсульта по шкале NIHS (ОШ=1,117, 95% ДИ – 1,07–1,166). При анализе вероятности возникновения геморрагической трансформации очага поражения головного мозга (как симптомной, так и асимптомной) было выявлено, что на ее развитие оказывали влияние такие факторы, как наличие ранних компьютерно-томографических (КТ)-признаков инфаркта головного мозга (ОШ=2,057, 95% ДИ – 1,206–3,509), возраст (ОШ=1,034, 95% ДИ – 1,012–1,057), а также выраженность неврологического дефицита по NIHSS (ОШ=1,097, 95% ДИ – 1,049–1,147). Таким образом, выраженность клинической симптоматики по шкале NIHS оказывала значимое влияние на все анализируемые исходы, что еще раз подчеркивает необходимость тщательного обследования и отбора пациентов для ТЛТ.
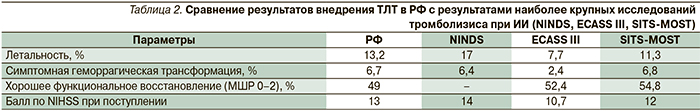
В целом результаты безопасности и эффективности внедрения метода ТЛТ в РФ были сопоставимыми с результатами наиболее крупных исследований и регистра SITS-MOST (табл. 2).

Более высокие показатели симптомной геморрагической трансформации и летальности по сравнению с ECASS III и SITS-MOST, вероятно, связаны с исходно более тяжелым неврологическим дефицитом по шкале инсульта NIHS при поступлении (13 баллов против 10,7 и 12,0 соответственно).
Следует отметить, что, по данным госпитального регистра, в нашей стране только около 18% пациентов с ИИ госпитализируются в период терапевтического окна. Частота выполнения ТЛТ у больных, поступивших за первые 4,5 часа от начала инсульта, составляет 7–8%, что существенно меньше ожидаемой потребности в реперфузионной терапии. Как свидетельствует опыт ведущих клиник, выполнение системной ТЛТ возможно для 40–50% всех пациентов, госпитализированных в период терапевтического окна [19–22] (соответственно 50–60% приходится на долю пациентов с геморрагическим инсультом и другими противопоказаниями к тромболизису или с другими заболеваниями, имитирующими инсульт).
Таким образом, в инсультных отделениях РФ имеется существенный потенциал к увеличению частоты выполнения процедур системной ТЛТ. Прогнозируемое число больных, которым должен проводиться тромболизис (исходя из ежегодного количества 450 тыс. случаев ОНМК и с учетом поступления в первые часы 18% пациентов с ИИ), может составить около 20 тыс. в год.
Можно выделить ряд факторов, препятствующих дальнейшему росту удельного веса процедур реперфузии у больных ИИ: поздняя обращаемость за медицинской помощью по поводу ОНМК в связи с низкой медицинской грамотностью населения, различные задержки и проблемы на догоспитальном этапе, недостаточная организация при поступлении больных в стационар (прежде всего задержки в выполнении различных диагностических процедур), в ряде случаев – недостаточная мотивация медицинского персонала к выполнению ТЛТ.
Краеугольным камнем внедрения новых высокоэффективных технологий лечения инсульта является максимально раннее поступление больных в специализированные отделения для лечения больных ОНМК. В связи с этим особое значение имеют проведение образовательных кампаний для населения с целью повышения информированности о признаках ОНМК, минимизация задержек при транспортировке на догоспитальном этапе, сокращение времени обследования больного и правильная маршрутизация потоков поступающих больных внутри стационара.
Промежуток времени от возникновения первых симптомов ОНМК до обращения за медицинской помощью служит одним из наиболее значимых факторов задержек на догоспитальном этапе [23–25]. С целью максимального охвата населения следует использовать ресурсы, имеющие наибольший информационный охват, такие как средства массовой информации, в частности, как это было показано в исследовании C. Hodgson и соавт. [26]. Авторы оценивали эффективность влияния средств масс-медиа, в частности телевизионных информационных роликов, на осведомленность населения старше 45 лет о симптомах инсульта, частоте госпитализации больных в первые 2,5 и 5,0 часов от начала развития заболевания, а также на количество поступлений с диагнозом транзиторной ишемической атаки (ТИА). Результаты исследования убедительно показали, что информирование населения подобным образом является эффективным мероприятием, способствующим повышению обращаемости за медицинской помощью (увеличение для общей обращаемости на 9%, 15% увеличения поступлений в течение 5 часов и 5% поступлений в течение 2,5 часа от начала заболевания, для ТИА – на 30%).
Кроме низкой информированности населения о признаках ОНМК, негативно влияющей на раннюю госпитализацию больных инсультом, существует множество факторов, связанных с организацией работы службы скорой медицинской помощи (СМП), также приводящих к более поздней госпитализации.
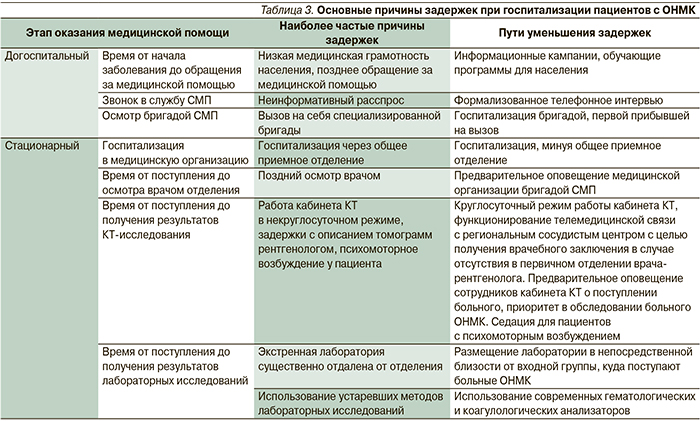
В РФ подавляющее большинство пациентов с ОНМК в первую очередь обращаются за медицинской помощью в службу СМП и, соответственно, ею и госпитализируются. До последнего времени имелись существенные региональные различия по ряду показателей, таких как частота госпитализации, точность диагностики ОНМК и время транспортировки больных в стационар. По данным регистра инсульта, проведенного Национальной ассоциацией по борьбе с инсультом в конце 1990-х – начале 2000-х гг., частота госпитализации варьировалась от 38,5 до 81,1% в различных городах [27]. Внедрение программы совершенствования медицинской помощи позволило значительно уменьшить временные затраты при обслуживании вызова бригадами СМП, сократить время от начала заболевания до обращения за медицинской помощью, а также время от вызова бригады до первого контакта с больным. Кроме того, значительно увеличилось число больных, госпитализированных в первые часы заболевания [28, 29]. Тем не менее и в настоящее время можно выделить ряд факторов, существенно ограничивающих быструю госпитализацию пациентов в специализированные отделения (табл. 3).
Прежде всего это связано с неиспользованием формализованных алгоритмов телефонного опроса диспетчером СМП, недостаточным качеством диагностики ОНМК бригадой СМП, отсутствием информирования стационара о поступлении больного, госпитализацией пациента через общий приемный покой, стремлением бригады СМП выполнить весь стандарт лечения больного с ожиданием эффекта от лечения, что особенно критично для больных в период терапевтического окна, вызовом на себя специализированной бригады. В некоторых случаях, особенно на удаленных территориях в условиях фельдшерской бригады, практикуется транспортировка пациента в ближайшую медицинскую организацию, где отсутствует специализированное инсультное отделение, для подтверждения диагноза ОНМК врачом и в случае подтверждения такового – госпитализация уже в первичное или региональное сосудистое отделение. Совокупность данных факторов может приводить к значительным задержкам в госпитализации в специализированное отделение и как следствие – к уменьшению частоты выполнения процедур ТЛТ.
В соответствии с рекомендациями AHA/ASA показатель времени «от двери до иглы» (от поступления до начала ТЛТ) не должен превышать 60 минут (в идеале – чем меньше, тем лучше) [3]. Данный показатель является интегративным и в целом отражает качество организации помощи при госпитализации пациентов в конкретной медицинской организации.
К основным факторам, влияющим на показатель «от двери до иглы» относятся время от поступления до осмотра врачом-неврологом, время выполнения и получения результатов нейровизуализации, время выполнения необходимых лабораторных показателей, время от поступления до перевода в блок интенсивной терапии и реанимации после КТ-исследования в соответствии с Порядком оказания медицинской помощи больным ОНМК (приказ МЗ РФ от 25.11.2012 № 928н, табл. 3).
Перечисленные факторы служат временными индикаторами качества медицинской помощи [29]. С точки зрения процессуальных индикаторов качества (выполнение необходимых диагностических, лечебных и других вмешательств) можно выделить следующие, критично влияющие на безопасность и эффективность ТЛТ: ошибки в определении противопоказаний к реперфузии, несоблюдение протокола проведения тромболизиса и последующего мониторинга состояния больного.
Как показал анализ более чем 200 историй болезни из инсультных отделений различных регионов, при определении противопоказаний к ТЛТ наиболее часто встречаются следующие ошибки: некорректное использование шкалы инсульта NIHS, являющейся общепризнанным инструментом определения степени тяжести больного ОНМК [3] (например, оценка двигательного дефицита только в паретичных конечностях, неправильная оценка дизартрии, афазии, чувствительных нарушений и т.д.), недооценка ранних КТ-признаков ишемического поражения головного мозга (наиболее критично игнорирование гипотензивности более трети размера бассейна средней мозговой артерии), неполный сбор анамнеза. Подобные нарушения протокола приводят к выполнению ТЛТ пациентам с тяжелым инсультом (в т.ч. в сопоре и в коме), которым реперфузия уже противопоказана, зачастую – с осложнениями или без существенного эффекта. Все это не может не приводить к увеличению летальности, способствует разочарованию специалистов в методике. В ряде случаев в историях болезни отсутствуют результаты лабораторных исследований, необходимых для выполнения ТЛТ; например, данные о количестве тромбоцитов (наиболее критичного показателя) отсутствовали в 20% проанализированных историй болезни.
Среди отклонений от протокола выполнения процедуры ТЛТ и последующего мониторинга в течение последующих 24 часов следует отметить следующие: отсутствие или недостаточный мониторинг витальных показателей (АД, частоты сердечных сокращения и др.) в 17% случаев, невыполнение повторного КТ или МРТ-исследования в конце первых суток заболевания – в 23%, назначение антиагрегантов или антикоагулянтов в 10% случаев, что существенно увеличивает риск геморрагических осложнений [3]. Несоблюдение или недостаточное выполнение временны́х и процессуальных индикаторов может сказываться на показателях индикаторов качества медицинской помощи по исходу заболевания – уровню летальности и степени функционального восстановления.
Таким образом, за последние годы реперфузионная терапия в нашей стране стала частью рутинной клинической практики и не является прерогативой ограниченного числа крупных научных центров, результаты внедрения ТЛТ в отношении безопасности и эффективности сопоставимы с зарубежными данными. С учетом имеющегося потенциала созданных инсультных отделений, работающих по единым порядкам и стандартам оказания медицинской помощи, представляется абсолютно реальным и необходимым увеличение числа процедур ТЛТ посредством проведения активных информационных кампаний среди населения с целью максимально ранней госпитализации пациентов с ОНМК в специализированные отделения, а также дальнейшее организационное совершенствование системы оказания медицинской помощи пациентам с инсультом на всех этапах ее оказания.



