Введение
Внебольничная пневмония (ВП) – широко распространенное заболевание, занимающее ведущее место в структуре заболеваемости и смертности от инфекционных болезней среди взрослых в развитых странах. Следует отметить, что наибольшую проблему для врачей представляют пациенты с тяжелой ВП (ТВП), т.к., несмотря на доступные методы диагностики и лечения, в т.ч. современные антимикробные препараты (АМП), летальность среди данной категории больных остается высокой, а лечение сложным и дорогостоящим.
Анализ практики лечения госпитализированных пациентов с ВП в различных регионах РФ в 2005–2006 гг. показал, что наиболее серьезные проблемы с выбором АМП и качеством этиологической диагностики отмечались у пациентов с тяжелым течением заболевания: соответствие стартового режима антибактериальной терапии (АБТ) национальным рекомендациям отмечено лишь в 15% случаев, только 44% пациентов получали комбинированную АБТ, из них 72% комбинаций оказались нерациональными; бактериологическое исследование крови выполнено 8% пациентов, а мокрота исследована в 35% наблюдений, причем в большинстве случаев клинический материал собирался после начала АБТ, что существенно снижало информативность данного метода исследования.
Эпидемиология
Согласно данным официальной статистики РФ (Центральный научно-исследовательский институт организации и информатизации здравоохранения Минздрава РФ), в 2012 г. в РФ было зарегистрировано 657 643 случая заболевания ВП, что составило 4,59‰; у лиц в возрасте ≥18 лет заболеваемость составила 3,74‰. Однако эти цифры не отражают истинной заболеваемости ВП в РФ, которая, согласно расчетам, достигает 14–15‰, а общее число больных ежегодно превышает 1,5 млн человек.
В США ежегодно регистрируется 5–6 млн случаев ВП, из них около 1 млн человек требуют госпитализации в стационар. По приблизительным подсчетам, на каждые 100 случаев ВП около 20 больных нуждаются в стационарном лечении, из них 10–36% – в условиях отделений реанимации и интенсивной терапии (ОРИТ). Среди госпитализированных в Европе и США доля пациентов с ТВП составляет от 6,6 до 16,7%.
Несмотря на успехи, достигнутые в АБТ, респираторной поддержке и терапии сепсиса, летальность среди больных ТВП составляет от 21 до 58%.
Основными причинами их смерти служат рефрактерная гипоксемия, септический шок и полиорганная недостаточность. В проспективных исследованиях главными факторами, ассоциированными с неблагоприятным прогнозом больных ТВП, стали возраст >70 лет, проведение искусственной вентиляции легких (ИВЛ), двусторонняя локализация пневмонии, сепсис и инфицирование Pseudomonas aeruginosa.

Определение
Под ВП следует понимать острое заболевание, возникшее во внебольничных условиях (т.е. вне стационара или спустя более 4 недель после выписки из него, или диагностированное в первые 48 часов от момента госпитализации), которое сопровождается симптомами инфекции нижних отделов дыхательных путей (лихорадка, кашель, выделение мокроты, возможно гнойной, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы.
ТВП – это пневмония, характеризующаяся выраженной дыхательной недостаточностью (ДН) и/или признаками сепсиса и полиорганной дисфункции. С клинической точки зрения, понятие ТВП носит контекстуальный характер, поэтому не существует ее единого определения.
ВП может рассматриваться как тяжелая в следующих случаях:
- высокий риск летального исхода;
- необходимость госпитализации больного в ОРИТ;
- декомпенсация (или ее высокая вероятность) сопутствующей патологии;
- неблагоприятный социальный статус больного.
Оценка риска летального исхода
ТВП чаще всего ассоциируется с крайне неблагоприятным прогнозом. Высокие показатели летальности и серьезный прогноз объединяют ТВП с таким актуальным заболеванием, требующим оказания интенсивной помощи, как острый инфаркт миокарда.
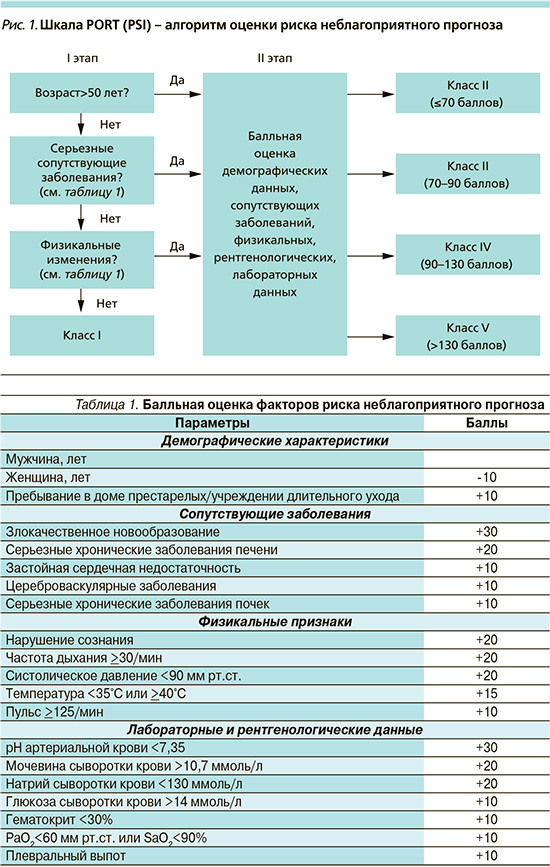
Для оценки риска неблагоприятного исхода при ВП могут использоваться разнообразные критерии и шкалы, из которых наиболее распространенными в настоящее время считаются индекс тяжести пневмонии (PSI – Pneumonia Severity Index), или шкала PORT (Pneumonia Outcomes Research Team) (рис. 1, табл. 1, 2), а также шкалы CURB/CRB-65 (рис. 2) и SMART-COP (рис. 3, табл. 3–5).
К сожалению, эти и ряд других шкал не свободны от контраргументов, поскольку не учитывают социальных факторов, ряд значимых сопутствующих заболеваний, в т.ч. декомпенсацию или обострение последних, «гиперболизируют» возраст пациентов в отсутствие других факторов риска неблагоприятного исхода либо, напротив, недооценивают прогноз для лиц молодого возраста и т.д.

Необходимость госпитализации в ОРИТ
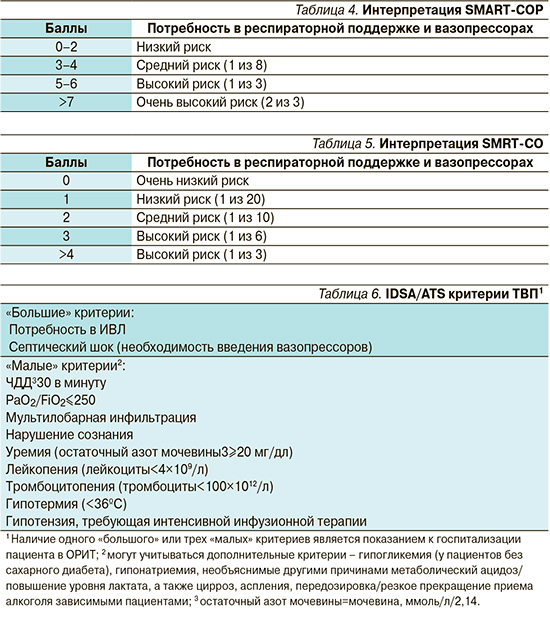
Наиболее эффективным инструментом для выработки показаний к направлению в ОРИТ являются рекомендации Американского торакального общества и Американского общества инфекционных болезней (IDSA/ATS) – табл. 6.
Этиология
Описано более ста микроорганизмов (бактерии, вирусы, грибы, простейшие), которые при определенных условиях могут стать возбудителями ВП. Однако большинство случаев заболевания ассоциируется с относительно небольшим кругом патогенов. К числу наиболее актуальных «типичных» бактериальных возбудителей ТВП относятся Streptococcus pneumoniae, энтеробактерии – Klebsiella pneumoniae и др., Staphylococcus aureus, Haemophilus influenzae.
У некоторых категорий пациентов (недавний прием системных АМП, длительная терапия системными глюкокортикостероидами – ГКС в фармакодинамических дозах, муковисцидоз, бронхоэктазы) в этиологии ТВП существенно возрастает актуальность P. aeruginosa.
Среди «атипичных» возбудителей при тяжелом течении ВП наиболее часто выявляется Legionella pneumophila, меньшую актуальность представляют Mycoplasma pneumoniae и Chlamydophila pneumoniae.
Значимость анаэробов, колонизующих полость рта и верхние дыхательные пути, в этиологии ТВП до настоящего времени окончательно не определена, что в первую очередь обусловлено ограничениями традиционных культуральных методов исследования респираторных образцов. Вероятность инфицирования анаэробами может возрастать среди лиц с доказанной или предполагаемой аспирацией, обусловленной эпизодами нарушения сознания при судорогах, некоторых неврологических заболеваниях (например, инсульт), дисфагии, заболеваниях, сопровождающихся нарушением моторики пищевода.
ТВП могут вызывать респираторные вирусы, наиболее часто вирусы гриппа, коронавирусы, риносинцитиальный вирус (РС-вирус), метапневмовирус человека, бокавирус человека.
Рост актуальности вирусной пневмонии за последние годы обусловлен появлением и распространением в популяции пандемического вируса гриппа A/H1N1pdm2009, способного вызывать первичное поражение легочной ткани и развитие быстропрогрессирующей ДН.
Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного поражения легких, характеризуется быстропрогрессирующим течением с развитием выраженной ДН) и вторичную бактериальную пневмонию, которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением гриппа. Наиболее частыми возбудителями вторичной бактериальной пневмонии у пациентов с гриппом являются S. aureus и S. pneumoniae. Частота выявления респираторных вирусов у пациентов с ВП носит выраженный сезонный характер и возрастает в холодное время года.
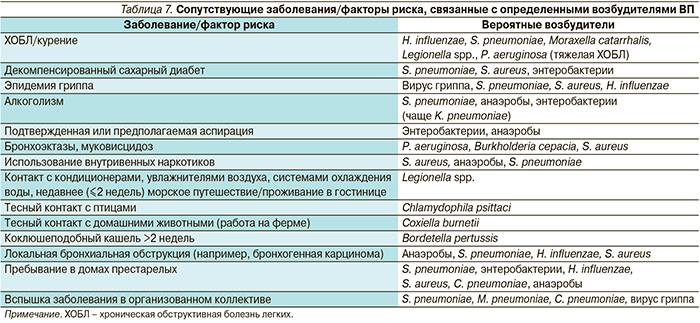
Необходимо отметить, что частота встречаемости различных возбудителей ТВП может существенно варьироваться в зависимости от географической локализации, сезона и профиля пациентов. Кроме того, вероятность инфицирования тем или иным возбудителем определяется наличием соответствующих факторов риска (табл. 7), а также методов исследования, использовавшихся для микробиологической диагностики.
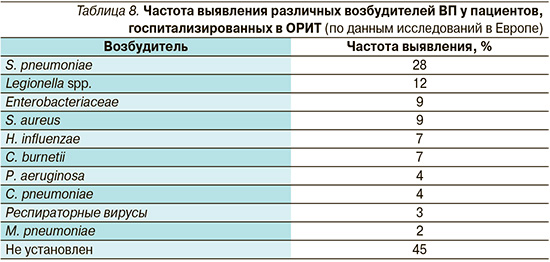
Частота выявления различных возбудителей ВП среди пациентов, госпитализированных в ОРИТ, по результатам исследований в странах Европы представлена в табл. 8.
Российские данные по этиологии ТВП остаются немногочисленными. Однако в целом они подтверждают закономерности, выявленные в зарубежных исследованиях.
Необходимо отметить тот факт, что, несмотря на расширение возможностей микробиологической диагностики, примерно у половины пациентов с ТВП этиологический диагноз остается неустановленным.
Резистентность возбудителей к АМП
С точки зрения выбора режимов эмпирической антимикробной терапии (АМТ) при ТВП наибольшее клиническое значение представляет локальный мониторинг антибиотикорезистентности S. pneumoniae и H. influenzae.
Данные мониторинга чувствительности клинических штаммов S. pneumoniae в РФ, выделенные у пациентов с внебольничными респираторными инфекциями в рамках многоцентровых исследований ЦЕРЕБРУС, представлены в табл. 9.
Как показывает многоцентровое исследование Церебрус, уровень устойчивости пневмококков к пенициллину и аминопенициллинам в РФ остается низким (2,0 и 1,4% нечувствительных изолятов соответственно). Частота выявления S. pneumoniae, резистентных к цефтриаксону составляет 1,8%, а доля умеренно резистентных – 0,9%. Все пневмококки, включая пенициллинрезистентные (ПРП), сохраняли чувствительность к цефтаролину, который проявлял наиболее высокую активность в отношении данного возбудителя in vitro.
Резистентность S. pneumoniae к эритромицину составила 8,4%; большинство макролидрезистентных S. pneumoniae демонстрировали устойчивость к клиндамицину, что может свидетельствовать о преобладании в РФ MLSB-фенотипа резистентности, обусловленного модификацией мишени и определяющего устойчивость S. pneumoniae ко всем макролидам, включая 16-членные, и существенное повышение значений МПК (минимальная подавляющая концентрация).
Высокую активность в отношении S. pneumoniae проявляли линезолид, респираторные фторхинолоны.
Уровень устойчивости пневмококков к тетрациклину, несмотря на существенное сокращение использования данной группы АМП в РФ за последние годы, остается высоким (33,1% нечувствительных изолятов).
Высокую активность в отношении H. influenzae сохраняют цефалоспорины III поколения; не выявлено изолятов, устойчивых к фторхинолонам. Наиболее высокий уровень резистентности H. influenzae зарегистрирован к ко-тримоксазолу (32,8% нечувствительных изолятов).
Несмотря на общие тенденции, профиль устойчивости респираторных возбудителей может различаться в отдельных регионах, поэтому при выборе препаратов наиболее целесо-образно руководствоваться локальными данными резистентности микроорганизмов к АМП. Кроме того, необходимо учитывать индивидуальные факторы риска выявления антибиотикорезистентных возбудителей.
Факторами риска выявления ПРП являются возраст старше 65 лет, недавняя (<3 месяцев) терапия β-лактамными АМП, серьезные хронические сопутствующие заболевания, алкоголизм, иммунодецифит или иммуносупрессивная терапия, тесный контакт с детьми, посещающими дошкольные учреждения. Частота встречаемости ПРП увеличивается при недавнем использовании макролидов и ко-тримоксазола.
Вероятность инфицирования макролидрезистентными S. pneumoniae возрастает у пожилых пациентов, при применении данной группы АМП в ближайшие 3 месяца, недавнем использовании пенициллинов или ко-тримоксазола, ВИЧ-инфекции, тесном контакте с лицами, колонизированными резистентными изолятами.
Ключевым фактором риска выявления резистентных к фторхинолонам S. pneumoniae является неоднократное использование фторхинолонов в анамнезе.

Потенциальной проблемой, способной оказать влияние на стратегию эмпирической АБТ ТВП, является распространение во внебольничных условиях метициллино-резистентных S. aureus (MRSA – Methicillin-resistant Staphylococcus aureus). Для некоторых стран актуальность представляют т.н. внебольничные MRSA (CA-MRSA – Community-Associated Methicillin-Resistant Staphylococcus aureus), обусловливающие развитие тяжелой некротизирующей пневмонии, серьезных осложнений (пневмоторакс, абсцессы, эмпиема плевры, лейкопения и др.) и высокую летальность. CA-MRSA устойчивы к β-лактамным АМП, но, как правило, сохраняют чувствительность к другим классам АМП (линкозамиды, фторхинолоны, ко-тримоксазол).
Распространенность MRSA среди взрослых с ТВП в РФ, по-видимому, невелика, хотя этот вопрос требует дополнительного изучения.
Еще одна потенциальная угроза обусловлена возможным распространением во внебольничных условиях среди представителей семейства Enterobacteriaceae изолятов, вырабатывающих β-лактамазы расширенного спектра (БЛРС), что определяет их нечувствительность к цефалоспоринам III–IV поколений, а также рост устойчивости энтеробактерий к ингибиторзащищенным аминопенициллинам и фторхинолонам, которые являются препаратами первого ряда для эмпирической терапии ТВП. Такая тенденция в РФ прослеживается в отношении возбудителей внебольничных инфекций мочевыводящих путей, но пока не исследована у пациентов с ВП.
Диагностика
Клиническая диагностика
С учетом быстрого прогрессирования заболевания и неблагоприятного прогноза необходимо в кратчайшие сроки с момента подозрения на наличие ТВП предпринимать усилия, направленные на подтверждение/исключение диагноза.
Диагностика ТВП включает:
- cбор эпидемиологического анамнеза;
- идентификацию пневмонии;
- выявление сепсиса и полиорганной недостаточности;
- выявление острой ДН;
- оценку сопутствующей патологии (исключение обострения или декомпенсации сопутствующих заболеваний).
ТВП манифестирует респираторными симптомами, включающими лихорадку, острый кашель (с мокротой или без нее), одышку и боль в грудной клетке. Важные симптомы, указывающие на необходимость срочного оказания интенсивной терапии, могут быть обусловлены системными проявлениями сепсиса, ДН либо признаками обострения/декомпенсации хронических сопутствующих заболеваний.

Необходимо иметь в виду, что как минимум 30% больных ТВП до поступления в стационар начинают прием АМП. Это приводит к изменению классической картины заболевания и возможному появлению симптомов, связанных с нежелательными лекарственными реакциями.
Большинство исследований указывает на то, что отсутствие «находок» при аускультации (локально выслушиваемое бронхиальное дыхание, фокус мелкопузырчатых хрипов или крепитации) существенно снижает вероятность пневмонии как основного диагноза.
В то же время результаты исследований, включившие анализ большой базы данных пациентов с ТВП, приводят к заключению об отсутствии симптомов и их комбинаций, а также анамнестических сведений, которые позволяют как безошибочно устанавливать диагноз ВП, так и, наоборот, исключать его. Однако указанные ограничения не исключают ценности тщательно собранного анамнеза, жалоб и полноценного осмотра больного. Помимо помощи в установлении диагноза это может быть полезным с точки зрения уточнения этиологии ТВП.
Выявление сепсиса и полиорганной недостаточности
Сепсис – патологический процесс, осложняющий течение пневмонии, основным содержанием которого является неконтролируемый выброс эндогенных медиаторов с последующим развитием воспаления и органно-системных повреждений на удалении от первичного очага.
Определение синдрома системного воспалительного ответа (ССВО) и классификация сепсиса, предложенная в 1992 г. Международной согласительной конференцией ACCP/SCCM, представлена в табл. 10.
Необходимо отметить, что сепсис, тяжелый сепсис и септический шок не являются отдельными патологическими состояниями, а представляют стадии развития одного процесса. Летальность при сепсисе составляет 10–36%, при тяжелом сепсисе – 18–52%, при септическом шоке – 46–82%.
Бактериемия служит одним из возможных, но необязательных проявлений сепсиса. Диссеминация микроорганизма может отсутствовать или быть кратковременной. Однако этот кратковременный контакт способен запустить выброс провоспалительных цитокинов на удалении от очага инфекции.

Для оценки сепсис-ассоцииро-ванной органной недостаточности целесообразно использовать шкалу SOFA (Sepsis-related organ failure assessment), которая позволяет определять в количественном выражении тяжесть органно-системной дисфункции; нулевое значение по шкале SOFA указывает на ее отсутствие (табл. 11).
Выявление острой ДН
ДН – состояние человека, при котором в условиях покоя при дыхании воздухом парциальное напряжение кислорода в артериальной крови (РаО2) становится меньше 60 мм рт.ст. или парциальное напряжение углекислого газа (РаСО2) превышает 45 мм рт.ст.
При ТВП развивается гипоксемическая (паренхиматозная) ДН. Она может появиться в течение нескольких часов, и за это время не успевают включиться компенсаторные механизмы со стороны системы дыхания, кровообращения, кислотно-основного состояния крови.
Острая ДН характеризуется глубокой гипоксемией, труднокорригируемой кислородотерапией, респираторным алкалозом. Признаками гипоксемической острой ДН являются диспноэ, тахипноэ, рентгенологические признаки массивной альвеолярной инфильтрации, крепитация.
Гиперкапния появляется при дальнейшем прогрессировании патологического процесса, например при развитии утомления дыхательных мышц или массивного плеврита.
Клинические признаки прогрессирующей ДН:
- нарушение дыхания (одышка, постепенное уменьшение объема дыхания);
- нарастающая неврологическая симптоматика (безразличие, агрессивность, возбуждение, заторможенность, кома);
- сердечно-сосудистые нарушения (тахикардия, стойкое повышение АД при гиперкапнии, декомпенсация сердечной деятельности).
Рентгенологическая диагностика
Лучевое исследование больных ТВП должно начинаться с обзорной рентгенографии органов грудной полости в передней прямой и боковой проекциях. У 2–5% больных ВП рентгенологическая картина нетипична или клинические проявления, сходные с пневмонией, обусловлены другим патологическим процессом. В этих случаях рентгенографическое исследование может быть дополнено рядом специальных методик, среди которых наибольшее клиническое значение имеет компьютерная томография (КТ).

Показания к КТ легких при предполагаемой ТВП:
- У пациента с очевидной клинической симптоматикой пневмонии изменения в легких на рентгеновских снимках отсутствуют.
- Нетипичные для ВП изменения на рентгенограммах – любые сомнения в правильности такой трактовки являются веским аргументом в пользу проведения КТ.
- Рецидивирующая или затяжная пневмония, при которой длительность существования инфильтративных изменений в легочной ткани превышает один месяц. В обоих случаях причиной повторного возникновения или длительного сохранения изменений в легочной ткани может быть стеноз крупного бронха, обусловленный в т.ч. и злокачественным новообразованием.
- Ультразвуковое исследование больных ТВП применяется для оценки состояния плевры и плевральной полости при развитии парапневмонических экссудативных плевритов. Другие методы лучевого исследования, в частности радионуклидное, магнитно-резонансная томография, ангиография, не имеют практического значения в диагностике пневмонии.
Обратное развитие воспалительного процесса связано со снижением интенсивности тени инфильтрации вплоть до полного ее исчезновения. Длительность обратного развития пневмонии может различаться в широких пределах, но обычно составляет 3–4 недели. Контрольное рентгенологическое и КТ-исследования в эти сроки позволяют выявлятьть нормальную картину или остаточные изменения в легких в виде локальных участков уплотнения легочной ткани или деформации легочного рисунка в отсутствие клинических симптомов заболевания. Длительность сохранения остаточных изменений не влияет на продолжительность АБТ.
Этиологическая диагностика
Всем пациентам с ТВП рекомендуется проводить культуральное исследование крови, бактериоскопию и бактериологическое исследование респираторного образца (мокрота, трахеальный аспират, образцы, получаемые при бронхоскопии) и экспресс-тесты по выявлению пневмококковой и легионеллезной антигенурии. Так, для экспресс-диагностики ВП, вызванной S. рneumoniae, наибольшее распространение в РФ получил иммунохроматографический тест, предусматривающий выявление пневмококкового клеточного полисахарида (С-полисахарида) в моче. Данный экспресс-тест демонстрирует приемлемую чувствительность (50–80%) и достаточно высокую специфичность (>90%) при ВП у взрослых по сравнению с культуральными методами. Его использование рекомендуется всем пациентам с ТВП, особенно при невозможности получения качественного респираторного образца и обследовании пациентов, получавших системную АБТ.
Для некультуральной диагностики ВП, вызванной L. pneumophila серогруппы I, разработаны иммунохроматографический тест и тест на основе иммуноферментного анализа. Чувствительность иммунохроматографического теста для выявления L. pneumophila у пациентов с ВП составляет 70–95% (выше – при тяжелом течении заболевания), специфичность достигает 95%.
Использование теста на легионеллезную антигенурию рекомендуется всем пациентам с ТВП. Отрицательный тест не исключает окончательного диагноза легионеллезной пневмонии, т.к. он не валидирован для выявления L. pneumophila других серогрупп и легионелл других видов. Однако, по данным эпидемиологических исследований, на долю L. pneumophila серогруппы I приходится не менее 80% случаев внебольничного легионеллеза.
Пневмококковый и легионеллезный иммунохроматографические экспресс-тесты остаются положительными в течение нескольких недель после перенесенного эпизода ВП, поэтому они имеют диагностическую ценность только при наличии клинических проявлений заболевания.
По показаниям может проводиться бактериологическое исследование других клинических образцов (например, плевральной жидкости) и использоваться другие методы исследования – иммуносерологические, полимеразная цепная реакция (ПЦР), направленные на выявление и идентификацию респираторных вирусов, «атипичных» и редко встречающихся «типичных» бактериальных возбудителей.
Рутинное использование методов этиологической диагностики «атипичных» бактериальных возбудителей при ТВП, за исключением экспресс-теста на легионеллезную антигенурию, не рекомендуется.
С точки зрения выбора режима АМП, наибольшее клиническое значение при ТВП имеет ранняя диагностика вирусов гриппа, основным методом идентификации которых в настоящее время является ПЦР и ее модификации. Существующие тест-системы позволяют выявлять вирусы гриппа А и В, дают возможность определения субтипа вирусов гриппа А, например пандемического варианта A/H1N1pdm2009 и высокопатогенного вируса гриппа птиц А/H5N.
Обследование на грипп должно проводиться всем пациентам с ТВП во время эпидемии гриппа в регионе либо при наличии клинических или эпидемиологических данных, свидетельствующих о возможном инфицировании.
В качестве клинического материала при подозрении на грипп предпочтительнее использовать мокроту или инвазивные респираторные образцы (бронхоальвеолярный лаваж, трахеальный аспират), при невозможности их получения – мазки из носоглотки и задней стенки глотки; наибольшей чувствительности удается добиться при комбинации мазков из обоих локусов.
За последние годы появились экспресс-тесты для выявления антигенов гриппа А и Б в респираторных образцах, основанные на иммуноферментном анализе или иммунохроматографическом методе.
Выбор режимов эмпирической АБТ
При ТВП назначение антибиотиков должно быть неотложным; отсрочка c началом АБТ на 4 часа и более существенно ухудшает прогноз. В случае развития септического шока это время целесообразно сократить до 1 часа. Стартовая АБТ ТВП предполагает внутривенное введение АМП, т.к. данный путь доставки обеспечивает наиболее высокую и предсказуемую биодоступность, не зависящую от полноты и скорости всасывания препаратов в желудочно-кишечном тракте (ЖКТ).
В дальнейшем по мере клинической стабилизации возможет перевод пациента на пероральный прием АМП в рамках концепции ступенчатой терапии.
Выбор режима эмпирической АМТ ТВП зависит от наличия факторов риска инфицирования P. aeruginosa, предполагаемой/документированной аспирации, клинических и/или эпидемиологических данных, свидетельствующих об инфицировании вирусами гриппа.
У пациентов без факторов риска эмпирическая АБТ предусматривает назначение препаратов, активных в отношении наиболее вероятных «типичных» бактериальных возбудителей (в первую очередь S. pneumoniae и L. Pneumophila). Препаратами выбора являются цефалоспорины III поколения без антисинегнойной активности, цефепим, ингибиторзащищенные аминопенициллины или эртапенем, которые должны назначаться в комбинации с макролидом для внутривенного введения (табл. 12).
Указанные режимы терапии в целом характеризуются сопоставимой эффективностью, выбор конкретного β-лактама может определяться рядом дополнительных факторов – сопутствующими заболеваниями, наличием препаратов в ЛПУ, затратной эффективностью. В регионах с более высокой распространенностью ПРП, при наличии индивидуальных факторов риска инфицирования ПРП предпочтение следует отдавать цефтаролину.
У пожилых пациентов с множественной сопутствующей патологией и высоким риском неблагоприятного прогноза, обитателей домов престарелых определенными преимуществами может обладать эртапенем. При развитии ВП у пациентов с гриппом предпочтительны ингибиторзащищенные аминопенициллины, цефтаролин, цефепим в силу их более высокой антистафилококковой активности.
Альтернативным режимом эмпирической АБТ ТВП без дополнительных факторов риска является комбинация респираторного фторхинолона (моксифлоксацин, левофлоксацин) с цефалоспорином III поколения (цефотаксим, цефтриаксон).
У лиц с факторами риска инфицирования P. aeruginosa препаратами выбора являются β-лактамные АБП с антисинегнойной активностью (пиперациллин/тазобактам, цефепим, меропенем, имипенем) в сочетании ципрофлоксацином или левофлоксацином в высокой дозе; β-лактамы с антисинегнойной активностью могут комбинироваться с аминогликозидами II–III поколений и макролидами либо респираторными фторхинолонами.
При документированной/предполагаемой аспирации препаратами выбора являются ингибиторзащищенные β-лактамы, карбапенемы либо комбинация цефалоспорина III поколения без антисинегнойной активности с клиндамицином или метронидазолом.
Рутинное назначение препаратов, активных в отношении MRSA (ванкомицин, линезолид), в режимах эмпирической АБТ ТВП не рекомендуется ввиду ожидаемой низкой распространенности возбудителя в РФ.
В дополнение к АМП у пациентов с клиническими симптомами, предполагающими инфицирование вирусами гриппа, рекомендуется эмпирическое назначение ингибиторов нейраминидазы. Противовирусные препараты могут назначаться эмпирически пациентам с ВП, находящимся в критическом состоянии в период сезонного подъема заболеваемости гриппом в регионе (терапию целесообразно отменить в случае отрицательного результата исследования респираторных образцов на грипп методом ПЦР).
Первоначальная оценка эффективности стартового режима АБТ должна проводиться через 48–72 часа после начала лечения. Основными критериями эффективности в эти сроки является снижение температуры тела, выраженности интоксикации, ДН и полиорганной недостаточности. Если у пациента сохраняются высокая лихорадка и интоксикация, прогрессируют симптомы заболевания или развиваются осложнения, АБТ расценивается как неэффективная. В этом случае необходимо пересмотреть выбранный режим АБТ.
При неэффективности АБТ на втором этапе необходимо проводить обследование пациента для уточнения диагноза, выявления возможных осложнений ВП и проанализировать результаты доступных к этому моменту микробиологических исследований.
При положительной динамике следует рассматривать возможность перевода пациента на пероральные АМП в рамках ступенчатой терапии. Переход с парентерального на пероральный АБТ должен осуществляться при стабилизации гемодинамических показателей пациента, нормализации температуры тела, улучшении клинических симптомов и признаков ТВП.
При принятии решения о переводе на пероральный прием АМП целесо-образно использовать следующие критерии:
- снижение температуры тела до субфебрильных цифр (<37,5°C) при двух измерениях с интервалом 8 часов;
- уменьшение выраженности одышки;
- отсутствие нарушения сознания;
- положительная динамика со стороны других симптомов и признаков заболевания;
- отсутствие нарушений всасывания в ЖКТ;
- согласие (настроенность) пациента на пероральное лечение.
На практике возможность перехода на пероральный способ введения АМП появляется в среднем через 2–4 дня с момента начала лечения.
Продолжительность АБТ
Оптимальная продолжительность применения АБП при ТВП до настоящего времени не определена. По мнению экспертов, при ТВП неуточненной этиологии продолжительность АБТ должна составлять 10 дней. Более длительные курсы АБТ рекомендуются при развитии осложнений заболевания (эмпиема, абсцесс), наличии внелегочных очагов инфекции, инфицировании такими возбудителями, как S. aureus, Legionella spp., неферментирующие микроорганизмы (P. aeruginosa и др.). Длительность применения противовирусных препаратов (оселтамивир, занамивир) обычно составляет 5–10 дней.
При решении вопроса об отмене АМП рекомендуется руководствоваться следующими критериями:
- температура тела <37,2°С;
- отсутствие интоксикации;
- отсутствие дыхательной недостаточности (ЧДД<20 в минуту);
- отсутствие гнойной мокроты;
- число лейкоцитов <10×109/л, нейтрофилов <80%, «юных» форм <6%;
- отсутствие отрицательной динамики на рентгенограмме органов грудной клетки (при ее выполнении в указанные сроки).
Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не является абсолютным показанием к продолжению АБТ или ее модификации.
Неантимикробная терапия
Глюкокортикостероиды
В качестве показаний к применению ГКС при ТВП рекомендуется использовать следующие: длительность септического шока (СШ) <1 суток, рефрактерный СШ или необходимость использования норадреналина (НА) в дозе, превышающей 0,5 мкг/кг/мин. Препаратом выбора является гидрокортизон в дозе 200–300 мг/сут; наиболее обоснованным выглядит инфузионный путь введения препарата со скоростью 10 мг/ч после нагрузочной дозы 100 мг. Через 2 суток необходимо оценить эффект от включения ГКС в схему терапии ТВП; длительность их применения не должна превышать 7 дней. Аргументов для рутинного использования ГКС пациентами с ОРДС (острый респираторный дистресс-синдром) без СШ, а также их назначения другим категориям больных ТВП пока недостаточно.
Заместительная терапия иммуноглобулинами
Несмотря на положительные результаты отдельных рандомизированных клинических исследований (РКИ), рекомендации по применению внутривенных иммуноглобулинов пациентам с ТВП, осложненной сепсисом, следует считать преждевременными.
Иммуностимуляция
Эффективность гранулоцит-колониестимулирующего фактора (ГКСФ) и гранулоцит-макрофаг-колониестимулирующего фактора (ГМКСФ) исследовалась отдельно при ТВП с развитием сепсиса и СШ. Позитивные результаты, выражающиеся в повышении выживаемости, получены только в одном исследовании, включившем 18 пациентов с ТВП, осложнившейся формированием сепсиса и СШ. При этом пациенты контрольной группы оказались тяжелее по шкале АРАСНЕ II – 31 против 25 баллов – и имели более высокое исходное содержание в крови интерлейкина-6.
Для успешного выбора кандидатов к проведению иммуностимуляции необходимо понимание фенотипа воспалительного ответа; рутинное использование ГКСФ и ГМКСФ на основании клинических критериев сепсиса нецелесообразно.
Статины
Доказательств, позволяющих рекомендовать рутинное использование статинов при инфекциях, включая ТВП, пока недостаточно, т.к. большинство исследований по дизайну носили наблюдательный, ретроспективный характер; при оценке эффективности в них использовались различные конечные точки и длительность приема препаратов.
Cелен
Опубликованный в 2013 г. мета-анализ девяти РКИ пациентов с сепсисом выявил снижение риска летального исхода в группе парентерального введения селена по сравнению с группой пациентов без лечения. Это, безусловно, дает определенные перспективы использования препарата в качестве адъювантной терапии пациентов с ТВП, осложненной сепсисом.
Препараты селена для внутривенного введения в РФ в настоящее время не зарегистрированы.
Респираторная поддержка
Острая ДН развивается у 58–87% больных ТВП, потребность данной категории пациентов в проведении ИВЛ достигает 66%. Острая ДН служит ведущей причиной летальности больных пневмонией. По данным проспективных исследований, госпитальная летальность среди пациентов с ТВП, нуждающихся в проведении ИВЛ, составляет 46%.
К главным задачам лечения острой ДН относится обеспечение нормальной оксигенации организма, т.к. выраженная гипоксия обладает потенциально летальными эффектами. Применение кислорода служит одним из основных направлений терапии острой ДН при пневмонии. Показанием к О2-терапии является РаО2<55 мм рт.ст. или Sр(a)O2<88% (при дыхании воздухом). Оптимально поддержание Sa(р)O2 в пределах 88–95% или PaO2 в пределах 55–80 мм рт.ст.
При умеренной гипоксемии (SpO2 80–88%) при условии достаточного респираторного усилия больного, сохраненного сознания и быстрой обратной динамики инфекционного процесса возможна коррекция гипоксемии ингаляциями кислорода при помощи простой носовой маски (FiO2 – 45–50%) или маски с расходным мешком (FiO2 – 75–90%). Если «целевые» параметры оксигенации не достигнуты, следует рассмотреть вопрос о вентиляции легких.
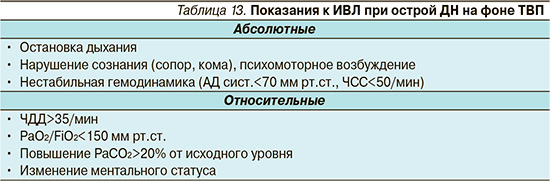
Если достижение «целевых» значений параметров оксигенации сопровождается нарастанием респираторного ацидоза и выраженной работой дыхания больного, в такой ситуации также следует рассмотреть вопрос об инициации респираторной поддержки. То есть кислородотерапия не должна использоваться вместо респираторной поддержки, если есть налицо показания к ее применению. Показания к ИВЛ при острой ДН на фоне ТВП представлены в табл. 13.
Подходы к ИВЛ при ТВП без выраженной асимметрии между легкими существенно не отличаются от тактики при ОРДС. Используется тактика протективной вентиляции легких (с использованием малых VT и подхода «открытого легкого»), что позволяет значительно уменьшать риск вентиляторассоциированного повреждения легких.
Альтернативой традиционной респираторной поддержке служит неинвазивная вентиляция легких (НВЛ), т.е. вентиляционное пособие без постановки искусственных дыхательных путей (интубационной или трахеостомической трубок), с помощью масок. Показаниями к НВЛ при ТВП являются выраженная одышка в покое, ЧДД>30 в минуту, O2/FiО2<250 мм рт.ст., PaCO2>50 мм рт.ст. или рН<7,3.
В отличие от традиционной респираторной поддержки НВЛ позволяет избегать развития многих инфекционных и механических осложнений, в то же время обеспечивая эффективное восстановление газообмена и достижение разгрузки дыхательной мускулатуры у больных острой ДН.
Следует подчеркнуть, что для проведения НВЛ при ТВП необходим строгий отбор больных, главными критериями служат сохранение сознания и кооперативность больного, а также стабильная гемодинамика. Применение НВЛ при ТВП особенно обосновано в отношении больных с фоновым заболеванием ХОБЛ при условии хорошего дренирования дыхательных путей и на ранних этапах развития острой ДН.
Предикторы неуспеха НВЛ при ТВП:
- PaO2/FiO2≤127 мм рт.ст. при поступлении;
- PaO2/FiO2≤149 мм рт.ст. после 1 часа НВЛ.
НВЛ может быть использована для отлучения больных от респиратора после длительной инвазивной респираторной поддержки.
Крайне тяжелые случаи острой ДН при ТВП могут потребовать проведения экстракорпоральной мембранной оксигенации.
Пациенты с ТВП, не отвечающие на лечение
У большинства больных ВП к 3–5-му дню с момента начала потенциально эффективной фармакотерапии и респираторной поддержки отмечается регресс клинических симптомов, признаков пневмонии и органной дисфункции. Однако часть пациентов с ВП (до 40% госпитализированных в ОРИТ) не отвечают на лечение, что может проявляться прогрессированием острой ДН и необходимостью проведения ИВЛ, развитием СШ, усугублением проявлений полиорганной недостаточности. Ухудшение в сроки > 72 часов чаще всего связано с развитием осложнений ТВП (парапневмонический плеврит, эмпиема плевры), декомпенсацией сопутствующих заболеваний или нозокомиальной суперинфекцией. Такие пациенты требуют тщательного мониторинга, т.к. летальность в группе пациентов,не ответивших на лечение, существенно возрастает.
При неэффективности стартовой терапии необходимо проводить дополнительные лабораторные и инструментальные исследования с целью уточнения степени выраженности органной дисфункции, выявления осложнений ТВП/декомпенсации сопутствующих заболеваний, пересмотреть режим АБТ с учетом полученных результатов микробиологических исследований, оценить необходимость интенсификации респираторной поддержки и показания к адъювантной фармакотерапии.
У ряда пациентов может отмечаться более медленное разрешение клинических симптомов ВП с отсроченным достижением показателей клинической стабильности; это может сопровождаться отсутствием рентгенологического разрешения очагово-инфильтративных изменений в легких или их прогрессированием (медленноразрешающаяся или неразрешающаяся пневмония).
К факторам риска неадекватного (позднего) ответа на лечение относят пожилой возраст (>65 лет), наличие хронических сопутствующих заболеваний (ХОБЛ, хроническая сердечная недостаточность, почечная и печеночная недостаточность, злокачественные новообразования, сахарный диабет и др.), мультилобарной инфильтрации, полостей деструкции, экссудативного плеврита или эмпиемы плевры, лейкопении, бактериемиии, выявление высоковирулентных возбудителей (L. pneumophila, энтеробактерии), особенно при наличии факторов риска инфицирования антибиотикорезистентными штаммами, внелегочные очаги инфекции, нерациональная эмпирическая АБТ.
Для пациентов с медленноразрешающейся/неразрешающейся ВП помимо поиска потенциальных причин неэффективности лечения большое значение имеет дифференциальная диагностика с другими инфекционными и неинфекционными заболеваниями, которые могут протекать под маской ТВП. К ним в первую очередь относятся туберкулез легких, злокачественные новообразования, тромбоэмболия легочной артерии и др.
Профилактика
Наиболее эффективными средствами профилактики ТВП в настоящее время представляются пневмококковая и гриппозная вакцины.
С целью специфической профилактики инвазивных пневмококковых инфекций, в т.ч. пневмококковой ВП с бактериемией, у взрослых в РФ используется 23-валентная неконъюгированная вакцина, содержащая очищенные капсулярные полисахаридные антигены 23 серотипов S. pneumoniae. Вакцинация пневмококковой вакциной рекомендуется группам лиц с высоким риском развития инвазивных пневмококковых инфекций.
К ним относятся:
- пациенты в возрасте 65 лет и старше;
- лица с сопутствующими хроническими заболеваниями бронхолегочной (ХОБЛ, эмфизема, бронхиальная астма), сердечно-сосудистой систем, сахарным диабетом, хроническими заболеваниями печени (включая цирроз), хронической почечной недостаточностью, нефротическим синдромом, алкоголизмом, кохлеарными имплантами, ликвореей, функциональной или органической аспленией (серповидно-клеточная анемия, спленэктомия);
- пациенты с иммунодефицитом (ВИЧ-инфекция, злокачественные новообразования, иммуносупрессивная терапия и др.);
- лица, проживающие в домах престарелых и других учреждениях закрытого типа.
Если вакцинация пневмококковой вакциной проводилась до 65 лет, то в возрасте 65 лет (не менее чем через 5 лет от момента введения первой дозы вакцины) пациентам с факторами риска инвазивных пневмококковых инфекций рекомендуется ревакцинация.
Введение гриппозной вакцины с целью профилактики гриппа и ее осложнений, в т.ч. ВП, рекомендуется при наличии высокого риска осложнений гриппа.
К группам риска относятся:
- пациенты в возрасте 65 лет и старше;
- лица с сопутствующими хроническими заболеваниями бронхолегочной, сердечно-сосудистой систем, сахарным диабетом, заболеваниями почек, гемоглобинопатиями;
- лица, проживающие в домах престарелых и других учреждениях закрытого типа;
- женщины во II или III триместре беременности (в период сезонного подъема заболеваемости).
Вакцинация также рекомендуется медицинским работникам, осуществляющим лечение и уход за лицами, входящими в группы высокого риска осложнений гриппа.
Вакцинация гриппозной вакциной проводится ежегодно, оптимальное время для проведения вакцинации: октябрь – первая половина ноября.
Следует отметить, что при наличии показаний обе вакцины (пневмококковая и гриппозная) могут вводиться одновременно без увеличения частоты побочных эффектов или снижения иммунного ответа.



