Ведущей причиной акромегалии является формирование моноклональной СТГ-продуцирующей опухоли гипофиза (соматотропиномы), которая оказывает поступательное компрессионное воздействие на окружающие ткани (масс-эффект) и способствует прогрессивному развитию в организме соматических и обменных нарушений, вызванных продолжительной гиперпродукцией соматотропного гормона (СТГ) и гормона-посредника – инсулиноподобного фактора роста 1 (ИФР-1).
Заболевание характеризуется запоздалой диагностикой, присутствием полиорганной патологии, снижением качества и продолжительности жизни, а также трудностями в подборе адекватного лечебного пособия. К независимым предикторам преждевременной смерти относят: кардиоваскулярные нарушения, артериальную гипертензию, сахарный диабет, сохраняющиеся высокие концентрации СТГ и ИФР-1, большую продолжительность активной стадии, пожилой возраст пациентов [1, 2].
Существующая низкая распространенность акромегалии (35–70 случаев на 1 млн жителей) затрудняет проведение проспективных сравнительных клинических исследований, направленных на поиск более совершенных методов лечения. В связи с этим особую актуальность приобретает разработка наиболее эффективных схем выявления и лечения заболевания, что существенно улучшает его прогноз.
В настоящее время наиболее рациональной организационной формой помощи больным редкими нозологиями являются национальные и муниципальные регистры, реализующие программы ранней диагностики заболевания, изучения патогенетических механизмов его развития, клинической апробации новых медицинских пособий. С 2003 г. благодаря корпоративному участию сотрудников Эндокринологического научного центра МЗ РФ, Эндокринологического диспансера Департамента здравоохранения г. Москвы и кафедры эндокринологии Первого МГМУ им. И.М. Сеченова в Москве существует регистр больных акромегалией и гипофизарным гигантизмом, который обеспечивает каждому пациенту современное диагностическое обследования, квалифицированное лечение и динамическое наблюдение. По данным на декабрь 2014 г., на учете в Эндокринологическом диспансере состояли 406 больных акромегалией, средний возраст которых при обращении составил 54 (47–62) года, Ме (25–75%), 75% от всей выборки составляют женщины. Пик дебюта заболевания приходится на 3–5-ю декады жизни. Средняя длительность латентного периода составляет 6,4 (4–8) года, длительность активной стадии – 10,5 (7–17,5) года. В последний показатель входит длительность неэффективного лечения, которая в среднем составляет 3 (1–9,5) года. Обнаружена обратная корреляция между возрастом дебюта заболевания, с одной стороны, и базальным содержанием в крови СТГ, ИФР-1, а также объемом опухоли гипофиза, с другой (p<0,001), что указывает на возрастные особенности течения заболевания. За истекший период удалось решить ряд методологических и организационных вопросов, позволивших существенно повысить качество и эффективность медицинской помощи больным акромегалией. Среди них:
- принятие международного консенсуса по тактике обследования и лечения больных гипофизарным гигантизмом и акромегалией;
- внедрение согласованных и унифицированных методов диагностики и лечения больных акромегалией в клиническую практику;
- создание системы динамического наблюдения за состоянием пациентов с помощью современных лабораторных и инструментальных методов диагностики;
- организация льготного обеспечения больных акромегалией и гипофизарным гигантизмом необходимыми лекарственными средствами [3].
Несмотря на достигнутые успехи, все еще сохраняются проблемы, связанные с оперативной диагностикой и адекватным лечением акромегалии. Скрытый характер заболевания, замедленное развитие характерных соматических изменений приводят к тому, что при постановке диагноза примерно у 80% больных выявляется макроаденома гипофиза, нередко с экстраселлярным ростом, что автоматически снижает прогноз радикального удаления опухолевой ткани и предполагает необходимость подключения вторичной фармакотерапии. Клиническую ситуацию осложняет множественность существующих патоморфологических вариантов опухолевого строения, различающихся особенностями клинического развития, степенью цитодифференцировки и характером рецепторной экспрессии, что также следует учитывать при формировании лечебной стратегии [4].

Среди типичных соматотропинóм выделяют аденомы, состоящие из густогранулированных ацидофильных клеток; аденомы, состоящие из слабогранулированных хромофобных клеток; смешанные аденомы (соматопролактиномы, маммосоматотропиномы), аденомы из ацидофильных стволовых клеток и плюригормональные аденомы [5, 6]. Относительно благоприятным течением отличаются соматотропиномы, состоящие из густогранулированных клеток, их течение характеризуется поздним дебютом, низкой секреторной и пролиферативной активностью. Как правило, аденоматозные клетки экспрессируют 2-й подтип соматостатиновых рецепторов (ССР) и отличаются хорошей чувствительностью к октреотиду и ланреотиду [7, 8].
Напротив, низкодифференцированные и смешанные виды аденом отличаются агрессивным течением, что проявляется в быстром увеличении опухолевой массы с выходом за пределы турецкого седла, инфильтративном характере роста и наклонности к рецидивированию после хирургического вмешательства. Эти опухоли наблюдаются, как правило, у лиц моложе 30 лет, имеют генетическую предрасположенность, характеризуются большим объемом (>1 см3), высокой скоростью опухолевого роста (>2 см3 в год) с признаками интраселлярной и интракраниальной компрессии, повышенной секреторной активностью (уровни СТГ>50 нг/мл, ИФР-1>850 нг/мл) и устойчивостью к лечебному воздействию. При гистологическом исследовании опухолевого материала обнаруживают слабогранулированные соматотропоциты, смешанные или низкодифференцированные клетки с высоким индексом пролиферации Кi-67 (3%) и повышенной концентрацией белка р53. Клетки отличаются низкой экспрессией 2-го подтипа ССР и, соответственно, резистентностью к аналогам соматостатина – АС [9–11]. Косвенным инструментальным подтверждением наличия опухоли, образованной из слабогранулированных хромофобных клеток, является наличие изо- или гиперинтенсивного сигнала на Т2-взвешенных магнитно-резонанансных томограммах [12].
Таким образом, к настоящему времени накоплены убедительные доказательства того, что гистологический фенотип аденоматозной ткани определяет не только характер развития опухолевого процесса и клинический сценарий акромегалии, но и избирательную чувствительность к предлагаемому лечению, что необходимо учитывать при формировании лечебной стратегии.
Консенсусные соглашения по диагностике, лечению и контролю течения акромегалии
Международная практика подтверждает, что своевременное выявление акромегалии, радикальная аденомэктомия (или стойкая лекарственная супрессия опухолевой активности с нормализацией уровней СТГ и ИФР-1) являются залогом профилактики необратимых осложнений, ассоциированных с ранней инвалидизацией и высокой летальностью. В диагностической формуле выделяют активную стадию акромегалии и стадию контроля, под которой понимается стойкая нормализация секреции гормона роста (ГР), обусловленная хирургическим, фармакологическим, лучевым или комбинированным лечебным пособием (табл. 1) [13].
С учетом низких показателей качества жизни и выживаемости пациентов основной целью лечения акромегалии является скорейшее достижение и поддержание стойкой клинико-биохимической ремиссии с минимизацией риска ятрогенных нарушений. Медицинское пособие предполагает применение современных средств хирургического, лучевого или медикаментозного контроля роста и секреторной активности аденомы гипофиза с учетом выраженности масс-эффекта, особенности клинического течения и соматического состояния больных [14].
Транссфеноидальная аденомэктомия является терапией первой линии при микроаденомах и интраселлярных макроаденомах. Хирургический подход также показан при появлении масс-эффекта растущей опухоли, в частности при выраженной краниалгии и прогрессирующем нарушении зрительных функций. При оперативном удалении микроаденомы полная биохимическая ремиссия (с нормализацией уровня ИФР-1 в крови) наблюдается в 75–80% случаев, тогда как радикальное удаление макроаденомы достигается лишь у 40–60% пациентов. Сам факт наличия опухоли больших размеров указывает на техническую сложность достижения клинико-биохимической ремиссии из-за инвазивного прорастания в окружающие структуры. В 43% случаев сохраняется продолженный рост и в 2–3% случаев – рецидивирующее течение [15].
Что же касается лучевой терапии, то, согласно международным рекомендациям, в связи с отсроченным эффектом наступления ремиссии и высоким риском развития осложнений этот ранее распространенный способ используют в основном при неэффективности оперативного и/или медикаментозного лечения. Даже при использовании высокоточной стереотаксической радиотерапии и радиохирургии нормализация уровня ИФР-1 наблюдается через 3, 5 и 10 лет у 45%, 58 и 86% больных соответственно. Контроль акромегалии после лучевой терапии наступает у 22% больных через 2 года, у 77% – через 20 лет. Нередко резистентным больным назначают повторные курсы облучения, что существенно повышает риск побочных эффектов. Осложнениями являются гипофизарная недостаточность, лучевые некрозы, зрительные нарушения, вторичные опухоли, снижение когнитивных функций [14, 16].
За последние десятилетия способ медикаментозного лечения акромегалии существенно укрепил свои позиции и в немалой степени благодаря широкому использованию синтетических АС, обладающих не только антисекреторным, но и выраженным антипролиферативным действием, приводящим к «медикаментозной аденомэктомии». Как показывает клиническая практика, более половины больных соматотропиномами нуждаются в длительном первичном приеме пролонгированных АС, которые назначают в связи с отсутствием хирургической перспективы, тяжелым соматическим состоянием или отказом от оперативного вмешательства [17].
Хорошо зарекомендовала себя практика предоперационного использования АС для уменьшения объема опухолевой ткани и улучшения соматического статуса пациентов, что способствует значительному снижению риска периоперационных осложнений. Противоопухолевый эффект АС реализуется прямым и непрямым влиянием через активацию ССР на поверхности опухолевых клеток, а также клеток микроокружения. Механизмы противоопухолевого действия изучены в исследованиях in vitro и in vivo и изложены в одном из последних обзоров Zatelli и соавт. Ведущими из них являются приостановка клеточного цикла, активизация апоптоза и ингибирование продукции ангиогенных ростовых факторов [18].
Считается, что именно 2-й подтип ССР обладает особенной активностью в обеспечении жизнеспособности клетки. Снижение его экспрессии в процессе туморогенеза способствует дисрегуляции клеточного роста и гормональной гиперсекреции в результате нивелирования соматостатин-опосредованных ингибирующих сигналов. Доказано, что именно соматостатин-резистентные аденомы отличаются наибольшими размерами и агрессивным течением. Напротив, сохраняющаяся экспрессия 2-го подтипа ССР обеспечивает антипролиферативное действие АС благодаря цитостатическому и цитотоксическому воздействиям на опухолевые клетки. При проведении клинико-морфологического исследования было показано, что даже 3-месячное введение АС способствовало развитию регрессивных изменений в аденоматозных клетках, а также образованию периваскулярного и интерстициального фиброза [19, 20].
В настоящее время выделяют две генерации синтетических АС. К первой генерации аналогов соматостатина (АС1) относятся хорошо известные лекарственные соединения – октреотид и ланреотид, которые преимущественно воздействуют на 2-й подтип ССР, что проявляется в известной избирательности их действия. К АС второй генерации (АС2) относится пасиреотид – новое лекарственное соединение, обладающее аффинностью к рецепторам соматостатина 1-го, 2-го, 3-го и преимущественно 5-го подтипов, которое может быть использовано в случае резистентности к АС1 [21].
Выделяют следующие степени чувствительности к АС:
- полную чувствительность – контроль уровней СТГ и ИФР-1 и уменьшение объема опухоли >20% от исходного при первичной (вторичной) терапии;
- частичную чувствительность – достоверное снижение уровней СТГ, ИФР-1>50%, но не достигающее нормы и/или уменьшения объема опухоли >20%, отсутствие чувствительности (резистентность) – недостоверное снижение уровней СТГ, ИФР-1, отсутствие контроля и уменьшения объема опухоли [20].
Клинико-лабораторные предикторы, характеризующие особенности клинического течения и качество контроля акромегалии
В свете вышесказанного становится очевидным, что, поскольку в опухолевой ткани могут доминировать клетки с преимущественной экспрессией 2-го либо 5-го подтипов, для оценки перспективности долговременного использования АС у больных акромегалией желательно первоначально определиться с характером функционирующих рецепторов, т.е. представительством позитивных (или негативных) по 2-му и 5-му подтипам ССР в опухолевых клетках. Чем выше соотношение между 2-м и 5-м подтипами, тем лучше гормональный контроль при использовании АС1.

Дополнительными иммунологическими маркерами повышенной чувствительности к АС1 являются наличие GSP-мутации, низкая экспрессия β-аррестина 1, повышение уровня Е-кадерина и присутствие дофаминовых рецепторов 2-го типа в опухолевых клетках. Напротив, при наличии мутации арил гидрокарбон рецепторного белка (AIP), наблюдаемой в случаях семейной изолированной гипофизарной аденомы, больные отличаются ранним возрастом дебюта, агрессивным развитием опухолевого процесса и низкой чувствительностью к АС [22–24].
К сожалению, практические врачи при первичном обследовании не обладают достаточной информацией о состоянии опухолевого процесса (данными электронной микроскопии и иммуногистохимии, характеризующими особенности рецепторной архитектоники и пролиферативную активность опухолевых клеток). Такой «паспорт аденомы гипофиза», отражающий фенотипическую гетерогенность опухолевой ткани, можно получить только при направленном исследовании удаленного материала и реально использовать для решения вопроса о вторичной терапии. Однако для эндокринологов представляется архиважным уже на диагностическом этапе получить представление относительно вероятного сценария развития акромегалии и наиболее рациональных лечебных мероприятиях в каждом конкретном случае.
Внедрение современных принципов персонализированной и предиктивной медицины в нейроэндокринологию предполагает отказ от формальных эмпирических схем методом «проб и ошибок» и внедрение в практику дифференцированного подхода с учетом фенотипических особенностей течения заболевания. Порочность существовавшей ранее практики следует из клинических данных, указывающих на то, что в неселективной выборке лечение АС1 приводит к биохимической нормализации только в 25–34% случаев [13, 17]. Возвращаясь к схеме A. Colao, представляется нецелесообразным проводить дорогостоящий курс терапии АС и только по итогам длительного периода лечения констатировать наличие к ним резистентности.
Среди доступных клинико-лабораторных показателей, которые могут иметь прогностическое значение, можно выделить возраст пациента, возраст дебюта заболевания, длительность латентного периода и активной стадии, активность СТГ/ИФР-1 оси (исходно и на фоне лечения), величину СТГ-надира, содержание тропных гормонов, объем опухолевой ткани, скорость и характер опухолевого роста, признаки интраселлярной или интракраниальной компрессии, данные о наличии органных и обменных нарушений. Следует учитывать и гендерные особенности. У женщин наблюдается лучшая чувствительность к АС1, поскольку эстрогены участвуют в регуляции 2-го подтипа ССР. Дополнительным фактором являются сведения относительно способа и эффективности ранее проведенного лечения [5, 21].
Косвенное суждение о характере рецепторной экспрессии может быть получено с помощью короткой пробы с октреотидом, используемой в качестве диагностического зонда для подтверждения наличия или отсутствия 2-го подтипа ССР. Обоснованием для такого заключения явились результаты проспективного двухлетнего сравнительного исследования эффективности использования АС1 в двух группах пациентов, исходно различавшихся по степени снижения уровня ИФР-1 при проведении 3-дневной пробы с октреотидом. Первую группу составили пациенты с хорошей чувствительностью к октреотиду (снижение уровня ИФР-1 на фоне пробы >60% от исходного), 2-ю группу – больные с исходно низкой чувствительностью к октреотиду (снижение ИФР-1<30% от исходного уровня). Результаты показали, что у больных 1-й группы прием АС даже в небольшой дозе (20 мг/28 дней) способствовал достижению быстрой и стойкой биохимической ремиссии в 89% случаев, тогда как во 2-й группе (несмотря на максимальные дозы октреотид-содержащих препаратов 40 мг/28 дней) медикаментозный контроль наблюдался только в 17% случаев (р=0,001). Если же сравнивать противоопухолевое действие АС1, то в 1-й группе уменьшение объема опухолевой ткани отмечалось в 83% и стабилизация размеров – в 17% случаев, тогда как во 2-й группе уменьшение объема опухолевой ткани наблюдалось лишь в 37%, стабилизация объема – в 22% случаев и что самое неприятное – в 41% случаев отмечался продолженный рост опухоли (р=0,032) [25].
Отсюда можно сделать три вывода. Во-первых, чувствительность к октреотиду является важным прогностическим фактором для суждения об эффективности планируемого длительного медикаментозного лечения АС1. Во-вторых, предварительный выбор «чувствительных к АС1» пациентов позволяет существенно повысить процент эффективности фармакотерапии при сопряженном снижении финансовых затрат. И в-третьих, такая целенаправленная позиция позволяет исключить из лечебного списка заведомо неэффективные для конкретного пациента лекарственные препараты и избежать негативных последствий, связанных с длительным неадекватным лечением.
На необходимость предварительного использования острого теста с октреотидом как биомаркера эффективности лечения АС1 указывают и другие авторы [26–28]. M.P. Domingo предлагает сопоставлять результаты острого теста с октреотидом с данными магнитно-резонансной томографии (МРТ). Сочетание положительной пробы с октреотидом с наличием гипоинтенсивного (относительно коры мозга) сигнала на Т2-взвешенных МР-томограммах указывает на наиболее вероятное присутствие опухоли, состоящей из густогранулированных клеток, восприимчивых к лечению АС1. Как показывают исследования, почти 90% больных с выявленным гипоинтенсивным сигналом положительно реагируют на тест с октреотидом, демонстрируя снижение уровня СТГ>50% от исходного. Напротив, отрицательная реакция на октреотид и выявление при МРТ изо- или гиперинтенсивного сигнала от опухолевой ткани свидетельствуют в пользу присутствия агрессивной слабогранулированной опухоли, резистентной к АС1. В последнем случае рекомендуется использование пробы с пасиреотидом для оценки перспективы его дальнейшего применения у данной категории пациентов [29].
С целью систематизации выделенных клинико-лабораторных диагностических признаков нами осуществлен кластерный анализ, в ходе которого были определены статистически значимые совокупности параметров, позволяющие выделить в клиническом течении акромегалии по крайней мере 2 сценария развития, различающихся между собой по ряду анамнестических и морфо-функциональных признаков, отражающих специфику опухолевого процесса и чувствительность к лечению (табл. 2).
Как показали результаты клинико-патоморфологических исследований, первому сценарию отвечают опухоли гипофиза, состоящие из слабогранулированных хромофобных клеток, а также смешанные аденомы, отличающиеся агрессивным и рецидивирующим течением, тогда как 2-й сценарий более подходит для аденом, состоящих из густогранулированных ацидофильных клеток, имеющих доброкачественное течение и хорошие перспективы для фармакотерапии [10, 30].
Вместе с тем хотелось бы обратить внимание на еще один очень важный аспект, связанный с длительной медикаментозной терапией. Дополнительным предиктором эффективности лекарственной терапии (несмотря на наличие изначальной чувствительности к препарату) является длительность периода нормализации уровней СТГ и ИФР-1, зависящая от соблюдения терапевтического режима, который включает использование высококачественных лекарственных форм, регулярный прием, соблюдение правил введения препарата, условий хранения и динамический контроль гормонального статуса. Описаны случаи, когда прерывание лечения АС приводило к обратному увеличению размеров опухоли. Отсюда следует, что достижение и поддержание стойкой биохимической ремиссии попутно с улучшением клинической симптоматики будет сопровождаться поступательным уменьшением объема опухолевой ткани (и уменьшением масс-эффекта) [31].
Практика показывает, что, ориентируясь на динамику нормализации содержания СТГ, ИФР-1 на фоне приема АС, можно судить о перспективе антитуморозного действия фармакотерапии, что представляется наиболее важным в плане долгосрочной перспективы. При этом можно ограничиться динамическим контролем лишь уровня ИФР-1, адекватно отражающим текущую секреторную активность опухоли. Для этого заключения есть несколько резонов. Во-первых, единственной причиной повышения уровня ИФР-I в крови является продолжительная гиперсекреция СТГ. Во-вторых, благодаря длительному периоду полужизни (18–20 часов) его содержание в крови (в отличие от СТГ) не подвержено частым колебаниям, обеспечивая более воспроизводимые результаты гормонального анализа.
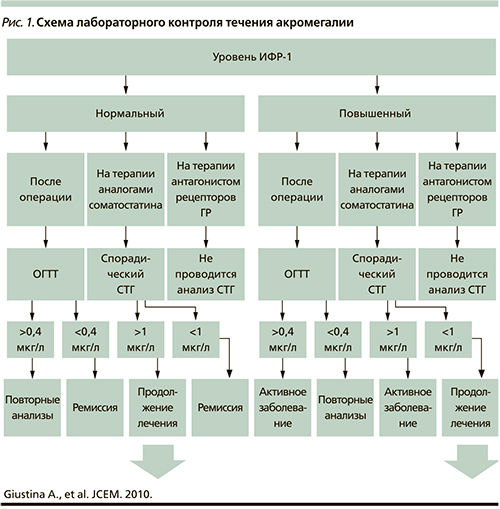
И в-третьих, именно хроническое увеличение концентрации ИФР-1 (выше возрастно-половой нормы) является ответственным за развитие основных клинических проявлений акромегалии. Обобщенные рекомендации консенсусной группы в отношении лабораторного контроля течения заболевания представлены на рис. 1 [32].
На диагностическую значимость динамического контроля уровня ИФР-1 как предиктора адекватности антисекреторного и антипролиферативного лечения акромегалии АС указывают результаты международных исследований. Так, предоперационное использование ланреотида у 104 пациентов с акромегалией из неселективной выборки способствовало нормализации уровня ИФР-1 у каждого четвертого пациента, что сопровождалось уменьшением объема опухоли на 20% от исходного (р<0,001) [33, 34].
Согласно результатам 48-недельного международного открытого многоцентрового исследования PRIMARYS (3б-фаза), было показано, что лечение ланреотидом (Соматулин® Аутожель® 120 мг) способствовало снижению уровня СТГ≤2,5 мг/л у 65% и нормализации уровня ИФР-1 у 39% больных. При этом у 63% пациентов было отмечено уменьшение объема опухоли ≥ 20% по сравнению с первоначальным значением [35].
Клинические данные post-hoc анализа исследования PRYMARYS также указывают на роль динамики снижения концентрации ИФР-1 в качестве ключевого предиктора эффективного лечения акромегалии и демонстрируют прямую корреляцию между степенью нормализации уровня ИФР-1 на фоне лечения ланреотидом 120 мг и величиной редукции опухолевой ткани. В исследование были включены ранее нелеченные пациенты с акромегалией и наличием макроаденомы. Лечение включало инъекции ланреотида 120 мг подкожно каждые 28 дней без титрации дозы (всего 12 инъекций). Гормональный статус и объем опухолевой ткани контролировались на 12-й, 24 и 48-й неделях от начала терапии. Изменение размеров опухоли определяли как существенное при уменьшении объема ≥20% по сравнению с исходным значением. О контроле заболевания судили по уровню СТГ≤2,5 мг/л и нормализации показателя ИФР-1.
Снижение уровня ИФР-1 менее 10% от исходного к 24-й неделе терапии отмечалось как недостаточное.
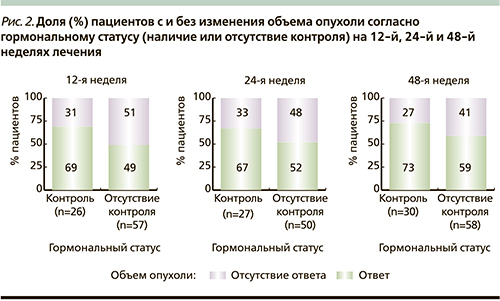
Результаты клинического исследования подтвердили наличие связи между снижением активности СТГ/ИФР-1 оси и уменьшением объема опухоли к 48-й неделе терапии по сравнению с первоначальными данными. Доля пациентов с существенным уменьшением объема опухоли была значительно выше в группе, достигшей гормонального контроля (67–73%), чем в группе с сохраняющейся активной стадией (41–51%). Как правило, при наличии чувствительности положительная тенденция формируется уже к 12-й неделе лечения (рис. 2) [36].
Заключение
Использование АС в качестве первичной или вторичной медикаментозной терапии (с учетом клинико-лабораторных предикторов) позволяет добиться хороших терапевтических результатов, способствующих повышению качества и продолжительности жизни больных акромегалией. Залогом эффективного противоопухолевого действия АС является длительный период поддержания нормальных концентраций ИФР-1, что подтверждается результатами международных клинических исследований.



