Бронхиальная астма (БА) остается самым частым хроническим заболеванием нижних дыхательных путей у детей во всем мире. Влияние БА на качество жизни детей разного возраста очень велико [1]. Экономический ущерб от астмы огромен. Одним из основных способов снижения затрат является достижение хорошего контроля астмы [2]. БА относится к заболеваниям, исход которых зависит от применяемой терапии. Оптимальная фармакотерапия в большинстве случаев позволяет больным контролировать симптомы астмы и снижать риск обострений [3].
Целью лечения БА у детей стало достижение хорошего контроля симптомов, поддержание нормального уровня активности, снижение риска обострений и ухудшения функции легких. Лечение БА включает медикаментозную терапию, коррекцию изменяемых факторов риска и немедикаментозные методы лечения. Перспективной стратегией служит выделение фенотипов БА с определением наиболее подходящих вариантов лечения для каждой группы больных [4].
В соответствии с Глобальной стратегией лечения и профилактики БА (GINA – Global Initiative for Asthma, 2014) [5] терапия БА представляет замкнутый цикл, состоящий из jценки (диагноза, контроля над симптомами и факторами риска, функции легких, методики ингаляции и приверженности лечению, предпочтений больного/родителей), jодбора терапии (медикаментозные и немедикаментозные методы лечения, модификация факторов риска) а также ревизии симптомов, обострений, побочных эффектов терапии, удовлетворенности больного, функции легких (см. рисунок).
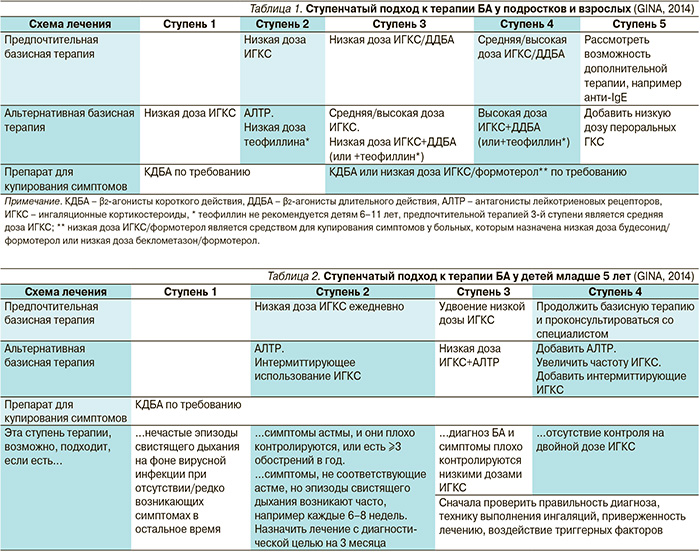
 Современный ступенчатый подход к терапии БА позволяет достигать максимального контроля симптомов астмы и приверженности лечению и в то же время минимизировать стоимость лечения и побочные эффекты терапии (табл. 1, 2). Ступенчатый подход предполагает усиление терапии при невозможности достичь контроля в течение 1–3 месяцев и снижение медикаментозного лечения при наличии хорошего контроля.
Современный ступенчатый подход к терапии БА позволяет достигать максимального контроля симптомов астмы и приверженности лечению и в то же время минимизировать стоимость лечения и побочные эффекты терапии (табл. 1, 2). Ступенчатый подход предполагает усиление терапии при невозможности достичь контроля в течение 1–3 месяцев и снижение медикаментозного лечения при наличии хорошего контроля.
К основной группе препаратов для лечения БА относятся ингаляционные кортикостероиды (ИГКС) [6]. Использование ИГКС в качестве базисной терапии поддерживается международными и отечественными рекомендациями [1, 5, 6], т.к. имеются веские доказательства, согласно которым терапевтические дозы ИГКС снижают выраженность симптомов астмы и улучшают функцию легких, снижают потребность в дополнительных препаратах, а также уменьшают частоту обострений БА и госпитализаций детей. Благодаря разносторонней противовспалительной активности ИГКС оправданны в качестве первой ступени базисной терапии БА, особенно у детей первых лет жизни, у которых обострения развиваются на фоне респираторных вирусных инфекций и носят, как правило, выраженный характер [5, 6].
Для достижения наилучших результатов базисная терапия должна быть начата в максимально короткие сроки после установления диагноза БА. Раннее начало базисной терапии низкими дозами ИГКС позволяет сохранять более хорошую функцию легких и контроль симтомов астмы по сравнению с отсутствием терапии. Эффективность ИГКС может зависеть от длительности предшествующих симптомов астмы: чем раньше начата базисная терапия, тем эффективность медикаментозного лечения выше. Кроме того, раннее начало базисной терапии позволяет применять более низкие дозы ИГКС [7–9]. Последствия позднего начала терапии ИГКС остаются заметными даже через 5 лет после начала лечения [9].
Ступень 1. Для детей младше 5 лет с интермиттирующими эпизодами свистящего дыхания на фоне вирусной инфекции, у которых короткодействующие β2-агонисты недостаточно эффективны, можно рассмотреть вопрос о назначении интермиттирующих курсов ИГКС.
Ступень 2. Регулярное ежедневное применение низких доз ИГКС и использование КДБА по потребности. Применение низкой дозы ИГКС служит доказанной эффективной стратегией первоначальной базисной терапии БА у детей младше 5 лет. Было показано, что ИГКС у детей дошкольного возраста снижают риск возникновения тяжелых обострений, улучшают другие клинические параметры и показатели функции легких [10–12]. Такая базисная терапия детей со среднетяжелой и тяжелой БА должна продолжаться по крайней мере 3 месяца, чтобы определить ее эффективность в достижении хорошего контроля астмы.
Ступень 3. Если в течение трех месяцев терапия низкой дозой ИГКС не дает контроля симптомов астмы, предпочтительной тактикой становится увеличение дозы ИГКС в 2 раза и оценка эффективности лечения через 3 месяца. Наилучшей комбинацией при недостаточном эффекте является ИГКС с β2-агонистами длительного действия [1, 13, 14]. В педитарии зарегистрированы будесонид с формотеролом и флутиказона пропионат с салметеролом. С 12 лет также могут использоваться мометазон и формотерол, а также беклометазон и формотерол. Альтернативой служит добавление АЛТР к низкой дозе ИГКС.
Ступень 4. Если увеличение дозы ИГКС в 2 раза не позволяет достигать контроля симптомов астмы, возможна следующая стратегия:
- дальнейшее увеличение дозы ИГКС (возможно, в сочетании с более частым приемом) в течение нескольких недель до достижения контроля астмы;
- добавление АЛТР, теофиллина или низких доз пероральных КС (только на несколько недель) до достижения контроля астмы;
- добавление ИГКС по требованию в дополнение к регулярному приему, если основной проблемой являются обострения.
Применение будесонида суспензии через небулайзер снижает риск обострений БА у детей на 45% по сравнению с другими видами базисной терапии [15].
ИГКС могут эффективно применяться не только в качестве базисной терапии, но и при терапии обострений БА, особенно у детей, не получающих базисную терапию ИГКС [16]. К таким больным возможно применение будесонида через небулайзер в течение нескольких дней или недель. Дети, получавшие ингаляции суспензии будесонида при терапии обстрений БА, имели в дальнейшем сниженный риск госпитализаций [15]. Ингаляция суспензии будесонида через небулайзер в сочетании с β2-агонистами остается эффективной терапией среднетяжелых и тяжелых приступов БА у детей [17]. Возможно применение ИГКС в высокой дозе через небулайзер (1000–2000 мкг/сут) в течение нескольких дней, что может снижать потребность в пероральных ГКС и повышать показатели достижения полной ремиссии [18]. Однако следует тщательно контролировать возможность возникновения побочных эффектов. Если в качестве базисной терапии уже использовались ИГКС, удвоение их дозы у детей старше 5 лет было неэффективным, а исследования с участием детей младше 5 лет отсутствуют [5].
С учетом распространенности БА и ее влияния на качество жизни целесообразна дальнейшая разработка мер первичной и вторичной профилактики, особенно у детей с атопией. В последнее время активно исследуются возможности раннего назначения терапии в целях влияния на естественное течение заболевания. Однако пока результаты неутешительны: в ряде исследований было показано, что даже продолжительное лечение ИГКС не предотвращало прогрессирования заболевания [6].
Изучение естественного течения и прогноза БА имеет особенно большое значение в педиатрии, т.к. дети младшего возраста с рецидивирующими эпизодами свистящего дыхания имеют повышенный риск развития персистирующей БА к подростковому возрасту, особенно дети с атопией. С другой стороны, известно, что у значительной части детей с эпизодами свистящего дыхания эти симптомы исчезают к определенному возрасту.
Данные об эффективности низких доз ИГКС в предотвращении интермиттирующих эпизодов свистящего дыхания, ассоциированных с вирусной инфекцией у маленьких детей, ограниченны и противоречивы [6]. Эпизоды свистящего дыхания у маленьких детей первоначально следует лечить ингаляционными КДБА независимо от того, установлен ли диагноз БА [5]. Если характер симптомов указывает на астму и респираторные симптомы не контролируются и/или эпизоды свистящего дыхания возникают часто и протекают тяжело, следует верифицировать заболвание с привлечением специалистов и назначать базисную терапию.
ИГКС у детей дошкольного возраста с высоким риском развития астмы могут снижать частоту возникновения эпизодов свистящего дыхания и их тяжесть, а также уменьшать потребность в бронхолитиках, однако они не оказывают профилактического действия после их отмены даже при длительном применении [19–21]. Ежедневное применение ИГКС детьми дошкольного возраста с частыми эпизодами свистящего дыхания и при наличии высокого риска развития БА снижало число обострений, требующих применения пероральных ГКС [22].
Точный механизм действия ИГКС при лечении БА до конца не ясен. ИГКС оказывают противовоспалительное действие – ингибируют высвобождение медиаторов воспаления и цитокин-опосредованного иммунного ответа. ИГКС снижают выраженность отека слизистой оболочки бронхов, продукцию слизи и гиперреактивность дыхательных путей. Противовоспалительный эффект реализуется во время раннего и позднего аллергических ответов [23]. Кроме того, было показано, что ГКС восстанавливают синхронность митоза в респираторном эпителии при астме. Предполагается, что респираторный эпителий играет важную роль в патогенезе БА. Было выявлено, что секреция воспалительных цитокинов коррелирует с асинхронностью митоза эпителиальных клеток при повреждении [24].
Одним из наиболее изученных и широко распространенных ИГКС является будесонид, обладающий сильным местным противовоспалительным действием. Аффинность будесонида к рецепторам ГКС в 15 раз выше, чем у преднизолона. Благодаря высокой растворимости будесонид абсорбируется с поверхности слизистой оболочки бронхов в течение 6 минут. Будесонид обладает меньшей, чем другие ИГКС, местной иммуносупрессивной активностью. После проникновения в клетки будесонид связывается с жирными кислотами, образуя депо. Будесонид высвобождается из депо в течение суток и может оказывать длительное (24-часовое) действие, благодаря чему всю суточную дозу можно ингалировать за один раз. Будесонид увеличивает количество активных β2-адренорецепторов и восстанавливает реакцию на бронхолитики, позволяя уменьшать частоту их применения [25].
Будесонид оказывает противовоспалительное действие в бронхах, снижая выраженность симптомов и частоту обострений БА с меньшей, чем при использовании системных ГКС, частотой побочных эффектов. Он уменьшает реактивность дыхательных путей в ответ на ингаляцию гистамина и метахолина.
При назначении ИГКС следует учитывать потенциальный риск возникновения побочных эффектов, к одним из которых относится торможение линейного роста. Систематический обзор 2014 г. из Кокрановской базы данных показал, что регулярное применение ИГКС в низких или средних дозах детьми школьного возраста с легкой и среднетяжелой персистирующей БА связано с торможением скорости линейного роста на 0,48 см/год в течение первого года терапии. Этот эффект максимально выражен в течение первого года терапии ИГКС и гораздо менее заметен в последующие годы терапии [26]. Влияние ИГКС на рост зависит от дозы и длительности терапии [27]. Однако даже при длительном применении ИГКС рост больных достигает ожидаемых нормативных показателей для взрослых [28, 29]. Вместе с тем необходимо помнить, что неконтролируемая БА замедляет развитие детей и уменьшает итоговый рост. Риск возникновения подкапсульной катаракты и снижения минеральной плотности костей при использовании ИГКС детьми очень низок. При подборе поддерживающей дозы необходимо стремиться к назначению минимальной эффективной дозы.
Применение будесонида в дозе до 400 мкг/сут детьми старше 3 лет не приводило к возникновению системных побочных эффектов. При превышении дозы 800 мкг/сут системные эффекты препарата встречаются чаще. Будесонид хорошо переносится при длительном лечении, не обладает минералокортикостероидной активностью [30]. Время начала терапевтического эффекта после ингаляции одной дозы препарата составляет несколько часов. Максимальный терапевтический эффект достигается через 1–2 недели после начала лечения.
Таким образом, будесонид как монотерпия в суспензии, так и в комбинации с другими препаратами оказывает хороший эффект в качестве базисной терапии и терапии обострений БА у детей при оптимальном профиле безопасности. Варианты терапии могут быть индивидуально подобраны с учетом особенностей возраста и течения заболевания.



