Бронхиальная астма (БА) относится к числу наиболее широко распространенных хронических заболеваний. Считается, что этим заболеванием в мире страдают более 300 млн человек [1]. В основе патогенеза БА лежит хронический воспалительный процесс, который приводит к развитию гиперреактивности бронхов и бронхиальной обструкции, проявляющейся приступами одышки (удушья), хрипами (свистами) в грудной клетке, кашлем с выделением скудной мокроты.
Глюкокортикостероидные гормоны, обладающие широким спектром противовоспалительных эффектов, с середины прошлого столетия широко используются в лечении различных заболеваний, в т.ч. и БА. Широта спектра противовоспалительного действия глюкокортикостероидов (ГКС) обусловлена их влиянием на клеточные и молекулярные механизмы воспаления. На клеточном уровне ГКС уменьшают число воспалительных клеток в бронхах, включая эозинофилы, Т-лимфоциты, тучные клетки, макрофаги и дендритные клетки [2]. Эти эффекты ГКС осуществляются путем уменьшения привлечения воспалительных клеток в бронхи вследствие угнетения факторов хемотаксиса, адгезивных молекул и уменьшения выживаемости в бронхах эозинофилов, Т-лимфоцитов и тучных клеток. Кроме того, ГКС оказывают действие и на структурные элементы бронхов – эпителиальные, эндотелиальные и гладкомышечные клетки, снижая продукцию ими провоспалительных медиаторов и цитокинов, уменьшая сосудистую проницаемость и воспалительный отек, а также угнетают продукцию мокроты слизистыми железами бронхов [3].
Молекулярные механизмы противовоспалительного действия ГКС связаны с их способностью активировать различные противовоспалительные и угнетать многие воспалительные гены, а также внегеномными эффектами.
ГКС диффундируют через клеточную мембрану, в цитоплазме связываются с глюкокортикостероидным рецептором-α и проникают в ядро после связывания с ядерным переносящим белком (импортин-α) [4]. Комплекс гормон–рецептор присоединяется к распознающему участку ДНК, т.н. ГКС-распознающему элементу в активаторной области стероид-отвечающего гена. В результате этого соединения происходит транскрипция гена при взаимодействии с транскрипционными активаторными молекулами, которые имеют внутреннюю гистоновую ацетилазную активность, ацетилируя лизины в гистоновом ядре, связанном с ДНК. Следствием этих процессов служит активация генов, кодирующих противовоспалительные медиаторы, такие как аннексин-1 (липокортин, ингибитор фосфолипазы А2), секреторный ингибитор лейкопротеаз, антагонист рецептора интерлейкина-1 и др., а также β2-адренергического рецептора. Этот механизм реализуется при использовании высоких доз ГКС. Другой механизм связан с деацетилированием гистоновых ядер и репрессией генов, кодирующих провоспалительные медиаторы и цитокины (гранулоциты/моноциты-колониестимулирующий фактор, циклооксигеназа-2, фактор некроза опухоли α, интерлейкин-1), и он реализуется при использовании ГКС в низких дозах [2].
Внегеномные эффекты ГКС связаны прежде всего с прямым взаимодействием комплекса гормон–рецептор в цитоплазме клетки с транскрипционными факторами: апопротеином-1 (АР-1) и ядерным фактором-κВ (NF-κB). Транскрипционные факторы активируются в клетке под воздействием воспалительных медиаторов (фактор некроза опухоли α, интерлейкин-1) и в свою очередь активируют провоспалительные гены, стимулируя синтез провоспалительных медиаторов. Связывание АР-1 и NF- κВ комплексом гормон–рецептор блокирует этот процесс и таким образом ГКС осуществляют противовоспалительное действие. Однако этот механизм по не известным пока причинам реализуется редко [4].
Создание ингаляционных ГКС (ИГКС) существенно улучшило комплаенс терапии и повысило эффективность лечения больных БА.
В настоящее время ИГКС остаются базисными препаратами в лечении больных БА, начиная с легкой персистирующей формы заболевания [1]. Считается, что все ИГКС в эквивалентных дозах обладают приблизительно одинаковой эффективностью в терапии БА. Однако исследования последних лет показали, что в реализации противовоспалительного действия ИГКС важную роль играют фармакокинетические/фармакодинамические свойства гормональных препаратов, а также устройства по их доставке в дыхательные пути [5]. Фармакокинетика характеризуется концентрацией лекарства в месте действия в течение определенного времени, а фармакодинамику оценивают по связи концентрации лекарства с его клиническим эффектом.
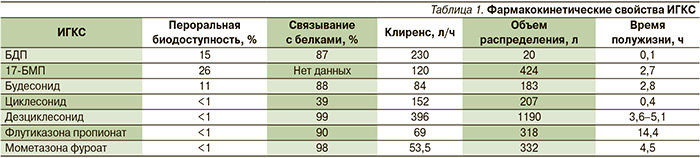
К важным фармакокинетическим и фармакодинамическим свойствам ИГКС относятся биодоступность при ингаляционном применении (количество препарата, поступившего в системный кровоток в процентах к введенной дозе); связывание с белками (доля препарата, связавшегося с белками крови и ставшего неактивным); клиренс, определяемый по объему крови, из которого препарат выводится за единицу времени; объем распределения, отражающий долю препарата во внесосудистом пространстве и характеризующий его липофиль-ность; период полужизни – время, за которое концентрация препарата в плазме крови уменьшается в 2 раза [5] (табл. 1).
Известно, что беклометазона дипропионат (БДП) и циклесонид являются пролекарствами и ингалируются в фармакологически неактивной форме, превращаясь в активные метаболиты под влиянием эстераз эпителиальных клеток легких: беклометазона-17-монопропионат (17-БМП) и дезциклесонид, причем в 17-БМП конвертируется 95% БДП, а в дезциклесонид превращается 100% циклесонида. Преимущественная локализация эстераз в легких приводит к очень незначительной активации этих молекул в ротоглотке и уменьшает риск развития там нежелательных эффектов ИГКС [5, 6].
Эффективность действия ИГКС в значительной степени зависит от сродства к рецепторам: чем выше сродство, тем меньшая концентрация лекарства нужна для получения терапевтического эффекта. Максимальным сродством характеризуются 17-БМП, дезциклесонид, флутиказона пропионат и мометазона фуроат (табл. 2).
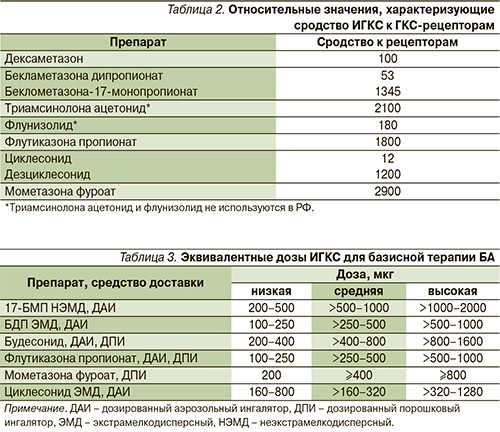
Противовоспалительный эффект ИГКС зависит не только от свойств молекулы препарата, но и от устройства доставки лекарства (аэрозольный ингалятор, порошковый ингалятор), размера ингалируемых частиц, умения пациента правильно использовать ингаляционное устройство. Так, появление устройств, производящих экстрамелкодисперсные аэрозоли (ЭМД ИГКС), имеющие средний аэродинамический диаметр частиц <2 мкм, позволило уменьшить эквивалентную дозу препарата (табл. 3), увеличив при этом долю лекарства, попадающего в мелкие дыхательные пути. В нашей стране такими препаратами являются циклесонид (Альвеско) и комбинация БДП с формотеролом (Фостер) [6, 8].
Клинический эффект ИГКС развивается постепенно и становится очевидным на 5–7-й день лечения. Начальная доза зависит от выраженности клинических симптомов БА и нарушения функции внешнего дыхания. Обычно эффект достигается при использовании средних доз ИГКС, которые пациент получает на протяжении не менее 3 месяцев с целью достижения стабильного контроля БА. После этого доза препарата может быть снижена (на 25–50%) до поддерживающей, которая сохраняется длительное время. При лечении с использованием ИГКС может быть достигнут полный контроль БА, но заболевание не излечивается, поэтому при прекращении применения ИГКС в подавляющем большинстве случаев симптомы болезни возвращаются [9].
При недостаточной эффективности лечения средними дозами ИГКС (полный контроль БА не достигнут) необходимо увеличить дозу препарата до высокой, но следует учитывать рекомендации GINA-2002, согласно которым, прежде чем увеличивать дозу ИГКС, необходимо добавить к терапии β2-адреноагонист длительного действия (салметерол, формотерол), что приводит к такому же эффекту, как и удвоение дозы ИГКС. В настоящее время в лечении больных БА широко используются комбинированные препараты, содержащие ИГКС и β2-адреноагонист длительного действия – Серетид, Симбикорт, Фостер, Форадил Комби, Тевакомб, Зенхейл.
Длительное применение ИГКС сопряжено с риском побочных эффектов, которые можно разделить на местные и системные.
К местным побочным эффектам относят орофарингеальный кандидоз, дисфонию, фарингит, рефлекторный кашель и парадоксальный бронхоспазм. Количество местных побочных эффектов уменьшается, если больной использует спейсер большого объема и тщательно полощет горло после ингаляции препарата [9]. Для лечения ротоглоточного кандидоза рекомендуется полоскание рта и горла с нистатином или амфотерицином В, сублингвальный прием нистатина [6]. При дисфонии рекомендуется использование минимальной дозы ИГКС, необходимой для контроля БА, или применение ИГКС, являющихся пролекарствами (БДП, циклесонид).
В результате длительного лечения высокими дозами ИГКС могут развиваться системные побочные эффекты: угнетение функции коры надпочечников [10], снижение минеральной плотности костной ткани [11], замедление линейного роста у детей [12], увеличение массы тела и склонность к образованию синяков [13]. Пациентам, длительное время получающим высокие дозы ИГКС, необходимо мониторировать уровень эндогенного кортизола, проводить костную денситометрию и офтальмоскопию с периодичностью в зависимости от возраста и от пола, но не реже чем 1 раз в 6–12 месяцев [6], и корригировать терапию ИГКС, а также осуществлять профилактику и лечение выявленных системных побочных эффектов. Показано, что клинический эффект высоких доз ИГКС выходит на плато (при дозе, эквивалентной 2000 мкг БДП), когда дальнейшее их увеличение дозы не приводит к повышению эффективности. В таком случае врачу приходится прибегать к использованию системных ГКС (СГКС).
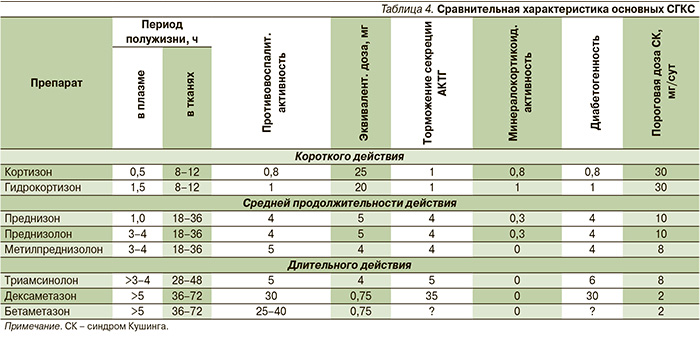
СГКС различаются по своей противовоспалительной активности, длительности действия (короткое, средней продолжительности и длительное), эквивалентным дозам и риску развития побочных эффектов (табл. 4).
В клинической практике при лечении больных БА с целью купирования обострения заболевания и в качестве поддерживающей терапии чаще всего используются преднизолон, метилпреднизолон и триамсинолон. Дексаметазон, обладающий мощным противовоспалительным действием, рекомендуется использовать для купирования обострения заболевания (астматического статуса) в течение 7–10 дней, но не для поддерживающей терапии из-за быстрого развития побочных эффектов: угнетения функции надпоечников и диабетогенного эффекта.
При длительной терапии пероральными ГКС могут использоваться следующие схемы:
- Непрерывная (ежедневный прием гормонов) – используется наиболее часто. При этом ⅔–¾ суточной дозы преднизолона назначают утром, ⅓–¼ – днем. Поддерживающая доза (5–10 мг) может приниматься однократно утром.
- Альтернирующая – предполагает прием обычно удвоенной поддерживающей дозы препарата однократно утром через день.
- Интермиттирующая – предполагает применение ГКС короткими курсами (по 3–4 дня) с 4-дневными интервалами между ними [14].
Необходимо помнить, что нельзя резко отменять лечение СГКС и при длительной терапии снижение дозы препарата до поддерживающей должно быть постепенным: по ½–¼ таблетки в 7–10 дней.
При длительном применении СГКС у большинства больных развиваются побочные эффекты, основные из которых: кушингоидный синдром, остеопороз (прежде всего позвонков), атрофия мышц, развитие катаракты, повышение артериального давления, задержка натрия, отеки, гипокалиемия, гипергликемия (развитие стероидного диабета), эрозивный гастродуоденит, угнетение функции надпочечников и др.
В связи с этим необходимо тщательное наблюдение за пациентами, получающими СГКС, с целью своевременно выявлять признаки развивающихся осложнений, осуществлять их профилактику и лечение.
В заключение хотелось бы напомнить один из афоризмов Гиппократа: «Для лечения самых сильных и опасных болезней нужны и самые сильные средства».



