ВИЧ-инфекция – инфекция, вызванная вирусом иммунодефицита человека (human immunodeficiency virus infection – HIV-infection). ВИЧ-инфекция – медленнопрогрессирующее антропонозное заболевание с контактным механизмом передачи, характеризующееся специфическим поражением иммунной системы (преимущественно Т-хелперов), в результате чего организм становится высоковосприимчивым к оппортунистическим инфекциям и опухолям, которые приводят к гибели больного [5].
Диагностика туберкулеза у больных ВИЧ-инфекцией
Подход к диагностике туберкулеза у ВИЧ-инфицированных лиц (взрослых и детей) не отличается от такового у неинфицированных. Однако эффективность такого подхода к лицам, живущим с ВИЧ, имеет ограничения по следующим причинам:
- Клинические проявления, схожие с таковыми туберкулеза легких, могут быть связаны и с другими вторичными заболеваниями, следовательно, менее специфичны для туберкулеза, чем у лиц с ВИЧ-негативным статусом.
- Туберкулиновые кожные пробы у ВИЧ-позитивных лиц при иммуносупрессии обладают меньшей чувствительностью, чем у ВИЧ-негативных.
- ВИЧ-инфицированные лица значительно чаще, чем ВИЧ-негативные, могут иметь заболевания легких, обусловленные несколькими причинами, что может маскировать ответ на противотуберкулезную терапию (ПТТ).
- У ВИЧ-инфицированных лиц рентгенологические изменения в легких при туберкулезе могут быть схожими с другими вторичными оппортунистическими заболеваниями, что затрудняет интерпретацию скиалогической картины специалистами лучевой диагностики.
- Туберкулез, развивающийся у пациентов при значительной иммуносупрессии (уровень CD4+-лимфоцитов менее 200 клеток/мкл), часто носит генерализованный характер с поражением нескольких систем.
- Большинство ВИЧ-инфицирован-ных детей заражаются вирусом перинатально. Поэтому максимальная распространенность ВИЧ-инфекции среди детей приходится на младенцев и детей до 5 лет, которые составляют возрастную группу, где наиболее сложно выяснить причину острого или хронического заболевания легких, в т.ч. и туберкулеза.
- У ВИЧ-инфицированных детей чаще встречаются другие хронические или острые легочные заболевания, чем у ВИЧ-негативных [6].
Все впервые выявленные больные ВИЧ-инфекцией должны быть обследованы на предмет исключения активного туберкулеза и латентной туберкулезной инфекции. Аналогичным образом всем больным туберкулезом должно быть проведено тестирование на ВИЧ.
Процесс диагностики включает несколько этапов [4]:
1. Отбор лиц с клинико-рентгенологическими признаками, подозрительными на туберкулез, осуществляется тремя способами:
1.1. Активно (при проведении планового флюорографического обследования у взрослых и массовой туберкулинодиагностики у детей). Больные ВИЧ-инфекцией являются медицинской группой риска по туберкулезу с показанием проведения подросткам и взрослым флюорографического обследования, а детям туберкулинодиагностики – 2 раза в год [7]. Однако по мере снижения числа CD4+-лимфоцитов (особенно когда их число менее 200 клеток/мкл) активное флюорографическое выявление туберкулеза органов дыхания теряет свою значимость. Это связано с тем, что манифестация и течение туберкулеза у больных ВИЧ-инфекцией значительно отличаются от его начала и течения у лиц с сохранной иммунной системой. Для туберкулеза на фоне ВИЧ-ассоциированной иммуносупрессии характерны пневмониеподобная клиническая картина, нередко острое начало, бурное и быстрое развитие заболевания. Кроме того, пропорционально степени иммунодефицита снижается туберкулиновая чувствительность.
1.2. Активный скрининг четырех клинических симптомов (приоритетное направление в выявлении туберкулеза у людей, живущих с ВИЧ): кашель, лихорадка, ночная потливость и потеря массы тела. Скрининг проводится при каждом обращении пациента за медицинской помощью в любое медицинское учреждение. В отсутствие всех обозначенных клинических симптомов наличие туберкулеза у больного ВИЧ-инфекцией с иммуносупрессией маловероятно. В свою очередь лица с положительными результатами скрининга должны пройти диагностическое обследование для выявления либо активного туберкулеза, либо другого заболевания.
1.3. При обращении за медицинской помощью в учреждения первичной медико-санитарной помощи.
2. Дообследование в учреждениях первичной медико-санитарной помощи:
2.1. Трехкратное исследование мокроты на наличие кислотоустойчивых микобактерий (КУМ).
2.2. Обзорная рентгенография органов грудной клетки.
2.3. Общий анализ крови.
2.4. При подозрении на внелегочную локализацию исследование любого диагностического материала на наличие КУМ.
3. Обследование в учреждениях противотуберкулезной службы. Обязательный диагностический минимум:
3.1. Лучевое рентгенологическое обследование. Рентгенография грудной клетки – цифровая или аналоговая.
Томографическое обследование (спиральная компьютерная томография – СКТ органов грудной клетки или линейные томограммы, необходимость и объем которых определяет рентгенолог с учетом рекомендаций фтизиатра). Проведение СКТ особенно оправданно для больных с глубокой иммуносупрессией (CD4+-лимфоциты менее 100 клеток/мкл) с подозрением на туберкулезный сепсис (в отсутствие изменений на рентгенограмме), а также при наличии диссеминации легочной ткани и внутригрудной лимфаденопатии.
3.2. Ультразвуковое исследование (УЗИ) органов брюшной полости.
3.3. Микроскопия (из 3 проб) и посев мокроты на твердые или жидкие питательные среды (из 2 проб) для выявления микобактерий, ПЦР-(полимеразная цепная реакция)-диагностика с возможностью определения лекарственной чувствительности как минимум к рифампицину, идентификация культуры, выросшей на питательных средах, определение чувствительности микобактерий туберкулеза к противотуберкулезным препаратам (ПТП).
3.4. Исследование числа CD4+-лимфоцитов и РНК ВИЧ (вирусной нагрузки ВИЧ) в крови в начале ПТТ.
3.5. Консультацию врача-инфекциониста для исключения вторичных заболеваний, а также для проведения дифференциальной диагностики туберкулеза с другими заболеваниями проводить как можно раньше.
3.6. Консультацию врача-инфекциониста для назначения или коррекции антиретровирусной терапии (АРВТ) проводить в плановом порядке после получения результатов иммунного статуса и вирусной нагрузки.
3.7. При подозрении на поражение центральной или периферической нервной системы у больного ВИЧ-инфекцией необходимо обеспечить консультацию врача-невролога.
3.8. Консультации других узких специалистов (психиатра, нарколога, ортопеда, окулиста и др.) осуществлять по показаниям, исходя из имеющихся клинико-лабораторных данных.
Если диагноз неясен, необходимо проводить следующие дополнительные методы исследования:
3.9. Инвазивные (по показаниям) для получения биоптата пораженной ткани с проведением комплексного поэтапного изучения биопсийного материала с обязательным проведением цитологического исследования; микроскопической оценки биоптата; гистобактериоскопии с окраской по Цилю–Нильсену. По возможности проводить молекулярно-генетические исследования для выявления ДНК микобактерий туберкулеза (МБТ) в нативном материале и из парафиновых гистологических блоков.
Неинвазивные:
3.10. СКТ или магнитно-резонансная томография (МРТ) головного мозга – показания к назначению определяет врач-невролог.
3.11. СКТ органов брюшной полости – показания к назначению определяет лечащий врач.
3.12. Объем обследования на вторичные заболевания определяет врач-инфекционист.
3.13. Остальные методы лабораторной и инструментальной диагностики (например, УЗИ, эхокардиографию, СКТ/МРТ позвоночника и т.д.) проводят по общим показаниям, исходя из имеющихся клинико-лабораторных данных.
3.14. Пробная противотуберкулезная тест-терапия (еx juvantibus). При подозрении на туберкулез и отсутствии достоверных маркеров специфического воспаления у больных ВИЧ-инфекцией в тяжелом состоянии назначать терапию еx juvantibus с применением четырех ПТП основного ряда с обязательным включением рифампицина или рифабутина. После получения всех результатов обследования представлять на врачебную комиссию для окончательного суждения о диагнозе и лечебной тактике.
Состояние должно быть расценено как «тяжелое» при наличии хотя бы одного из следующих четырех признаков: невозможность передвигаться без посторонней помощи, частота дыхания 30 в минуту и более, пульс 120 в минуту и более, лихорадка 39°С и выше. Тяжесть состояния у таких пациентов оправдывает назначение пробной ПТТ, не дожидаясь выполнения всего комплекса диагностических мероприятий с поиском достоверных признаков туберкулеза и/или альтернативных заболеваний на фоне проводимого лечения.
Лечение пациентов с туберкулезом и ВИЧ-инфекцией
Особенности лечения туберкулеза у больных ВИЧ-инфекцией. Лечение туберкулеза проводится врачом-фтизиатром совместно с врачом-инфекционистом, который назначает и проводит мониторинг (АРВТ), осуществляет консультативную помощь в диагностике и лечении других вторичных заболеваний [1, 2].
К основным принципам лечения туберкулеза у больных ВИЧ-инфекцией добавляются аспекты, имеющие принципиальное значение для успешного ведения этой сложной категории больных:
- совместное ведение больного фтизиатром и инфекционистом;
- своевременное назначение АРВТ;
- по показаниям проведение профилактики других вторичных заболеваний в период лечения туберкулеза;
- своевременная диагностика и адекватная терапия других вторичных заболеваний. Терапия больных сочетанной инфекцией включает ПТТ и АРВТ (назначение последней определяется количеством CD4+-лимфоцитов на момент развития туберкулеза), терапию и профилактику вторичных и сопутствующих заболеваний.
При выборе терапии туберкулеза, сочетанного с ВИЧ-инфекцией, важно оценивать:
- степень иммуносупрессии у больного;
- взаимодействие медикаментов, которые принимает больной, как антиретровирусных, так и противотуберкулезных;
- вероятность возникновения, выявление и коррекцию побочных эффектов;
- вероятность возникновения воспалительного синдрома восстановления иммунной системы – ВСВИС.
Противотуберкулезная терапия больных ВИЧ-инфекцией (режимы химиотерапии). Химиотерапия (ХТ) туберкулеза у больных ВИЧ-инфекцией должна быть начата в максимально ранние сроки после установления диагноза. Эмпирическое назначение ПТП при подозрении на туберкулез у больных ВИЧ-инфекцией оправданно в случае тяжелого состояния пациента.
Выбор режима основывается на данных анамнеза и спектра лекарственной устойчивости выделенного возбудителя [2, 3]. Из анамнеза имеет значение: лечился ли ранее пациент от туберкулеза, результаты теста лекарственной чувствительности (ТЛЧ) в предыдущих случаях лечения, исходы предыдущего лечения, контакт с больным туберкулезом. До получения результатов ТЛЧ важно правильно определить, относится ли пациент к группам высокого риска МЛУ-туберкулеза (туберкулез с множественной лекарственной устойчивостью возбудителя).
Группы высокого риска МЛУ-туберкулеза:
- заболевшие из достоверного контакта с больным МЛУ-туберкулезом;
- больные туберкулезом, ранее получавшие 2 и более неэффективных курсов ХТ туберкулеза;
- больные с рецидивом туберкулеза и другие случаи повторного лечения, если ранее у них была выявлена лекарственная устойчивость к одному из основных препаратов – изониазиду или рифампицину;
- больные с отрицательной клинико-рентгенологической динамикой процесса, а также с сохранением или появлением бактериовыделения на фоне контролируемого лечения по стандартным режимам ХТ;
- дети с остропрогрессирующими формами туберкулеза из контакта с больными, ранее получавшими два и более неэффективных курсов ХТ туберкулеза или умерших от туберкулеза в отсутствие результатов определения лекарственной чувствительности возбудителя.
В настоящее время нет убедительных доказательств, что удлинение сроков терапии более 6 месяцев улучшает результаты лечения больных ВИЧ-инфекцией. Однако ряд исследований показывает, что пролонгированное лечение (до 8–9 месяцев) все же более предпочтительно для этой категории больных. И прежде всего это связано с уменьшением числа рецидивов по сравнению с краткосрочной шестимесячной ХТ.
Не рекомендовано больным ВИЧ-инфекцией использование приема ПТП в интермиттирующем режиме, в т.ч. в фазе продолжения.
Режимы ХТ назначают на основании индивидуальных результатов определения лекарственной устойчивости возбудителя: I – при лекарственной чувствительности, II – при монорезистентности к изониазиду или полирезистентности, III – при эмпирическом назначении ПТП, IV – при МЛУ, V – при широкой лекарственной устойчивости (ШЛУ).
Режимы ХТ и комбинации ПТП Режимы ХТ представлены в таблице.
I режим ХТ назначают больным туберкулезом с лекарственной чувствительностью МБТ. При эмпирической терапии (до получения ТЛЧ МБТ) назначают III режим. Режимы включают 4 препарата первого (основного) ряда: изониазид, рифампицин или рифабутин, пиразинамид, этамбутол. При распространенном и полиорганном туберкулезе в интенсивной фазе к режиму может быть присоединен аминогликозид. Рифабутин назначают вместо рифампицина, если он предпочтителен с точки зрения взаимодействия с АРВТ.
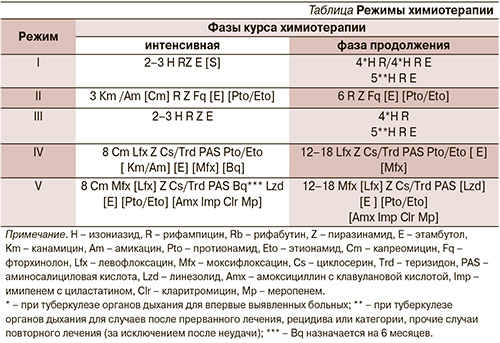
В фазе продолжения терапии назначают три основных препарата с обязательным включением изониазида, рифампицина или рифабутина. Основной курс лечения должен составлять не менее 9 месяцев. У больных туберкулезным менингитом, менингоэнцефалитом, костно-суставным и генерализованным туберкулезом длительность основного курса лечения должна составлять не менее 12 месяцев.
II режим ХТ назначают больным туберкулезом с лекарственной устойчивостью МБТ по крайне мере к изониазиду, но не к сочетанию изониазида и рифампицина по данным ТЛЧ на начало настоящего курса ХТ. Режим включает пять препаратов: рифампицин или рифабутин, пиразинамид, этамбутол, фторхинолон последнего поколения, аминогликозид (канамицин или амикацин) или капреомицин. Препараты, к которым имеется устойчивость микобактерий, больному не назначают, а режим формируется в интенсивной фазе лечения как минимум из четырех, а в фазе продолжения как минимум из трех препаратов, к которым чувствительность возбудителя сохранена. Основной курс лечения должен составлять не менее 12 месяцев.
IV или V режимы ХТ назначают больным туберкулезом при МЛУ или ШЛУ возбудителя. Подходы к терапии с таким видом лекарственной устойчивости практически не отличаются от таковых у больных без ВИЧ-инфекции. Ввиду лекарственных взаимодействий между антиретровирусными препаратами и кларитромицином применение последнего для лечения ШЛУ туберкулеза у больных ВИЧ-инфекцией, получающих АРВТ, не рекомендуется; IV режим ХТ должен состоять как минимум из 5 наиболее эффективных препаратов; IV режим ХТ обязательно должен включать аминогликозид или полипептид, левофлоксацин или моксифлоксацин, пиразинамид.
Длительность ХТ по режиму МЛУ–туберкулез/ВИЧ должна составлять не менее 18 месяцев. Длительность интенсивной фазы по МЛУ–туберкулез/ВИЧ-режиму должна составлять не менее 8 месяцев. IV режим ХТ может быть назначен без лабораторного подтверждения (стандартный), если достоверно известно, что был контакт с больным туберкулезом с МЛУ (множественная устойчивость у вероятного источника заражения должна быть документирована); больным туберкулезом, ранее получавшим 2 и более неэффективных курсов ХТ туберкулеза; больным с рецидивом туберкулеза и в других случаях повторного лечения, если ранее у больного была выявлена лекарственная устойчивость к одному из основных препаратов – изониазиду или рифампицину; больным туберкулезом в отсутствие клинического улучшения при проведении контролируемой ХТ по III режиму в течение 3 недель (при условии исключения ВСВИС).
Коррекция стартового эмпирического режима (III или IV режимы) лечения проводится после получения теста на лекарственную чувствительность. Если на фоне противотуберкулезного лечения в течение месяца по эмпирическому режиму без применения АРВТ наблюдается отрицательная клинико-рентгенологическая динамика, необходимо повторить тест на чувствительность ускоренным молекулярно-генетическим методом.
Дети с ко-инфекцией туберкулез/ВИЧ должны получать терапию, состоящую из комбинации четырех препаратов (изониазид, рифампицин/рифабутин, пиразинамид, этамбутол) в течение минимум 3 месяцев, затем трехкомпонентную терапию (изониазид+рифампицин/рифабутин+этамбутол/пиразинамид) в течение минимум 6 месяцев.
В режиме ПТТ рекомендовано использовать препарат группы рифампицина (рифампицин/рифабутин) весь курс лечения. Поэтому схема АРВТ у детей на период лечения туберкулеза должна быть скорректирована с учетом лекарственных взаимодействий с рифампицином или рифабутином.
При выявлении резистентного туберкулеза или при высоком риске МЛУ–туберкулеза ВИЧ-инфицированным детям и подросткам резервные ПТП могут назначаться по жизненным показаниям независимо от возраста пациента при условии согласия родителей ребенка или законного представителя.
Прогрессирование туберкулезного процесса за первые 3 месяца АРВТ (чаще в первый месяц) может быть связано с ВСВИС. Для дифференциальной диагностики ВСВИС и туберкулеза с МЛУ возбудителя необходимо применение ускоренных молекулярно-генетических методов выявления микобактерий и лекарственной устойчивости.
Хирургическое лечение туберкулеза
у больных ВИЧ-инфекцией. Экстренные и диагностические, а также плановые оперативные вмешательства по поводу туберкулеза и его осложнений проводят исходя из наличия показания, так же как и у больных с ВИЧ-негативным статусом, вне зависимости от степени иммуносупрессии пациента.
Антиретровирусная терапия больных ко-инфекцией
Сочетание ВИЧ-инфекции и туберкулеза обусловливает особый подход к назначению как противотуберкулезной, так и АРВТ. Лечение больных сочетанной патологией ВИЧ/туберкулез довольно сложно, поскольку больному необходимо принимать массу препаратов, между которыми существуют лекарственные взаимодействия.
Основной целью АРВТ служит увеличение продолжительности и сохранение качества жизни пациентов. Приоритетной задачей АРВТ, позволяющей добиваться этих целей, считается максимальное подавление размножения ВИЧ, что выражается в снижении вирусной нагрузки до неопределяемого уровня. Подавление репликации ВИЧ останавливает гибель CD4+-лимфоцитов, что приводит к восстановлению их популяции (рост числа CD4+-лимфоцитов в среднем на 100 клеток в мкл в год) и функциональной активности.
Характеристика схем АРВТ
В настоящее время АРВТ проводится по схемам т.н. высокоактивной терапии, т.е. пациенту одновременно назначают не менее трех антиретровирусных препаратов.
Предпочтительные схемы – схемы с доказанной вирусологической эффективностью, благоприятной переносимостью, экономически обоснованные, назначаемые большинству пациентов.
Альтернативные схемы – схемы с доказанной вирусологической эффективностью, хорошей переносимостью, которые назначают особым категориям пациентов или пациентам при наличии противопоказаний к использованию предпочтительных схем.
Приемлемые схемы – схемы, эффективность которых менее изучена или побочные эффекты выражены в большей степени по сравнению с предпочтительными или альтернативными схемами. Приемлемые схемы могут применяться только при невозможности (например, из-за непереносимости) применения предпочтительных и альтернативных схем.
Основные принципы АРВТ больных ко-инфекцией (ВИЧ-инфекция и туберкулез) практически не отличаются от рекомендаций больным только ВИЧ-инфекцией. Во всех случаях лечение начинают с ПТТ. Сроки начала АРВТ зависят от исходного количества CD4+-лимфоцитов. Больным ВИЧ-инфекцией и туберкулезом с низким числом CD4+-лимфоцитов (<100 клеток/мкл) АРВТ присоединяют через 2–3 недели после начала ПТТ (при хорошей переносимости ПТП).
Задержка начала АРВТ может приводить к возникновению новых вторичных заболеваний и даже к смерти больного. При исходном количестве CD4+-лимфоцитов 100–350 клеток/мкл АРВТ присоединяют как можно раньше (в течение первых 2 месяцев после начала ПТТ). При количестве CD4+-лимфоцитов >350 клеток/мкл назначают ПТТ, одновременно проводят контроль количества CD4+-лимфоцитов. Если на фоне лечения туберкулеза число CD4+-лимфоцитов становится < 350 клеток/мкл, назначают АРВТ. Кроме того, при прогрессировании туберкулезного процесса у больных ВИЧ-инфекцией (даже у больных при числе CD4+-лимфоцитов >350 клеток/мкл) целесообразно назначать АРВТ. После завершения терапии туберкулеза АРВТ рекомендуется всем больным ВИЧ-инфекцией (даже при количестве CD4+-лимфоцитов >500 клеток/мкл) с целью профилактики рецидива туберкулеза.
Детям с ко-инфекцией туберкулез/ВИЧ АРВТ назначается вне зависимости от степени иммуносупрессии. Для пациентов с показателем CD4+-лимфоцитов менее 50 клеток/мкл АРВТ должна быть начата в течение 2 недель после начала ПТТ, детям с большим количеством CD4+-клеток – в течение 2 месяцев. При начале АРВТ до развития туберкулеза терапию продолжать.
Лечение активного туберкулеза всегда клинически более важно, чем лечение ВИЧ-инфекции. Несмотря на то что таким больным показано одновременное лечение обеих инфекций, сначала рекомендуется начать лечение туберкулеза и отложить АРВТ хотя бы на 2 недели. Если ПТП хорошо переносятся, можно начинать АРВТ. Такие больные должны находиться под медицинским наблюдением, поскольку для них существует высокий риск развития ВСВИС и тяжелых побочных реакций на комбинированную терапию.
Особые рекомендации по назначению АРВТ имеются при развитии туберкулезного менингита/менингоэнцефалита у больных ВИЧ-инфекцией. Таким больным назначение АРВТ целесообразно отложить хотя бы на 2 месяца после начала ПТТ. Было замечено, что у таких пациентов при немедленно начатой АРВТ наблюдали больше тяжелых побочных эффектов и клиническое ухудшение по сравнению с началом АРВТ через 2 месяца после начала противотуберкулезного лечения. При этом раннее назначение АРВТ не улучшало показатели выживаемости среди больных туберкулезным менингоэнцефалитом.
Помимо показаний к началу АРВТ и сроков ее назначения для больных ВИЧ-инфекцией и туберкулезом серьезной проблемой является выбор оптимальной схемы АРВТ с учетом наличия лекарственных взаимодействий между антиретровирусными и ПТП.
При назначении рифамицинов (рифампицин и рифабутин) вместе с АРВТ необходимо обращать внимание на влияние назначаемых препаратов на ферменты системы цитохрома Р450. Так, рифамицины индуцируют активность ферментов системы цитохрома P450 (в первую очередь изофермента CYP3A4), которые осуществляют метаболизм таких препаратов, как ингибиторы протеазы и в меньшей степени ненуклиозидные ингибиторы обратной транскриптазы (ННИОТ), что приводит к снижению сывороточных концентраций этих АРВП. Индукция рифампицином фермента уридиндифосфат-глюкуронилтрансферазы вызывает снижение концентрации препарата ингибитора интегразы (RAL). В свою очередь ННИОТ, ингибиторы протеазы (ИП) и ингибиторы интегразы через тот же механизм повышают сывороточные концентрации рифампицина. Лекарственные взаимодействия могут приводить к снижению эффективности АРВП и повышению риска гепатотоксических реакций. При этом рифабутин обладает сопоставимой активностью с рифампицином по воздействию на МБТ, поэтому введение его в режим лечения больного ВИЧ-инфекцией более предпочтительно перед рифампицином.
Рекомендации по выбору АРВП для лечения больных ВИЧ-инфекцией, страдающих туберкулезом
Предпочтительная схема: зидовудин (или тенофовир или абакавир)+ламивудин или тенофовир/эмтрицитабин+эфавиренз (в стандартных суточных дозировках) при использовании рифабутина. При использовании рифампицина дозу эфавиренза увеличивают до 800 мг/сут при массе тела пациента >60 кг. Для удобства пациентов и повышения приверженности к лечению рекомендуется назначать комбинированные формы препаратов.
Альтернативные схемы: 3 НИОТ – нуклеозидные ингибиторы обратной трансферазы (зидовудин+ламивудин+абакавир) в стандартных дозах при исходном уровне РНК ВИЧ<100 тыс. копий/мл. Предпочтительно использовать комбинированную форму (зидовудин/ламивудин/абакавир – 1 таблетка 2 раза в сутки). Для больных с уровнем РНК ВИЧ>100 тыс. копий/мл эта схема менее эффективна, чем схема 2 НИОТ+ННИОТ (зидовудин+ламиву-дин+эфавиренз).
Два НИОТ (зидовудин+ламивудин в стандартных дозах)+невирапин 0,2 г 1 раз в сутки в течение 14 дней, далее по 0,2 г 2 раза в сутки (невирапин следует назначать женщинам при числе CD4+-лимфоцитов <250 клеток/мкл и мужчинам – <400 клеток/мкл).
В сочетании с рифампицином уро-вень невирапина в крови может быть ниже терапевтического, возможно также усиление гепатотоксичности препаратов.
Тенофовир (зидовудин)+ламивудин (в стандартных дозах)+ралтегравир в стандартных дозах при использо-вании в схеме ПТТ рифабутина и 0,8 г 2 раза в сутки при использовании рифампицина.
Пациентам с предшествующим опытом АРВТ: 2 НИОТ (зидовудин+ламивудин в стандартных дозах) + энфувиртид 90 мкг 2 раза в сутки подкожно или маравирок 0,3 г 2 раза в сутки при использовании в схеме рифабутина и 0,6 г 2 раза в сутки при использовании рифампицина.
Больным туберкулезом с исходно низким числом CD4+-лимфоцитов (<100 клеток/мкл) в качестве четвертого препарата к схеме АРВТ (2 НИОТ+ННИОТ или ИП) может быть добавлен энфувиртид 90 мкг 2 раза в сутки подкожно (в течение 6 месяцев).
При использовании в схеме АРВТ эфавиренза, ралтегравира или маравирока целесообразно заменить рифампицин на рифабутин в среднетерапевтической дозе (300–450 мг/сут).
При назначении в составе АРВТ ИП ВИЧ, усиленного ритонавиром, рифампицин необходимо заменить на рифабутин (150 мг/сут). Не рекомендуется одновременный прием рифампицина и ИП ВИЧ, усиленных или не усиленных стандартной дозой ритонавира.
При необходимости применения в составе схемы ПТТ препарата рифампицин и отсутствия возможности использования других вариантов схемы АРВТ (включающих 3 НИОТ, ННИОТ, ингибитор интегразы или антагонист рецепторов CCR5) в качестве приемлемого режима АРВТ пациенту может быть назначена схема АРВТ, включающая 2 НИОТ+лопинавир/ритонавир в двойной суточной дозе (800/200 мг 2 раза в сутки) или лопинавир/ритонавир в стандартной суточной дозе (400/100 мг 2 раза в сутки) с добавлением ритонавира в дозе 300 мг 2 раза в сутки.
При переключении с режима на основе рифампицина на рифабутин или на режим, не содержащий рифампицина, необходимо отложить не менее чем 2 недели начало АРВТ – так, чтобы эффект от рифампицина не влиял на активность АРВП.
Если необходимо в схеме ПТТ оставить рифампицин (например, для парентерального введения), увеличивают дозу эфавиренза до 800 мг/сут при массе тела пациента >60 кг, ралтегравира до 800 мг 2 раза в сутки (вне зависимости от массы тела), а препарата маравирок – до 600 мг 2 раза в сутки.



