Актуальность
Невынашивание беременности – одна из основных научно-практических проблем современной репродуктологии. Интерес к ней объясняется стабильно высокой частотой этой патологии (10–30%) во всех странах мира [1]. В настоящее время в России прерывается 15–20% желанных беременностей [2]. На долю недоношенных детей приходится 60–70% случаев ранней неонатальной смертности, 50% неврологических заболеваний, в т.ч. детский церебральный паралич, нарушений зрения (вплоть до слепоты), слуха (вплоть до глухоты), тяжелых хронических заболеваний легких [2]. Мертворождение при преждевременных родах наблюдается в 8–13 раз чаще, чем при своевременных.
Истмико-цервикальная недостаточность (ИЦН) – одна из частых причин недонашивания и невынашивания беременности, которая представляет собой недостаточность перешейка и шейки матки. ИЦН наблюдается у 0,2–2% в общей популяции беременных женщин и у 15,0–42,7% женщин, страдающих невынашиванием беременности.
Цель исследования: улучшить исходы родов у беременных женщин с ИЦН путем дифференцированного подхода к ее коррекции на основе разработанного алгоритма ведения беременности.
Материал и методы
В исследование были включены 106 беременных с явлениями ИЦН и угрозой преждевременных родов, которые составили 1-ю (проспективную) группу, и 50 пациенток, вошедших во 2-ю (ретроспективную) группу, находившихся на стационарном лечении в 2011 г. Пациентки обеих групп, включенные в исследование, были сопоставимы по возрасту, социальному положению, соматическому и гинекологическому статусам, а также по акушерским осложнениям.

Критерии включения в обе группы: диагностированная ИЦН, угрожающие преждевременные роды и отягощенный акушерский анамнез (преждевременные роды – ПР и самопроизвольные выкидыши в анамнезе). Критерии исключения: тяжелая экстрагенитальная патология, многоплодная беременность, врожденные пороки развития плода.
Критерии диагностики ИЦН во время беременности: укорочение шейки матки менее 25–20 мм и раскрытие внутреннего зева на 0,8 мм и более по данным ультразвукового исследования (УЗИ) в двух позициях – лежа и стоя [3–4] и размягчение и укорочение вагинальной части шейки матки при осмотре шейки матки в зеркалах и влагалищном исследовании, иногда – пролабирование плодного пузыря в цервикальный канал.
В ходе работы были использованы общеклинические (клинико-анамнестические, лабораторные), специальные (УЗИ, допплерометрия, кардиотокография), генетические, иммунологические и статистические методы исследования. Исходы родов для плода, течение раннего неонатального периода проанализированы у всех новорожденных.
Беременные женщины 1-й группы были ознакомлены с целью и методами исследования и дали письменное согласие на их включение в научное исследование.

Пациентки обеих групп были разделены на подгруппы в зависимости от полученного лечения (табл. 1).
В А подгруппе применялись пессарии доктора Арабин (Германия), выполненные из силикона, которые вводились в сроках от 22 до 32 недель при диагностике ИЦН и угрожающих ПР. В подгруппе Б применялся хирургический серкляж (наложение швов на шейку матки) по методу Любимовой–Мамедалиевой при сроках 16–20 недель по тем же показаниям. Пациенткам В-подгруппы выполнялась хирургическая коррекция ИЦН до 20 недель беременности, однако при развитии угрозы прорезывания и несостоятельности швов, а также при низком расположении плода лечение дополнялось введением акушерского пессария доктора Арабин в 22–23 недели беременности. Кроме того, во 2-й группе были шесть беременных с ИЦН, которым по тем или иным причинам коррекция не проводилась (подгруппа Г).
Перед проведением коррекции ИЦН в обеих группах проводилась санация родовых путей и токолитическая терапия (сульфат магния внутривенно капельно 8–10 г/сут в течение 3–5 дней до 20 недель беременности) или острый токолиз гексапреналином (по схеме после 20 недель беременности). Пациенткам 1-й группы острый токолиз проводился на фоне вагинального введения микронизированного прогестерона до 400 мг/сут.
В дальнейшем беременные 1-й группы получали базовую терапию препаратами магния и микронизированным прогестероном вагинально по 200 мг/сут до 36 недель. Во 2-й группе терапия угрозы ПР проводилась препаратами магния и гексапреналином (перорально).
В обсуждении результатов использована градация убедительности доказательств: 1a – систематический обзор рандомизированных контролируемых исследований (РКИ), 1b – отдельное РКИ, 2a – систематический обзор когортных исследований, 2b – отдельное когортное исследование, 3a – систематический обзор исследований случай–контроль», 3b – отдельное исследование случай–контроль, 4c – исследование серии случаев.
Результаты исследования
Анатомическая ИЦН в результате большого количества прерываний беременности (медицинские аборты и самопроизвольные выкидыши) выявлялась у 51,9% (43) беременных 1-й группы и 42% (21) – 2-й, для остальных пациенток ИЦН носила функциональный характер.
Изолированная ИЦН как причина ПР выявлялась у 17,9% (19) беременных, сочетание ИЦН с каким-либо одним фактором риска развития ПР определялась у 44,3% (47), а сочетание 2 и более факторов с ИЦН было выявлено у 37,8% (40) беременных 1-й группы.
Среди беременных 2-й группы сочетание нескольких факторов риска ПР и ИЦН встречалось в 42% (21) случаев, а изолированная ИЦН наблюдалась у 14% (7) пациенток.
Сочетание ИЦН с гиперандрогенией выявлено в 17% случаев у пациенток 1-й группы и у 20% – 2-й, при этом в большинстве случаев определялся смешанный характер гиперандрогении – у 9,4 и 12% пациенток соответственно.
Сочетание ИЦН с урогенитальными инфекциями определено в 12,3% случаев, при этом наиболее часто встречались бактериальный вагиноз, кандидоз, а также условно-патогенная бактериальная инфекция, выявляемая при исследовании бактериологического посева из цервикального канала (протей, энтеробактерии, кишечная палочка, клебсиелла, стафилококковая и стрептококковая инфекция и др.) в титре 103 и более.
Сочетание ИЦН с тромбофилией было выявлено у 16% (17) беременных в 1-й группе и 18% (9) – во 2-й (мутация Лейдена, мутация протромбина, мутация метилентетрагидрофолатредуктазы и плазменного фактора активатора ингибитора плазминогена).
После проведения коррекции ИЦН мы наблюдали всех пациенток 1-й группы на предмет осложнений течения беременности. Обращает на себя внимание их низкая частота и отсутствие тяжелых акушерских осложнений в виде синдрома задержки роста плода и преждевременной отслойки нормально расположенной плаценты. Это, вероятно, связано с тщательным наблюдением и адекватной терапией. Важно отметить, что наименьшая частота осложнений регистрировалась в подгруппе пациенток, в отношении которых применялся пессарий – плацентарная недостаточность и гестоз были в 3,0 и 5,7 раза реже по сравнению с подгруппами, где использовался серкляж и комбинированный метод соответственно, угроза преждевременных родов – в 3 и 10 раз соответственно.

Данные аналогичных наблюдений за беременными 2-й группы были недостоверны, поскольку оценивались эти пациентки ретроспективно.
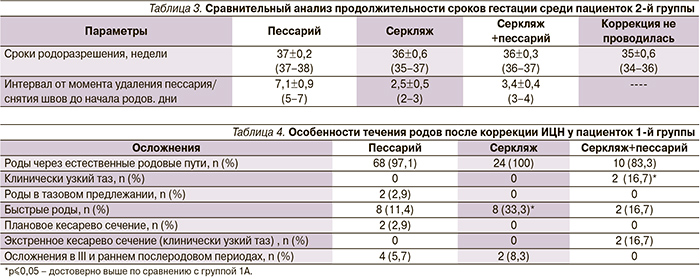
Сравнительный анализ продолжительности сроков гестации после коррекции ИЦН различными методами у пациенток 1-й группы представлен в табл. 2.
Из табл. 2 видно, что после применения пессария сроки родоразрешения приближаются к 40 неделям беременности, хотя удаляли пессарий и снимали швы в 37–38 недель у всех пациенток. Данный факт, вероятно, связан с разгружающим воздействием пессария, так что после его удаления до родов проходит еще 10–15 дней, когда предлежащая часть опускается, начинает «давить» на шейку матки и происходит «разворачивание» нижнего сегмента матки. Аналогичная ситуация выявлена и при применении комбинированного метода, при наложении же швов начало родов происходит в течение 3–5 дней после их снятия. Роды наступали позднее и у женщин, получавших прогестерон – во второй группе интервал от момента удаления пессария до родов был в 2 раза меньше по сравнению с первой (табл. 3).
Среди пациенток ретроспективной группы ПР произошли у 11 беременных, что составило 22% от общего числа, при этом в 6% (3) случаев имели место очень ранние ПР, в 10% (5) – ранние ПР.
Хотелось бы отметить, что ПР в сроке от 32 до 35 недель произошли у 5 (4,7%) пациенток 1-й группы, также был отмечен один случай ранних преждевременных родов (0,9%), что в совокупности составило лишь 5,6% от числа всех наблюдений, т.е. применение прогестерона в качестве базовой терапии способствовало пролонгиро-ванию беременности до доношенного срока у 94,4% беременных.
В ретроспективной группе, где применялся токолитик, 11 (22%) женщин родили преждевременно, из них ранние преждевременные роды были у 5 (10%) и очень ранние – у 3 (6%), таким образом, роды в срок произошли у 78% женщин.
При изучении особенностей течения родов у беременных 1-й группы (табл. 4) было выявлено, что частота быстрых родов и осложнений в III и раннем послеродовом периодах определена как существенно более высокая в подгруппе после хирургической коррекции ИЦН, чем у беременных после введения пессария, – число быстрых родов было в 3 раза выше, средняя продолжительность родов составила 6–9 часов (7,9±1,5 часа – при использовании пессария, 7,6±1,7 часа – серкляжа и 7,4±1,8 часа – серкляжа с пессарием), в целом происходило укорочение латентной фазы родов.
При изучении исходов родов для новорожденных после коррекции ИЦН среди пациенток 1-й группы существенных различий выявлено не было. Все дети родились с оценкой по шкале Апгар 8/9 баллов. Доля новорожденных с массой тела менее 2800 г в соответствующих подгруппах составила 2,9% (2), 8,3% (2) и 16,7% (2).
Однако при анализе частоты осложнений течения беременности, родов и послеродового периода после коррекции ИЦН различными методами (табл. 5) была выявлена более высокая частота травматизма шейки матки, преждевременных родов и послеродовых и перинатальных инфекционно-воспалительных осложнений у пациенток после наложения швов.
Обсуждение
Несмотря на хорошо разработанную систему балльной оценки риска ПР, у большинства женщин не удается выявить ни одного фактора риска вплоть до начала преждевременной родовой деятельности и единственным диагностическим критерием является измерение длины шейки матки, а также оценка внутреннего зева. При этом длина ее менее 25 мм, начиная от 16 недель гестации, служит предиктором ПР [5].
Исследования женщин с высоким риском развития ПР показали высокую чувствительность и высокую прогностическую ценность этого показателя (в популяции с высокой степенью риска 75% женщин имеют ПР), однако в группах с низким уровнем риска они не показали высокой чувствительности [6]. Визуализация пролабирования плодного пузыря за внутренний зев шейки матки является независимым фактором риска развития ПР [7–9].
С учетом вышеизложенных данных, а также нашего собственного опыта в качестве критерия начала лечения женщин с целью профилактики ПР нами была выбрана длина шейки матки 25 мм и менее, по данным УЗИ, а также состояние внутреннего зева шейки матки (его расширение более 0,8 мм), которые мы определяли у женщин с высоким риском ПР начиная с 15–16 недель беременности с интервалом в 2 недели.
Среди методов эффективной вторичной профилактики ПР с высоким уровнем доказательности в литературе указываются: использование цервикального пессария (1b) [10–13], назначение прегненов (1a) [14], скрининг и лечение инфекций (2a), в т.ч. бактериального вагиноза у беременных с ПР в анамнезе (2a) [1, 10] и внедрение антиникотиновых программ среди беременных (1a) [15].
Несмотря на большой опыт применения серкляжа, данные о его эффективности до сих пор противоречивы [16–17]. Неэффективно профилактическое использование токолитиков (1b) [18]. Использование пессария связано с более низким уровнем рождаемости – до 34 недель, чем при использовании прогестерона и серкляжа (3a) [11].
Указанные выше положения в полной мере подтверждаются результатами нашего исследования. Так, применение пессариев доктора Арабин оказалось эффективнее по сравнению с серкляжем и позволило пролонгировать беременность до сроков 39,9±0,4 недели против 38,2±0,5 соответственно у пациенток 1-й группы, получавших в качестве базовой терапии микронизированный прогестерон, по сравнению с 37,0±0,2 и 36,0±0,6 недели соответственно в группе беременных, получавших токолитик.
Кроме того, использование серкляжа связано с повышенной частотой несостоятельности швов (11,3% – в 1-й группе и 16% – во 2-й), что потребовало дополнительного вмешательства – введения пессария, а также более высокой частотой осложненного течения беременности.
При одноплодной беременности с укороченной шейкой пессарий способствует пролонгированию беременности за счет механического воздействия на маточно-шеечный угол (4с) [19]. При этом он снимает прямое давление на внутренний зев шейки матки [20].
В литературе подчеркивается, что при беременности двойное наложение швов на укороченную шейку матки, наоборот, повышает риск ПР и перинатальной смертности (3a) [17]. В то время как при многоплодной беременности наложение серкляжа не показано, при одноплодной – продолжает обсуждаться. Альтернативой серкляжу считают шеечный пессарий [20]. Отмечена высокая удовлетворенность пациенток этим методом [21], что также отмечено и среди пациенток, наблюдаемых в настоящем исследовании.
Возможное увеличение выделений из влагалища на фоне пессария не связано с повышением инфицированности [12]. Перфорированная модель пессария доктора Арабин (тип ASQ) обеспечивает лучший отток жидкости при повышенной вагинальной секреции предпочтительна для беременных женщин.
По данным мировой литературы, эффективно назначение прогестерона в группе высокого риска, который снижает риск повторных ПР на 35% (1a) [14].
Прогестерон и его производные неэффективны при многоплодной беременности (1b) [22].
На основании проанализированных нами случаев можно констатировать высокую эффективность применения нехирургической коррекции ИЦН в сочетании с вагинальным введением микронизированного прогестерона, замедляющего созревание шейки матки, поскольку в 94,4% родоразрешение беременных произошло в срок. При анализе сроков родоразрешения беременных 2-й группы этот показатель был достоверно ниже и составил 78% от общего числа родов. То есть комбинирование микронизиованного прогестерона в качестве базовой терапии с местными методами коррекции ИЦН позволило улучшить результаты на 16,4% и пролонгировать срок беременности на 2,7 недели.
Таким образом, нами был разработан алгоритм ведения женщин при высоком риске ПР: 1-й этап – мониторирование длины шейки матки с помощью УЗИ (в двух позициях) каждые 2 недели у женщин группы риска с 15–16 неделями беременности.
К беременным группы риска по невынашиванию были отнесены пациентки:
- имеющие в анамнезе выкидыши в поздних сроках, преждевременные роды, привычное невынашивание беременности;
- при наступлении беременности после продолжительного бесплодия;
- с нарушением функции яичников, генитальным инфантилизмом;
- с угрозой невынашивания настоящей беременности в сочетании с прогрессирующими изменениями шейки матки;
- после вспомогательных репродуктивных технологий;
- с многоплодной беременностью, в т.ч. после вспомогательных репродуктивных технологий;
- с угрозой прерывания настоящей беременности и измененными психоадаптационными реакциями в отношении завершения беременности.
2-й этап – выбор метода нехирургической коррекции у женщин с ИЦН функционального и органического генеза на основании показаний и противопоказаний к применению пессария.
Показаниями к применению пессария доктора Арабин служат: Укорочение шейки матки по данным УЗ-мониторинга (25 мм и менее и несостоятельность внутреннего зева – его расширением более 0,8 мм).
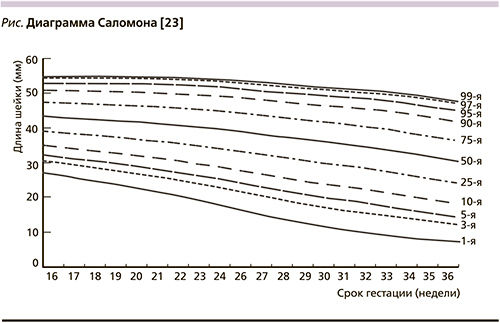
Для более точного определения нормальной длины шейки матки в соответствующие сроки беременности и ее укорочения рекомендуется использовать диаграмму Саломона [23] (см. рисунок).
2. Несостоятельность циркулярного шва при хирургической коррекции ИЦН.
Противопоказаниями к применению пессария доктора Арабин служат:
- Экстрагенитальные заболевания, при которых противопоказано пролонгирование беременности.
- Рецидивирующие кровянистые выделения из половых путей во II–III триместрах беременности.
- Выраженная степень ИЦН (пролабирование плодного пузыря) или нарушение его целостности.
При воспалительных заболеваниях влагалища, шейки матки, наружных половых органов необходима предварительная санация инфекции с последующим бактериологическим контролем.
3-й этап – выполнение нехирургической коррекции ИЦН на фоне базовой терапии микронизированным прогестероном.
Таким образом, представленная схема выбора методов профилактического лечения пациенток с угрозой ПР позволит добиться максимальных результатов.
Выводы
Комплексное лечение угрозы невынашивания беременности с использованием нехирургической коррекции ИЦН (пессарий доктора Арабин) в сочетании с вагинальным введением микронизированного прогестерона способствует пролонгированию беременности до 39–40 недель в 94,4% случаев.
Применение пессариев доктора Арабин в комбинации с базовой терапией позволяет пролонгировать срок беременности на 2,7 недели дольше по сравнению с серкляжем.
Обоснованный выбор метода коррекции ИЦН, рациональная этиотропная терапия с помощью медикаментозных средств, направленных на снятие симптомов угрозы прерывания и правильный подбор базовой терапии, способствуют снижению перинатальных потерь.


