За последнее десятилетие проблема урогенитальной инфекции находится в центре внимания многих исследователей и практикующих врачей. Прежде всего это обусловлено широким распространением различных форм вульвовагинальной и цервикальной инфекции, а также тем, что инфекция остается одной из ведущих причин материнской и перинатальной заболеваемости. При ее наличии повышается вероятность невынашивания беременности, растет риск анте- и интранатального инфицирования плода, развития гнойно-воспалительных осложнений в послеродовом периоде, поскольку нижние отделы генитального тракта таких пациенток являются резервуаром массы различных потенциально опасных микроорганизмов [1–3, 29]. Патогенетическое значение некоторых из них изучено уже достаточно хорошо, например Streptococcus agalactiae или анаэробных ассоциаций при бактериальном вагинозе [6, 9, 14, 29], роль других возбудителей пока не столь очевидна. За последнее время особый интерес представляют генитальные микоплазмы (ГМ), которые, по данным эпидемиологических исследований, часто обнаруживаются у женщин репродуктивного возраста: Ureaplasma spp. – 40–80%, Mycoplasma hominis – 5–49, Mycoplasma genitalium – 0,7–1% [4, 18, 20]. Однако истинное этиологическое значение этих микроорганизмов в развитии неблагоприятных исходов беременности и родов остается неопределенным до настоящего времени. Ряд авторов полагают, что ГМ при определенных условиях могут быть причастными к таким осложнениям беременности и родов, как преждевременное излитие околоплодных вод, преждевременные роды, рождение детей с низкой массой тела, послеродовый эндометрит [5, 10, 31, 32]. Другие исследователи высказывают абсолютно противоположное мнение, утверждая, что данные микроорганизмы – не более чем комменсалы, и не оказывают никакого неблагоприятного воздействия на течение беременности, родов и послеродового периода [14, 19, 21, 23]. Существует также мнение, будто определяющую роль в патогенезе неблагоприятного воздействия ГМ на мать, плод и новорожденного играет не столько сам факт обнаружения данных микроорганизмов в половых путях матери, сколько степень их колонизации. То есть чем выше концентрация ГМ, тем чаще происходят преждевременное излитие околоплодных вод, преждевременные роды, рождение детей с низкой массой тела, послеродовый эндометрит, увеличивается частота вертикальной передачи инфекции. Условным количественным значением, предполагающим развитие указанных осложнений, принято считать превышение концентрации 104 КОЕ/мл [4, 5, 27, 28].
 Однако основная проблема заключается в следующем: исследования, посвященные этой теме, в подавляющем большинстве случаев основываются на анализе небольших групп пациенток, имеют ретроспективный характер, а главное – не учитывают возможного патогенетического значения других условно-патогеннных микроорганизмов, присутствующих в нижних отделах генитального тракта беременных [8, 20, 15]. Выделение же ГМ в монокультуре (а именно это служит залогом объективности сделанных выводов) представляет значительные сложности, т.к. резко повышаются требования к объему проводимого исследования, а соответственно, и финансовые затраты.
Однако основная проблема заключается в следующем: исследования, посвященные этой теме, в подавляющем большинстве случаев основываются на анализе небольших групп пациенток, имеют ретроспективный характер, а главное – не учитывают возможного патогенетического значения других условно-патогеннных микроорганизмов, присутствующих в нижних отделах генитального тракта беременных [8, 20, 15]. Выделение же ГМ в монокультуре (а именно это служит залогом объективности сделанных выводов) представляет значительные сложности, т.к. резко повышаются требования к объему проводимого исследования, а соответственно, и финансовые затраты.
Целью настоящего проспективного исследования стало определение частоты обнаружения ГМ в нижних отделах генитального тракта во II–III триместрах беременности, а также уточнение роли данных микроорганизмов в развитии ряда осложнений беременности, родов и послеродового периода.
Материал и методы
Для решения поставленных задач проведено скрининговое обследование на наличие вульвовагинальной и цервикальной инфекции у 677 пациенток на сроке беременности 24–40 недель, наблюдавшихся в клинике акушерства и гинекологии Первого МГМУ им. И.М. Сеченова с февраля 2008 по май 2010 г.
Впоследствии 65 пациенток по разным причинам выбыли из исследования, 612 были родоразрешены. Использовались следующие лабораторные методы диагностики: микроскопия мазков из цервикального канала и заднего свода влагалища с окраской по Граму, бактериологическое исследование содержимого заднего свода влагалища и цервикального канала (культуральное исследование проведено с использованием питательных сред Acumedia Manufacturers, Inc., США: кровяной агар на основе колумбийского агара с добавлением 5% крови, среда Левина для идентификации грамотрицательных микроорганизмов, среда Сабуро с хлорамфинеколом и гентамицином, кровяной агар на основе бруцелла агара с добавлением ростовых факторов: гемина и витамина В6 для культивирования анаэробов) и молекулярно-биологическое (ПЦР – полимеразная цепная реакция в реальном времени) исследование материала из цервикального канала и заднего свода влагалища на наличие M. genitalium, M. hominis, Ureaplasma urealyticum, Ureaplasma parvum, Trichomonas vaginalis, Neisseria gonorrhoeae, Chlamydia trachomatis. При этом использовали ПЦР-тест системы «АмплиСенс® N. gonorrhoeae/C. trachomatis/M. genitalium/T. vaginalis-МУЛЬТИПРАЙМ-FL» с гибридизационно-флуоресцентной детекцией в формате реального времени производства ФГУН ЦНИИ эпидемиологии Роспотребнадзора на приборе Rotor-Gene 6000 (Corbett Research, Австрия), согласно инструкции производителя, «АмплиСенс® U. parvum/U. urealyticum/M. hominis-МУЛЬТИПРАЙМ-FL» с гибриди-зационно-флуоресцентной детекцией в формате реального времени производства ФГУН ЦНИИ эпидемиологии Роспотребнадзора на приборе Rotor-Gene 6000, согласно инструкции производителя.
Клинически оценивались частота преждевременных родов, преждевременного излития околоплодных вод, рождения детей с низкой массой тела (<2500 г), а также случаи проявления послеродовых инфекционных осложнений (послеродовый эндометрит, раневая инфекция).
Результаты исследования
Подводя итоги полученных результатов, следует прежде всего отметить высокую распространенность генитальной инфекции у беременных.
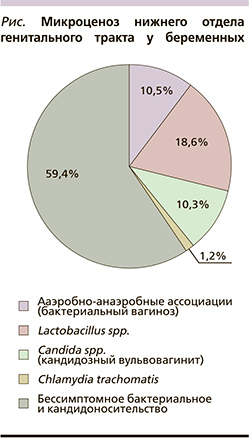
Из них бессимптомное бактериальное носительство (S. agalactiae, Enterobacteriaceae, Staphylococcus spp., ГМ и др. в титрах 102 –108 КОЕ/мл) и кандидоносительство (Сandida albicans в титрах 102–105 КОЕ/мл) выявлены у 402 (59,4%) пациенток (см. рисунок).
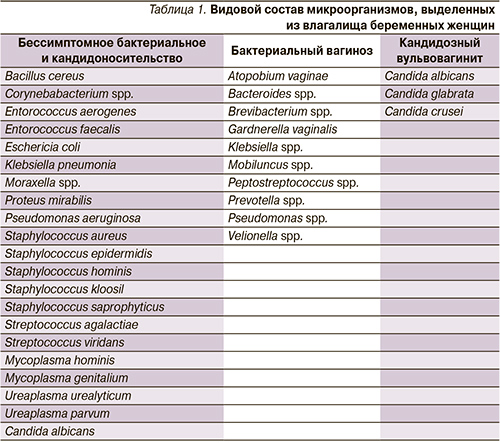
В 149 (22%) случаях отмечены различные клинико-лабораторные проявления вульвовагинальной и цервикальной инфекций (бактериальный вагиноз – 10,5%, кандидозный вульвовагинит – 10,3%, хламидийный цервицит – 1,2%). Гонорейная и трихомонадная инфекции не были обнаружены ни у одной из обследованных беременных женщин (табл. 1).
Генитальные микоплазмы выявлены у 304 пациенток, что составило 44,3%. В подавляющем большинстве при этом обнаружены U. parvum – 40,2%, U. urealyticum – 7,1%, M. hominis – 4,6%. M. genitalium встречалась лишь в 0,6% случаев (это было всего у 5 пациенток из 677). В 232 (76,3%) случаях у одной и той же пациентки обнаружено сразу несколько видов ГМ. Следует отметить, что у подавляющего большинства беременных ГМ в нижних отделах генитального тракта сочетались с другими условно-патогенными микроорганизмами, причем у 43 (14,1%) пациенток данные бактерии обнаружены на фоне наличия бактериального вагиноза, у 31 (10,2%) беременной – на фоне кандидозного вульвовагинита, а у 154 (50,7%) пациенток ГМ входили в состав микробных ассоциаций при бессимптомном бактериальном и кандидоносительстве. И только в 72 (10,6%) случаях данные бактерии были выделены в виде монокультуры или в сочетании только с Lactobacillus spp.
Выделение ГМ в монокультуре служит ключевым моментом в определении истинного этиологического значения этих микроорганизмов в неблагоприятных исходах беременности.
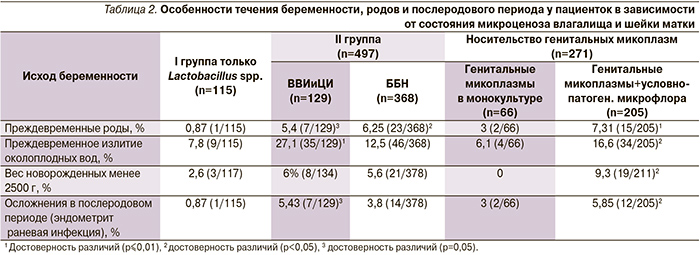
С целью уточнения истинного этиологического значения ГМ 612 родоразрешенных пациенток были разделены на 2 группы. В I группу были включены 115 беременных с нормальным состоянием влагалищной флоры (присутствие во влагалище только Lactobacillus spp.) и исключенной специфической инфекцией; II группу составили 497 пациенток с наличием во влагалище и цервикальном канале различных условно-патогенных микроорганизмов, включая ГМ, и дрожжеподобные грибы в различных титрах. В данной группе было выделено две подгруппы: 129 беременных с клиническими проявлениями вульвовагинальной и цервикальной инфекций (ВВИиЦИ) и 368 – с бессимптомным бактериальным и кандидоносительством (S. agalactiae, Enterobacteriaceae, Staphylococcus spp., Gardnerella vaginalis, С. albicans, Bacteroides spp. и др.) (ББиКН). Отдельно была выделена группа, которую составила 271 обследованная женщина с носительством ГМ в нижних отделах генитального тракта; в группе выделено 2 подгруппы: 66 – с выявленными ГМ в виде моноинфекции и 205 – с сочетанием микоплазм с другими условно-патогенными микроорганизмами (S. agalactiae, Enterobacteriaceae, Staphylococcus spp., G. vaginalis, С. albicans, Bacteroides spp. и др.; табл. 2).
При анализе течения беременности, родов и послеродового периода у пациенток, прошедших скрининговое обследование, обнаружено значительное возрастание частоты ряда осложнений в группе беременных с наличием во влагалище и цервикальном канале бактерий и дрожжеподобных грибов в различных титрах (табл. 2).
Так, по сравнению с группой обследованных пациенток с нормальным состоянием микроценоза нижнего отдела генитального тракта в подгруппах с вульвовагинальной, цервикальной инфекциями и бессимптомным бактериальным носительством:
- в 3–4 раза возрастает частота преждевременного излития околоплодных вод, в 5–6 раз увеличивается число преждевременных родов;
- в 2–3 раза возрастает число детей, рожденных с низкой массой тела <2500 г;
- в послеродовом периоде в 6–7 раз увеличивается распространенность послеродового эндометрита и раневой инфекции.
В подгруппе пациенток с наличием ГМ в виде монокультуры каких-либо статистически значимых различий в развитии вышеуказанных осложнений беременности, родов и послеродового периода по сравнению с группой беременных с нормальным состоянием влагалищной среды не выявлено.
С целью уточнения не только качественной, но и количественной роли (степени колонизации) ГМ в развитии осложнений беременности, родов и послеродового периода все обследованные пациентки с носительством данных микрорганизмов в нижних отделах генитального тракта дополнительно были разделены на две подгруппы: 65 пациенток с низкой концентрацией (≤104 КОЕ/мл) ГМ и 206 – с высокой концентрацией (>104 КОЕ/мл) данных микро-организмов в половых путях матери (табл. 3).
В данных подгруппах статистически значимых различий в частоте выявления преждевременных родов, преждевременного излития околоплодных вод, рождения детей с низкой массой тела (<2500 г), послеродового эндометрита и раневой инфекции не наблюдалось.
В данном исследовании была проведена оценка вертикальной передачи ГМ от матери к новорожденному, основанная на скрининговом молекулярно-биологическом (ПЦР в реальном времени) исследовании соскобов из зева новорожденных от матерей с подтвержденной лабораторными методами микоплазменной инфекцией во время данной беременности. Частота внутриутробного инфицирования ГМ составила 8,8%: U. parvum – 7,3%, U. urealyticum – 1,5%; случаев вертикальной передачи M. hominis и M. genitalium не отмечено. Причем инфицирование новорожденных наблюдается в 4 раза чаще у пациенток с высокой степенью колонизации данными микроорганизмами (>104 ГЭ/мл) нижнего отдела генитального тракта (табл. 3). Однако достоверной причинно-следственной связи между носительством ГМ у новорожденных и повышенным риском развития инфекционно-воспалительных заболеваний перинатального периода не выявлено независимо от их количественного титра (табл. 3).
Обсуждение
В повседневной практике, проводя обследование беременных на вульвовагинальную инфекцию, акушеры-гинекологи основываются прежде всего на результатах микроскопии влагалищного мазка. Развернутое бактериологическое исследование с количественным и качественным определением аэробных и анаэробных микроорганизмов производится крайне редко.
Полученные нами результаты скринингового исследования показали, что только у 18,6% беременных во влагалище были лактобактерии в виде монокультуры (т.е. «идеально» нормальная микрофлора). В остальных 81,4% случаев обнаружено либо бессимптомное носительство различных условно-патогенных микроорганизмов (59,4%), либо уже клинико-лабораторные проявления вульвовагинита и/или цервицита (22%). При этом бактериальный вагиноз диагностирован в 10,5% случаев, кандидозный вульвовагинит – в 10,3, хламидийный цервицит – в 1,2%. Эти показатели несколько ниже, чем в большинстве ранее проведенных эпидемиологических исследований (в 12 – 20%, в 20 – 35, в 8–9% соответственно) [3, 6], что отчасти можно объяснить высоким социально-экономическим уровнем обследованных нами пациенток и тщательным медицинским наблюдением во время беременности.

ГМ в нижних отделах генитального тракта беременных были представлены достаточно широко – в 44,9% случаев: U. parvum – 40,2%, U. urealyticum – 7,1, M. hominis – 4,6, M. genitalium – 0,6%, что в целом соответствует данным мировой литературы [6, 22, 23, 30].
Однако по полученным нами результатам в подавляющем большинстве случаев ГМ входят в состав микробных ассоциаций, а в монокультуре или в сочетании только с Lactobacillus spp. обнаруживаются редко – 10,6% случаев. Именно это обстоятельство становится ключевым в определении истинного этиологического значения ГМ в развитии ряда осложнений беременности, родов и послеродового периода.
Результаты проведенного исследования убедительно подтверждают тот факт, что вульвовагиниты и цервициты служат существенным фактором риска преждевременного излития околоплодных вод, преждевременных родов, рождения детей с низкой массой тела (<2500 г), а также послеродового эндометрита и раневой инфекции. Несколько неожиданной стала тенденция приближения частоты вышеуказанных осложнений беременности в группе пациенток с бессимптомным бактериальным носительством к частоте таковых в группе беременных с клинически выраженными формами вульвовагинальной и цервикальной инфекции.
Очевидно, отсутствие клинических проявлений инфекции не всегда является залогом нормального течения беременности, родов и послеродового периода, а бессимптомное бактериальное носительство в нижних отделах генитального тракта у беременных остается серьезной проблемой, требующей дальнейших углубленных исследований.
ГМ, как уже было отмечено, широко представлены в составе микробных ассоциаций как при выраженных формах вульвовагинальной и цервикальной инфекции (25,7%), так и при бессимптомном бактериальном носительстве (50,7%). Очевидно, что именно это обстоятельство позволяет многим экспертам предполагать их возможную роль в развитии рассматриваемых осложнений беременности, родов и послеродового периода [7, 11, 15, 18]. Однако, по полученным нами данным, в подгруппе пациенток с носительством ГМ в виде моноинфекции частота преждевременного излития вод, преждевременных родов, рождения детей с низкой массой тела, послеродового эндометрита и раневой инфекции была примерно такой же, что и в группе с нормоценозом влагалища и исключенной специфической инфекцией.
Следует также обратить внимание на следующее: степень колонизации нижних отделов генитального тракта данными микроорганизмами не играет сколько-нибудь значимой роли в развитии осложнений беременности, родов и послеродового периода. За исключением частоты вертикальной передачи инфекции, которая несколько возрастает при высокой концентрации ГМ у матери. Таким образом, ГМ как моноинфекция существенного значения в патогенезе неблагоприятных исходов беременности и родов, очевидно, не имеют. В первую очередь это касается наиболее часто встречаемых U. parvum, U. urealyticum и M. hominis. M. genitalium обнаруживается значительно реже: по нашим данным, в 0,5% случаев. Доказано ее этиологическое значение при негонококковых уретритах у мужчин [6, 4, 12, 16, 18], возможно, при слизисто-гнойных цервицитах и воспалительных заболеваниях органов малого таза у женщин [4, 16, 17]. Наши результаты и немногочисленные данные литературы [4, 18–20, 24] пока не позволяют говорить о каком-то неблагоприятном влиянии M. genitalium на течение беременности и родов. Однако редкость обнаружения этого микроорганизма не дает возможности сделать окончательный вывод и в этом отношении, по-видимому, потребуются дополнительные исследования.
Заключение
Колонизация нижних отделов генитального тракта беременных условно-патогенными микроорганизмами – существенный фактор риска преждевременных родов, преждевременного излития околоплодных вод, рождения детей с низкой массой тела (<2500 г), послеродового эндометрита и раневой инфекции.
ГМ (U. parvum, U. urealyticum, M. hominis) в составе микробных ассоциаций достаточно часто (44,9%) обнаруживаются во влагалище и цервикальном канале в III триместре беременности. Однако существенного значения в патогенезе неблагоприятных исходов беременности, родов и послеродового периода они, очевидно, не имеют в не зависимости от степени колонизации нижнего отдела генитального тракта.
Неблагоприятное влияние M. geni-talium на течение беременности и родов пока не определено.


