Распространенность хронических болевых синдромов в популяции пожилых людей увеличивается, а эффективность терапии боли снижается [1, 3, 14, 22, 26]. «Старые добрые» анальгетики, эффективно купировавшие боль в молодости, перестают «работать» в старости, вызывая обиду и недоверие к производителям лекарственных средств и врачам, а увеличение дозировок лишь усугубляет побочные эффекты, приводя к серьезным осложнениям. Лечение пожилого пациента с болью имеет ряд особенностей по сравнению с терапией молодых больных и является одной из актуальнейших проблем нейрогериатрии.
Предполагается, что биологическое старение служит результатом естественного процесса накопления повреждений: соматических мутаций, метилирования ядерной и митохондриальной ДНК, окисления и изменения пространственной конфигурации белков, приводящих к ускорению процессов апоптоза (гибели клеток). Существующие в организме антиоксидантные и другие защитные системы стараются бороться с вышеуказанными повреждениями, и различия скорости старения у разных организмов являются результатом разной эффективности этой борьбы. Предполагается участие эволюционно-генетических механизмов старения: антагонистической плейотропии и снижения способности клеток к делению в связи с утратой теломер на концах хромосом после определенного количества делений [18, 19]. У пациентов с хроническими болевыми синдромами, находящимися в условиях эмоционального стресса, размер теломер также укорачивается по сравнению с контрольной группой без боли и стресса, что свидетельствует о том, что боль и стресс ускоряют процесс старения. Физиологические изменения, которые происходят в нервной системе человека с возрастом, выражаются в снижении плотности серого вещества головного и спинного мозга вследствие апоптоза, дефиците нейромедиаторных систем, гипоталамо-гипофизарной недостаточности, приводящей к гормональному дисбалансу и прогрессирующему нарушению всех видов обмена. Возрастные изменения в биологических системах, ответственных за восприятие и подавление боли (ноцицептивной и антиноцицептивной) приводят к тому, что хроническая боль в старческом возрасте становится более сложным, чем у молодых людей, клиническим, биологическим, физиологическим состоянием [14, 26]. Показано, что восприятие в таких сенсорных системах, как слух, вкусовые ощущения, обоняние, зрение и осязание, с возрастом уменьшается вследствие снижения числа специфических периферических рецепторов. В периферических нервах отмечается уменьшение миелинизированных и немиелинизированных волокон [24], а также их валлеровское перерождение. Число и размер сенсорных нейронов в ганглиях задних корешков также уменьшаются. Возрастное уменьшение числа периферических волокон, наличие демиелинизации и признаков нейрогенного воспаления напоминают патологические изменения при полиневропатиях [14, 16, 20, 27, 31]. В этом заключается сходство между нейроанатомическими изменениями, лежащими в основе невропатической боли у молодых пациентов и возрастными изменениями в ноцицептивной системе пожилых людей. В обоих случаях развивается генерализованная дисфункция периферических и автономных нервных волокон, проявляющаяся снижением скорости проведения возбуждения по нерву и уменьшением вегетативных реакций (например, колебаний сердечного ритма на гипервентиляцию или пробу Вальсальвы). Снижение или отсутствие ахилловых рефлексов и уменьшение или потеря вибрационной чувствительности в стопах после 70 лет считаются нормой, в то время как у молодых пациентов это первый клинический признак полиневропатии. По мере прогрессирования утраты периферических волокон развивается гипестезия всех видов чувствительности (преимущественно температурной, болевой и вибрационной, позднее присоединяется снижение тактильного и суставно-мышечного чувства) в стопах и голенях, снижение функции сфинктеров, парезы в стопах и голенях, а также вегетативно-трофические расстройства. Через некоторое время в отсутствие патогенетической терапии присоединяются чувствительные и двигательные нарушения в руках (сначала в кистях, затем прокcимальнее). Субъективные симптомы у пациентов могут появляться при любой степени неврологических и электрофизиологических нарушений, а могут не появляться вообще. Выделяют негативные и позитивные симптомы. К негативным, отражающим функциональную недостаточность периферических нервов, относят снижение чувствительности, сенситивную атаксию, гипорефлексию, мышечную слабость и атрофию, вегетативные (импотенцию, гастропарез, атонию кишечника, ортостатическую гипотензию) и тазовые (недержание мочи, кала, кишечных газов) нарушения. К позитивным симптомам относят парестезии («мурашки», покалывание), чувство стянутости, онемение, боль (стреляющую, жгучую, саднящую, глубокую ноющую), аллодинию, болезненность при пальпации конечностей в зоне «носков и перчаток» (статическую гипералгезию). К позитивной моторной симптоматике относят крампии (болезненные судороги в икроножных мышцах). Позитивная симптоматика служит клиническим проявлением процессов сенситизации ноцицептивной системы и центральной дезингибиции, лежащих в основе развития хронической боли.
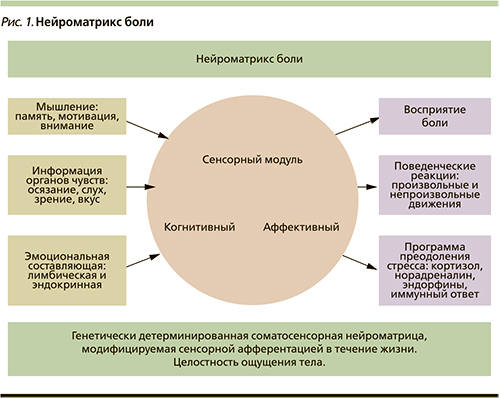
Отмечается сходство патофизиологических (клеточных и молекулярных) механизмов, ответственных за развитие патологических состояний хронической боли и биологического процесса старения [19, 25]. Наблюдаются синергичные изменения экспрессии нейротрансмиттеров и рецепторов в спинном мозге при старении и хронической невропатической боли. Считается, что возрастные изменения чувствительности могут быть результатом нейропластических изменений на уровне заднего рога, а также функционального нарушения нисходящих модулирующих путей антиноцицептивной системы. На клеточном уровне при старении выявлены молекулярно-генетические механизмы, влияющие на функционирование сенсорных нейронов, например возрастное снижение экспрессии генов, кодирующих нейротрофические факторы, нейропептиды, внутриклеточные мессенджеры, митохондриальные белки, а также ионные каналы и рецепторы мембран [29]. Иммуногистохимические исследования выявляют уменьшение экспрессии основных нейромедиаторов ноцицептивной системы: кальцитонин-ген-родственного пептида, субстанции Р, оксида азота и соматостатина в клетках задних рогов спинного мозга. С возрастом нарастает уменьшение плотности и функциональной активности глиальных клеток спинного мозга (астроцитов и микроглии), осуществляющих трофическую и регуляторную функцию на сегментарном уровне. Эти патофизиологические возрастные изменения приводят к нарушению «воротного контроля» боли на спинальном уровне [22, 29]. Вместе с тем наблюдаются изменения в нисходящих модулирующих путях антиноцицептивной системы: выявляется прогрессивная потеря серотонин- и норадренергических частей в заднем роге в процессе старения [20]. Уменьшение числа опиоидных рецепторов и снижение активности опиоидергических центров антиноцицептивной системы, вероятно, также приводят к возрастным изменениям в обработке и восприятии ноцицептивной информации на центральном уровне [15]. Изменяется работа нейроматрикса боли (рис. 1).
Теория нейроматрикса была предложена Рональдом Мелзаком в 1999 г. как дополнение разработанной им же полвека назад теории воротного контроля боли [21]. Нейроматрикс представляет собой обширную сеть нейронов, образующих функциональные петли между задними рогами спинного мозга, структурами ствола, таламусом, префронтальной, сенсорной и моторной корой, подкорковыми экстрапирамидными ядрами, гипоталамо-гипофизарным комплексом и гиппокампально-лимбической системой. Основные синаптические связи в этой нейронной сети генетически детерминированы и составляют материнскую «матрицу», генерирующую, воспроизводящую и модулирующую сенсорную информацию, обеспечивая целостность восприятия схемы тела. Нейронные петли дивергируют, т.е. расходятся в пространстве и формируют три основных компонента нейроматрикса – три «нейромодуля», в которых происходит одновременная параллельная обработка афферентных импульсов.
Нейромодули соответствуют трем главным психологическим компонентам болевого ощущения:
- сенсорно-дискриминативному (сенсорный);
- аффективно-мотивационному (аффективный);
- оценочно-познавательному (когнитивный).
Обработка данных в нейромодулях завершается конвергенцией информации, взаимодействием между ними и формированием конечного результата — нейросигнатуры (непрерывного исходящего из нейроматрикса потока импульсов, обеспечивающего оценку афферентации, ее осознание, осмысление и накопление опыта).
Афферентные потоки импульсов, обрабатываемые в болевом нейроматриксе, условно подразделяются на:
- сенсорные (исходящие из органов чувств, причем не только из соматосенсорной системы, но и из зрительного анализатора, органов слуха, вкуса, обоняния и т.д.);
- эмоционально-аффективные (изменения гомеостаза, гормонального и эмоционального фона): гипогликемия (голод) повышает болевой порог, а депривация сна, тревога и катастрофизация снижают. При снижении степени социализации (одиночестве) болевой синдром у пожилых больных нарастает, а при получении социальной эмпатии снижается [23];
- когнитивные (включая предшествующий болевой опыт, мотивационные особенности).
Именно поэтому пациенты, имевшие печальный опыт неподготовленных движений без адекватной аналгезии при обострении боли в спине, могут начать испытывать боли уже при попытке запрограммировать или представить себе мыслеобраз этого движения (этот феномен называется «кинезиофобия»).
Афферентные потоки соответствуют основным модулям нейроматрикса и с точки зрения нейроанатомии прямо не пересекаются: их взаимодействие возможно только в условиях формирования вторичных и третичных ассоциативных корково-подкорковых, корково-корковых и межполушарных связей в нейромодулях нейроматрикса.
В результате «продуктами» активности нейроматрикса (т.н. нейросигнатурами) становятся:
- восприятие боли как отрицательной эмоции;
- поведенческие и двигательные (сокращение или повышение тонуса мышц, дистонии, гиперкинезы, усиление физиологического тремора и т. д.) реакции;
- эндокринно-иммунные сдвиги, вызывающие соматические реакции.
Хотя нейроматрикс генетически детерминирован, он модифицируется во времени благодаря сенсорному опыту и обучению. Именно поэтому болевой синдром флуктуирует во времени. Важная характеристика нейроматриксной теории заключается в предположении, согласно которому паттерны нейросигнатур запускаются не только сенсорной афферентацией, но и центрально (эндогенно) независимо от периферической ноцицепции. Это объясняет усиление боли без видимых механических причин в ответ на эмоциональный стресс, изменение иммунного статуса и/или гормонального фона. Боль как «продукт деятельности» нейроматрикса может изменять структуру его анатомических составляющих. Показано, что при хронической боли в спине происходит атрофия серого вещества коры головного мозга в теменной области, таламусе и заднем роге в сегментах спинного мозга, соответствующих локализации боли. Это происходит вследствие чрезмерного выделения в этих структурах глутамата – нейромедиатора ноцицептивной системы, запускающего процессы эксайтотоксичности и апоптоза. Вместе с тем после устранения источника ноцицепции на периферии (например, при удалении грыжи межпозвоночного диска, вызвавшей хроническую радикулопатию) происходит восстановление утраченного объема серого вещества головного и спинного мозга, что опровергает известный постулат, будто нервные клетки не восстанавливаются [12].

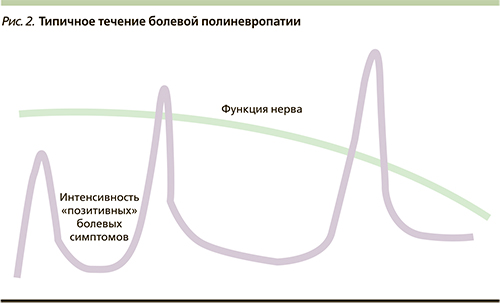
Грань, отделяющая физиологическую боль от патологической, достаточно условна и во многом определяется физическим и психическим состоянием человека. Степень ответных реакций организма и характер испытываемой боли во многом определяются не только самим повреждением, но и индивидуальным опытом человека, его отношением к повреждению. Так, одно и то же раздражение болевых рецепторов (ноцицепторов) в одних условиях может вызвать нестерпимую боль, в других – оказаться незамеченным. Главная особенность болевого синдрома пожилых пациентов – флуктуация болевой («позитивной») симптоматики на фоне медленнопрогрессирующего поражения нервных волокон, усугубляющего «негативные» симптомы невропатии (рис. 2).
Некоторые из связанных с болью защитных реакций (например, психомоторное возбуждение, повышение артериального давления, рвота, гиперкоагуляция, гипергликемия) способны вызывать угрожающие жизни последствия для пожилых больных с тяжелыми коморбидными заболеваниями (табл. 1). Это переводит проблему лечения боли из разряда улучшающих качество жизни в разряд жизнеспасающих мероприятий [3].
К основным факторам риска тяжелых соматических осложнений у пожилых пациентов с хроническими болевыми синдромами относятся сердечно-сосудистые заболевания, которые усугубляются проявлениями периферической вегетативной недостаточности: постоянной умеренной тахикардией и фиксированным пульсом, ортостатической гипотензией, безболевой ишемией (приводящей к бессимптомным инфарктам миокарда), хроносемантическим нарушением в виде дисбаланса циркадных ритмов. Периферическая вегетативная недостаточность (ВН) у пожилых повышает риск возникновения фатальных аритмий, осложнений при анестезии в виде неожиданной остановки дыхания и сердцебиения, а также увеличивает риск тромбоэмболических осложнений при хирургических вмешательствах. Одним из первых признаков, позволяющих заподозрить вегетативную недостаточность при полиневропатиях у молодых больных, а также у пожилых пациентов считается развитие тахикардии покоя, связанной с поражением блуждающего нерва при относительном преобладании активности симпатического отдела вегетативной нервной системы [28]. По мере прогрессирования ВН снижается активность симпатического отдела, что может сопровождаться исчезновением тахикардии. На этой более тяжелой стадии ВН отмечается отсутствие тахикардии даже в ответ на функциональные пробы (см. ниже) – выявляется «денервированное сердце» [7].
Для проведения начальной диагностики ВН наиболее широкое распространение получил метод пяти стандартных тестов по Ewing [13]:
- Изменение частоты сердечных сокращений (ЧСС) при медленном глубоком дыхании (6 в минуту). Наблюдаемое в норме ускорение ЧСС на вдохе и урежение на выдохе исчезают по мере прогрессирования недостаточности парасимпатической иннервации сердца. Разница между минимальной и максимальной ЧСС в 10 ударов и менее свидетельствует о нарушении парасимпатической иннервации сердца (N>5).
- Тест Вальсальвы. При повышении внутрилегочного давления (пациент натуживается – дыхание в мундштук, соединенный с манометром, с целью поддержания давления в спирометре на уровне 40 мм рт.ст. в течение 10–15 секунд). В норме ЧСС увеличивается с последующей компенсаторной брадикардией. При нарушении парасимпатической регуляции сердечной деятельности этот феномен выпадает. Отношение величины максимального R-R-интервала в первые 20 секунд после пробы к минимальному интервалу R-R во время пробы менее 1,2 свидетельствует о наличии у больного ВН.
- Тест Шелонга (ортостатическая проба). Пациент спокойно лежит на спине в течение 10 минут, после чего измеряется АД. Затем пациент встает, и АД измеряется на 2-й, 4-й, 6-й, 8-й и 10-й минутах. Снижение АД на 30 мм рт.ст. и более считается патологическим и свидетельствует о ВН с нарушением симпатической иннервации (N<10 мм рт.ст.).
- Тест 30:15. Тест основан на учащении ЧСС при вставании с максимальным значением к 15-му удару с последующим урежением ритма с минимальным значением к 30-му удару. Отношение 15-го R-R-интервала к 30-му с момента начала вставания при ортопробе ниже 1 является диагностическим критерием ВН (N>1,04).
- Проба с изометрической нагрузкой. При сжатии динамометра в течение 3 минут до трети максимальной силы руки отмечается подъем ДАД. Повышение ДАД менее чем на 10 мм рт.ст. говорит о ВН с недостаточной симпатической иннервацией (N>16 мм рт.ст.).
Использование данных тестов считается достаточным для выявления раннего субклинического поражения вегетативной нервной системы, и они используются как «золотой» стандарт для диагностики ВН. Для более точной оценки степени поражения вегетативной нервной системы может использоваться усовершенствованный вариант диагностики ВН – количественное вегетативное тестирование (КВТ).
В основе КВТ лежит методика регистрации и оценки высокочастотных дыхательных колебаний сердечного ритма, представляющая собой исследование вариабельности ритма сердца, выполняемое синхронно глубокому дыханию частотой 6 дыхательных циклов в минуту. При такой частоте дыхания в наибольшей степени стимулируется блуждающий нерв, поэтому проба используется для оценки реактивности парасимпатического отдела вегетативной нервной системы. Количественно оценивается разница между максимальной и минимальной ЧСС во время дыхательного цикла или экспираторно-инспираторное отношение.

Проявления ВН затрагивают оба эфферентных звена вегетативной нервной системы – симпатические и парасимпатические нервные волокна, однако с учетом более раннего и более значимого поражения парасимпатических нервных волокон при полиневропатиях у пожилых больных количественную оценку состояния вегетативной нервной системы при ВН целесообразно проводить именно по низкочастотному компоненту вариабельности сердечного ритма. Обладая высокой чувствительностью и селективностью, методика КВТ позволяет диагностировать ВН уже на доклиническом этапе и количественно определять степень вегетативного дефицита, что особенно важно для контроля эффективности лечения. КВТ может использоваться для раннего выявления дисфункции тонких волокон при полиневропатиях наряду с такими современными методами объективной диагностики, как конфокальная микроскопия, биопсия кожи с подсчетом плотности интраэпидермальных волокон и контактные тепловые (или лазерные) вызванные потенциалы [1, 7].
Установление причинно-следст-венной связи между вышеуказанными молекулярными и анатомическими изменениями спинного мозга и периферических нервов, приводящими к дисбалансу ноцицептивной и антиноцицептивной систем, отвечающих за восприятие боли, служит одной из главнейших задач для исследования боли и возраста, решение которых будет означать значительный вклад в развитие новых терапевтических мероприятий.
В соответствии с общепринятыми Европейскими рекомендациями по лечению невропатической боли (табл. 2), выбор симптоматического лечения обусловливается этиологической причиной возникновения болевого синдрома [1, 6].
Важно понимать механизм действия основных групп препаратов, используемых для лечения невропатической боли [1, 6].
1. Антидепрессанты. Ингибиторы обратного захвата моноаминов повышают концентрацию медиаторов в синапсах антиноцицептивной системы, продукция которых при старении мозга снижается [20]. Таким образом, эти препараты у пожилых пациентов активируют антиноцицептивную систему и подавляют проведение боли. Из них наименее селективны трициклические антидепрессанты (ТЦА) – амитриптилин и имипрамин, зато они обладают наибольшей анальгетической способностью. Важно отметить, что анальгетический эффект ТЦА проявляется уже в первые дни лечения, в то время как антидепрессивный – через несколько недель или месяцев применения. К тому же «анальгетическая» дозировка амитриптилина в несколько раз меньше «антидепрессивной» (соответственно 50–75 и 150 мг и выше). Однако, несмотря на низкие дозы, спектр побочных действий у ТЦА (обусловленные антихолинергическим действием: сухость во рту, тошнота, рвота, повышение внутриглазного давления, запор, задержка мочеиспускания; обусловленные адренергическим действием: тахикардия, аритмии, ортостатическая гипотензия, а также выраженные седативный эффект и головокружение) весьма широк, что ограничивает применение этих препаратов лицами пожилого возраста. Антидепрессанты двойного действия – селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН) – венлафаксин, дулоксетин и милнаципран показали высокую анальгетическую активность при невропатических болях различной этиологии, сопоставимую с таковой ТЦА, при этом спектр побочных эффектов СИОЗСиН значительно меньше, чем у ТЦА за счет отсутствия у них антихолинергического действия, но все же наличие у пожилых больных гипертонической и ишемической болезни сердца является противопоказанием к назначению им СИОЗСиН. Селективные ингибиторы обратного захвата серотонина (СИОЗС) – сертралин, флуоксетин, пароксетин – не вызывают столь выраженных побочных эффектов, как ТЦА и СИОЗСиН, но и анальгетическая активность большинства СИОЗС при хронических болевых синдромах оказалась существенно ниже. Исключение составляет эсциталопрам (Ципралекс), показавший в двойных слепых контролируемых исследованиях достоверную анальгетическую эффективность, не зависящую от наличия у пациента психических проявлений депрессии и не уступающую СИОЗСиН при более высоком профиле безопасности.
2. Антиконвульсанты. Блокируя натриевые каналы на мембранах нервных волокон, противосудорожные (карбамазепин, ламотриджин) и антиаритмические (мексилетин) препараты снижают возбудимость нейронов ноцицептивных структур. Это приводит к тому, что болевая импульсация перестает генерироваться ядрами задних рогов спинного мозга и волокнами черепно-мозговых нервов (тройничного, языкоглоточного и др.).
В большей степени регрессу подвергаются пароксизмальные стреляющие боли, парестезии и гипералгезии. Причем более выраженный анальгетический эффект наблюдается при лечении краниальных невралгий, чем болей в нижней части тела. Однако выраженный седативный эффект, головокружение и атаксия, возникающие вследствие неселективности подавления активности натриевых каналов (изменяется функциональная активность структур головного мозга, не вовлеченных в процессы патологической алгогенной гипервозбудимости) на фоне приема антиконвульсантов, могут настолько снижать качество жизни пожилых пациентов в первые дни приема, что они нередко вынуждены отказываться от лечения. И хотя со временем эти побочные эффекты значительно ослабевают или полностью регрессируют, терапия блокаторами натриевых каналов у пожилых больных не всегда возможна.
Лучший профиль переносимости отмечен у габапентиноидов: габапентина (Конвалиса) и прегабалина – жирорастворимых аминокислот, по химическому строению схожих с эндогенным тормозным медиатором γ-аминомасляной кислотой (ГАМК) – нейротрансмиттером, участвующим в передаче и модуляции боли. В основе развития различных видов спонтанной и стимулзависимой боли у пожилых больных лежат механизмы, связанные с растормаживанием генерации болевой афферентации на уровне задних рогов спинного мозга и таламуса, т.е. сенситизация алгогенных структур ноцицептивной системы. Именно эти процессы и являются «мишенью» для патогенетического воздействия Конвалиса, который не только значимо уменьшает выраженность болевого синдрома, но и не снижает качество жизни больных, т.к. частота побочных эффектов при его применении минимальна.
Конвалис обладает рядом биохимических свойств, позволяющих воздействовать на патогенез хронического невропатического болевого синдрома: взаимодействие с α2-δ2-субъеди-ницами потенциалзависимых Са2+-каналов и торможение входа ионов Са2+ в нейроны – таким образом снижается гипервозбудимость клеточных мембран, уменьшается сенситизация ноцицептивных нейронов; увеличивается синтез ГАМК (продукция которой с возрастом снижается [14, 15, 22]), что стимулирует активность глутамат декарбоксилазы – это приводит к повышению активности антиноцицептивной системы; ингибирование синтеза глутамата (возбуждающего нейромедиатора, к тому же обладающего эксайтотоксичностью) ведет к снижению возбудимости структур ноцицептивной системы и предотвращению гибели нейронов; модуляция активности NMDA(N-methyl-D-aspartate)-рецепторов воздействует на процессы формирования «болевой памяти».
Наркотические анальгетики (фентанил, бупренорфин) и синтетические опиоиды (трамадол, буторфанол) блокируют проведение боли на уровне задних рогов спинного мозга, воздействуя через сегментарные и нисходящие ингибиторные нейроны желатинозной субстанции, а также подавляя высвобождение альгогенного нейромедиатора – субстанции Р. Целесообразность использования наркотических анальгетиков для лечения невропатической боли продолжает оставаться дискуссионной – анальгетическая эффективность этих препаратов существенно выше при ноцицептивной боли, а выраженные побочные эффекты (когнитивные нарушения, атаксия, нарушение перистальтики желудочно-кишечного тракта, зуд, усугубление сонных апноэ за счет угнетения дыхательного и сосудодвигательного центра и т.д.) и развитие лекарственной зависимости ограничивают их применение в лечении невропатических болевых синдромов. Для паллиативного лечения паранеопластических болевых синдромов применяются трансдермальные системы с медленным высвобождением наркотических анальгетиков.
3. Местные анестетики. Трансдер-мальные системы анестезии (пластыри и гели с 2,5- и 5 %-ным содержанием лидокаина), как и антиконвульсанты, оказывают анальгетическое воздействие за счет блокады натриевых каналов, но уже на уровне периферических ноцицепторов. Препараты наносят местно на кожу в области боли и гипералгезии. Данный вид анальгезии у пожилых больных наиболее безопасен. Из острых побочных эффектов помимо аллергических реакций может наблюдаться раздражение кожи в области нанесения; чаще оно незначительное и быстро проходит. Если площадь зоны невропатической боли не очень большая и находится в доступном для использования анестетика месте, применение лидокаина в большинстве случаев помогает купировать боль при периферических невропатических болях, таких как диабетическая полиневропатия, опоясывающий герпес, постмастэктомические боли, комплексный регионарный болевой синдром. Продолжительность действия трансдермальных систем с лидокаином составляет примерно 12 часов, что необходимо учитывать в отношении пациентов с аллодинией при удалении с кожи крепко приклеенного, но утратившего анальгетический потенциал пластыря. При наличии аллодинии это бывает весьма болезненно.
4. Агонисты ваниллоидных рецепторов подавляют активность периферических ноцицепторов за счет селективной стимуляции тонких немиелинизированных С-волокон периферических нервов, вызывающей высвобождение в концевых терминалях субстанции Р и других алгогенных нейротрансмиттеров. Последовательное истощение запасов субстанции Р приводит к уменьшению болевой афферентации в центральной нервной системе и десенситизации ваниллоидных рецепторов. Однократное местное применение 8%-ного капсаицина в виде трансдермальной системы (Кутенза) на 1 час эффективно на срок до 3 месяцев в лечении локализованной невропатической боли, например при постгерпетической невралгии, не вызывая при этом у пожилых больных системных побочных эффектов. Усиление болевого синдрома на время аппликации (60 минут) трансдермальной системы с капсаицином можно купировать наложением грелки со льдом или нестероидными анальгетиками, в тяжелых случаях – опиоидными анальгетиками.
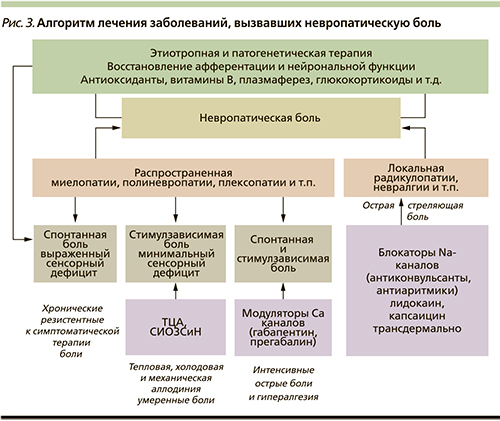
Клинические особенности заболевания, вызвавшего хроническую боль у пожилых пациентов, определяют симптоматическую терапию (рис. 3) Так, невропатическая боль при распространенных поражениях периферической нервной системы (полиневропатии, множественные мононевропатии и плексопатии) чаще уменьшается при применении антидепрессантов если у больного преобладает аллодиния, а антиконвульсанты – блокаторы кальциевых каналов (Конвалис) более эффективны в случае преобладания спонтанной жгучей, стреляющей боли. Для пациентов с локальным поражением (радикулопатии, мононевропатии) более эффективными оказываются блокаторы натриевых каналов – лечение тригеминальной, языкоглоточной и прочих невралгий рекомендуется начинать с карбамазепина или окскарбазепина. Назначение комбинации из двух и более симптоматических препаратов, по-разному воздействующих на механизмы формирования невропатической боли, целесообразно только при резистентных к монотерапии невропатических болевых синдромах [1, 6, 8] ввиду возможности усугубления побочных эффектов у пожилых больных.
Применение симптоматической анальгетической терапии пожилых больных имеет ряд особенностей [1, 3]:
Путь введения препарата должен быть наименее инвазивным: парентеральные пути введения не дают преимуществ по безопасности со стороны желудочно-кишечного тракта, зато чреваты инфекционными осложнениями (абсцессами, флебитами) в местах введения.
Предпочтительно применение анальгетиков с быстрым наступлением эффекта и коротким периодом полувыведения для предотвращения кумуляции препарата.
Лечение необходимо начинать с минимальных доз препарата, постепенно ее увеличивая; следует избегать высоких доз препаратов и их длительного применения; комбинировать между собой средства для симптоматической терапии боли целесообразно лишь при резистентности болевого синдрома к монотерапии.
При необходимости длительного применения антиконвульсантов, антидепрессантов и нестероидных противовоспалительных средств рекомендуется периодически мониторировать побочные эффекты (желудочно-кишечные кровотечения, функцию печени и почек, артериальную гипертензию и гипергликемию).
В случае когда пожилому больному купируется только болевой синдром без улучшения функции нерва, исчезновение боли как сигнала опасности не побуждает пациента продолжать лечение, что в итоге приводит к усугублению сенсомоторных и вегетативно-трофических нарушений (вплоть до формирования контрактур и трофических язв с последующим развитием гангрены и ампутацией конечностей, а также кардиальной автономной невропатии, приводящей к фатальным нарушениям ритма, ортостатической гипотензии и нарушениям мозгового кровообращения). Изолированное лечение боли без восстановления функции периферических нервных волокон (патогенетической терапии) в конечном итоге приводит к утяжелению дефицитарных расстройств и развитию осложнений основного заболевания [1, 4, 6].
Применение симптоматической терапии невропатической боли целесообразно сочетать с этиотропной терапией основного заболевания, приведшего к развитию болевого синдрома и повреждению периферической нервной системы, а также с патогенетической терапией периферической невропатии. Для патогенетической терапии невропатий в зависимости от преобладающих механизмов поражения нервов также могут применяться антиоксиданты (тиоктовая кислота – Октолипен), витамины группы В (Комбилипен, Комбилипен табс), ингибиторы холинестеразы (неостигмина метилсульфат, ипидакрин), ацетил-L-карнитин. Целью применения патогенетической терапии при невропатических болевых синдромах служит не только уменьшение боли, но и восстановление функции пораженных нервов, что позволяет рекомендовать ее как базовое лечение пожилых пациентов. Патогенетическая терапия характеризуется одновременным улучшением всех основных проявлений невропатии, как ее симптомов, так и клинических/физиологических показателей пораженных нервов [1, 6].
Роль окислительного стресса при физиологическом старении нервной системы и в развитии периферических невропатий считается одной из ведущих [4, 14, 18]. Естественным в связи с этим выглядит применение для патогенетического лечения невропатий у пожилых пациентов препаратов, обладающих антиоксидантным действием (α-липоевой кислоты), которые доказали как эффективность, так и безопасность в ходе ряда двойных слепых рандомизированных плацебо-контролируемых исследований [2, 7, 10, 30]. Для активации регенеративных процессов в периферических нервах используются нейротропные комплексы, содержащие большие дозы витаминов группы В (В1 В6, B12).
Отечественным препаратом, содержащим комплекс витаминов группы В в лечебных дозировках, является Комбилипен®, который выпускается в двух формах: инъекционной и таблетированной. Комбилипен® – инъекционный комплекс витаминов группы В, содержащий витамин В1(100 мг), В6 (100 мг) и В12 (1 мг). Комбилипен® табс – таблетированный комплекс витаминов группы В, содержащий высокоэффективный витамин В1-бенфотиамин (100 мг), В6 (100 мг) и В12 (2 мкг). Препарат может применятся как по «ступенчатой» схеме (Комбилипен® 2 мл 1 раз в сутки в течение 10 дней с дальнейшим переходом на на таблетированную форму Комбилипен® табс 1–3 таблетки в сутки в течение 4 недель), так и с использованием одной из форм.
Одновременное применение тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) влияет на стимуляцию аксоплазматической части транспорта структурных элементов мембраны или миелиновой оболочки, например холина. Тиамин способствует ремиелинизации через активацию фосфолипазы-A, что усиливает гидролиз эфиров жирных кислот, кроме того, посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, что особенно важно для восстановления трофической функции нерва у пожилых больных. Пиридоксин участвует в синтезе транспортных белков и сфингозина – структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонина, норадреналина). Цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Применение витамина В12 способствует не только ремиелинизации (за счет активации реакции трансметилирования, обеспечивающей синтез фосфатидилхолина мембран нервных клеток), но и снижению интенсивности болевого синдрома, что связано с собственным антиноцицептивным действием высоких доз цианокобаламина. Таким образом, нейротропные комплексы витаминов группы В улучшают скорость проведения нервного импульса, улучшают репаративные процессы в периферическом нерве. Наивысшую доказательную базу антиоксиданты и витамины группы В имеют в лечении неврологических осложнений сахарного диабета и алкоголизма, тем не менее их потенциал в лечении других нозологических форм поражения периферической нервной системы требует дальнейшего изучения.
Имеются данные о целесообразности использования ацетил-L-карнитина в патогенетическом лечении периферических невропатий. Антихолинэстеразные препараты (АХЭП) также используются в терапии поражения периферических нервов.
В основе механизма их действия лежит блокада калиевой проницаемости мембраны и обратимое ингибирование холинэстеразы, что приводит к стимулирующему влиянию на проведение импульса в нервно-мышечном синапсе. Обладая полисинаптическим действием, ипидакрин оказывает влияние как на пре-, так и на постсинаптические звенья передачи импульса, а с влиянием на проницаемость мембраны для натрия можно связать и анальгезирующие свойства этого препарата при невропатической боли [1, 5].
Иногда начало патогенетической терапии приводит к усилению болевого синдрома вследствие усиления периферической афферентации по регенерирующим нервным волокнам, причем болевой синдром при монотерапии АХЭП или антиоксидантами регрессирует медленнее, чем при симптоматической терапии трициклическими антидепрессантами, СИОЗСиН или антиконвульсантами, поэтому при выраженном невропатическом болевом синдроме лечение невропатической боли целесообразно начинать с назначения комбинированной патогенетической и симптоматической обезболивающей терапии с последующей отменой симптоматической терапии по мере купирования болевого синдрома.
Наличие у больных невропатиями вегетативно-трофических нарушений (например, трофических язв) может обусловливать добавление к комбинированному лечению препаратов, способствующих регенерации тканей и антибактериальной терапии, а при сопутствующей макроангиопатии и ретинопатии – фибратов. Наличие ортостатической гипотензии может ограничивать применение трициклических антидепрессантов и требовать добавления симптоматической терапии. Для терапии ортостатической гипотензии используют минералокортикоиды (флудрокортизон ацетат в дозе 0,1–1,0 мг/сут). К препаратам второго ряда, применяемым в качестве дополнительной терапии ВН при неэффективности флудрокортизона или в качестве монотерапии при невозможности его назначения, относят синтетические аналоги вазопрессина (десмопрессина ацетат, лизин-вазопрессин), эритропоэтин, кофеин. Особенно важно для пожилых больных с ВН рациональное использование антигипертензивных лекарственных средств.
Для пожилых пациентов наиболее безопасны нефармакологические методы коррекции ортостатической гипотензии:
- медленное, постепенное изменение положения тела;
- избегание напряжения, натуживания и изометрических упражнений;
- использование компенсаторных физических упражнений;
- сон с приподнятым головным концом;
- диета с высоким содержанием натрия (поваренной соли);
- специально разработанные комбинезоны, сдавливающие нижнюю часть тела.
К основным задачам лечения пожилых пациентов с болевыми синдромами относится наиболее ранняя диагностика поражения периферической и вегетативной нервной систем, если это возможно, назначение этиотропной терапии с параллельным симптоматическим лечением боли («позитивной» симптоматики) и улучшение функциональных показателей периферических нервов патогенетической терапией (рис. 3). Контроль эффективности лечения должен включать как оценку симптомов и клинических проявлений заболевания, приведшего к развитию болевого синдрома, так и измерение объективных параметров функций нервов – электронейромиографию, количественное сенсорное и вегетативное тестирование. При лечении невропатий рекомендуется проведение нейрофизиологических исследований через 3 месяца после начала патогенетической терапии. В случае нормализации объективных показателей функции периферических нервов и вегетативной иннервации патогенетическое лечение невропатии и ВН можно приостанавливать. Контроль неврологического дефицита у таких пациентов должен проводиться не реже одного раза в год для решения вопроса о необходимости повторного проведения патогенетической терапии.



