Особенности течения рака молочной железы с тройным негативным фенотипом
Рак молочной железы (РМЖ) является гетерогенным заболеванием, неоднородным по прогнозу и чувствительности к противоопухолевой терапии, что обусловлено разнообразием генетических аббераций, приводящих к его развитию и прогрессированию. На основании профиля генной экспрессии была создана генетическая (молекулярная) классификация РМЖ, позволившая выделить несколько подтипов заболевания, значимо отличающихся по прогнозу и чувствительности к различным видам лечения [1]. Среди этих подтипов, которые включают HER2-позитивный, люминальный А, люминальный В и базально-подобный РМЖ, последний вариант обладает наихудшим прогнозом [2]. По результатам анализа O. Baser и соавт. [3], включившего 579 больных диссеминированным РМЖ, 134 (23%) из которых имели тройной негативный (ТН) фенотип, медиана выживаемости больных ТН РМЖ составила 1,71 года для больных ТН РМЖ по сравнению с 3,19 года в среднем для остальных подгрупп (р<0,001).
В повседневной клинической практике и многих исследованиях ввиду недоступности генетического анализа для выделения данной подгруппы (базально-подобного варианта) используется иммуногистохимически определяемый «эквивалент» – РМЖ с ТН фенотипом (ТН РМЖ), который составляет 10–24% всех случаев РМЖ, характеризуется отсутствием в опухоли рецепторов к эстрогенам (РЭ), прогестерону (РП) и одновременно отсутствием гиперэкспрессии HER2.
К другим иммуногистохимически определяемым характеристикам ТН РМЖ следует отнести частую встречаемость гиперэкспрессии «базальных» маркеров (цитокератины СК 5/6, СК-14, СК-17, виментин), EGFR (рецептор эпидермального фактора роста), c-kit. Кроме того, при ТН РМЖ имеется высокая частота мутаций p53, определяющая в т.ч. и геномную нестабильность опухоли. Было установлено, что от экспрессии базальных маркеров напрямую зависит и частота местных рецидивов, и выживаемость больных ТН РМЖ [4, 5], т.е. наличие иммуногистохимических признаков истинного базально-клеточного генетического подтипа свидетельствует о неблагоприятном прогнозе.
Молекулярный портрет ТН РМЖ значимо пересекается с базально-подобным раком – степень конкордантности составляет 70–90% [6, 7]. Так же как базально-подобный «генетический» вариант, ТН РМЖ часто ассоциирован с мутацией генов BRCA: встречаемость этих мутаций при ТН РМЖ составляет от 16 до 42%, по данным разных источников [8, 9].

Однако важно понимать, что нельзя полностью отождествлять базально-подобный рак, рак с тройным негативным фенотипом и BRCA1-ассоциированный РМЖ [10–13] – не все базально-подобные опухоли имеют ТН-фенотип, и не весь ТН РМЖ – базально-подобный, а некоторые опухоли, ассоциированные с BRCA-мутациями, могут относиться к совсем другим генетическим или «иммуногистохимическим» подтипам. Так, среди базально-подобных опухолей до 15–45% имеют экспрессию РЭ и/или РП и до 14% – гиперэкспрессию HER2+ (базально-подобные, но не ТН РМЖ); 71–91% ТН опухолей имеют экспрессию хотя бы одного базального маркера и только 44% – экспрессию всех базальных маркеров (цитокератины, EGFR, c-kit, виментин).
В то же время 16–44% ТН опухолей не имеют экспрессии ни одного базального маркера (ТН, но не базально-подобный РМЖ); 90% наследственного (с герминальными мутациями BRCA1) РМЖ имеют ТН-фенотип, в то время как при спорадических мутациях BRCA1 не более 40% больных имеют ТН-фенотип.
Характерной особенностью ТН РМЖ являются высокая непосредственная эффективность химиотерапии (ХТ) и одновременно неудовлетворительные отдаленные результаты лечения. Так, по данным неоадъювантных исследований, частота объективных эффектов при ТН РМЖ может достигать 86% [14], что значительно выше, чем при других подтипах РМЖ, однако выживаемость больных ТН РМЖ, получивших лечение со столь высокой непосредственной эффективностью, все равно оказывается ниже, чем при других подтипах опухоли. Медиана выживаемости после выявления метастазов ТН РМЖ не превышает 13 месяцев, в то время как у больных другими подтипами РМЖ – 22 месяца [15, 16]. Возможно, подобное течение ТН РМЖ обусловлено его общими молекулярно-генетическими характеристиками (высокая пролиферативная активность обеспечивает, с одной стороны, высокую чувствительность к цитотоксической терапии, с другой – высокую агрессивность заболевания). Однако не следует забывать, что ТН РМЖ – гетерогенное заболевание, в пределах одной и той же подгруппы объединенное лишь отрицательным статусом трех рецепторов, есть опухоли с высокой чувствительностью к ХТ и благоприятным прогнозом, опухоли с высокой непосредственной чувствительностью к ХТ и неблагоприятным прогнозом и опухоли, не чувствительные к ХТ.
Помимо того что цитотоксическое лечение (ХТ) до сих пор остается единственным вариантом терапии больных, опухоли которых не экспрессируют РЭ, РП и HER2, на сегодняшний день мы имеем очень ограниченное число рандомизированных исследований со зрелыми результатами различных вариантов терапии ТН РМЖ. До настоящего времени нет доказательных данных о предсказательном значении тех или иных молекулярно-генетических характеристик опухоли с ТН-фенотипом.
Как и при любом другом подтипе, метастатический ТН РМЖ неизлечим. Однако в отличие от других подтипов, например люминального, при котором метастатическая болезнь может течь годами, успешно контролируясь различными вариантами эндокринотерапии и ХТ, прогноз больных метастатическим ТН РМЖ крайне неблагоприятен (медиана общей выживаемости немногим превышает 20 месяцев). Подобная ситуация, скорее всего, обусловлена как биологическими особенностями опухоли, так и недостаточным арсеналом методов ее лечения. Дефицит доступных методов лечения во много отражается различием в выживаемости больных, у которых метастатическая болезнь была выявлена в дебюте заболевания, и больных, у которых отдаленные метастазы были выявлены после ранее проведенного радикального лечения. Медиана выживаемости больных первично метастатическим ТН РМЖ все же составляет чуть более 2 лет, а вот у пациенток, ранее получавших терапию по поводу локализованного заболевания, медиана выживаемости составляет лишь около 18 месяцев.
Как уже говорилось выше, оптимальные режимы ХТ при ТН РМЖ до сих пор не определены. Обусловлено это прежде всего тем, что в то время, когда большинство базовых режимов лечения метастатического РМЖ (мРМЖ) проходило клиническое тестирование, такая подгруппа, как ТН РМЖ, отдельно не выделялась. Основываясь на результатах ретроспективных анализов, было показано, что использование таксанов, капецитабина позволяет добиваться объективного ответа 18–26% больных; медианы времени до прогрессирования – 2,8–6,1 месяца и медианы общей выживаемости– 8,6–12,6.
Введение платиновых производных позволяет добиваться объективного ответа 30–62% больных; медианы времени до прогрессирования – 3,6–13,0 месяцев и медианы общей выживаемости – 7,7–16,0 месяцев.
В 2013 г. Y. Fan и соавт. представили результаты небольшого (n=53), но рандомизированного исследования II фазы, в котором сравнили эффективность применения комбинаций доцетаксел+цисплатин и доцетаксел+капецитабин в первой линии лечения метастатического ТН РМЖ [17]. Введение в режим первой линии цисплатина позволило значимо увеличить не только непосредственную эффективность (первичная цель исследования), но и, что более важно, добиться медианы выживаемости без прогрессирования 10,9 месяца. Медиана общей выживаемости в этом исследовании впервые превысила 32-месячный рубеж (табл. 1).
Таким образом, можно говорить, что наилучшие результаты были получены при использовании препаратов платины, а также интенсифицированных режимов [18], включивших антрациклины и таксаны [19, 20]. Обнадеживающие результаты были получены и при использовании иксабепилонов [21, 22]. В целом же набор цитостатиков и режимов, которые могут использоваться при ТН РМЖ, аналогичен таковому при РМЖ в целом.
Попытки улучшить результаты лечения больных РМЖ с тройным негативным фенотипом за счет введения в режимы лечения различных таргетных препаратов (различные тирозинкиназные ингибиторы, антитела к EGFR и т.д.) не привели к значимому улучшению результатов лечения этой подгруппы больных.
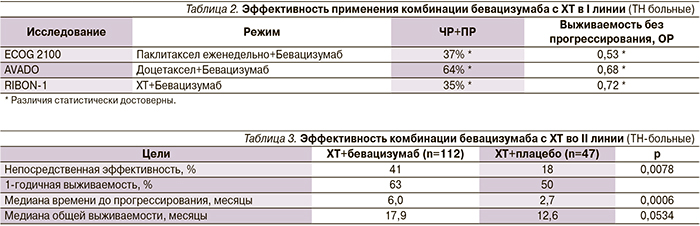
Определенные успехи были получены при введении в режимы терапии больных ТН РМЖ бевацизумаба. По результатам поданализа трех рандомизированных исследований – E2100, AVADO и RIBBON-1 (n=622 ТН РМЖ) [23] было показано, что непосредственная эффективность и время до прогрессирования при применении комбинации бевацизумаба с ХТ I линии значимо выше по сравнению только с ХТ, причем различия оказались сопоставимыми с результатами анализа всех включенных в эти исследования больных HER2-негативным РМЖ (табл. 2).
В то же время достоверных различий в отношении общей выживаемости, по результатам этого мета-анализа, получено не было (ОР=0,96).
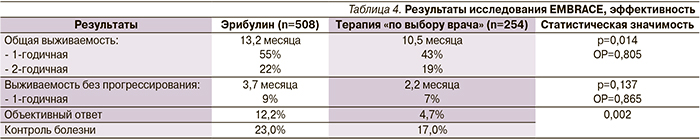
По результатам исследования RIBBON-2 [24], бевацизумаб показал свою эффективность и во II линии лечения мРМЖ. Причем наилучшие результаты были получены у когорты больных, опухоли которых были расценены как ТН РМЖ (n=159). Следует отметить, что эти больные характеризовались крайне неблагоприятной клинической картиной: более 3 зон метастазирования имели 32–48% больных, 62–74% – висцеральные метастазы; прогрессирование в сроки менее 6 месяцев после I линии ХТ было зафиксировано у более трети больных (33–38%). Тем не менее именно для больных ТН РМЖ различия во времени до прогрессирования и непосредственной эффективности оказались наиболее существенными (табл. 3). Очень обнадеживающими выглядят и данные о медиане общей выживаемости у больных ТН РМЖ, получивших бевацизумаб во II линии терапии, причем различия между группами очень близки к статистически значимым (p=0,0534, ОР=0,624) [25].
Применение бевацизумаба при лечении ТН РМЖ позволяет увеличивать непосредственную эффективность и замедлять прогрессирование опухоли у ряда больных не только в первой, но и последующих линиях лечения метастатической болезни.
В фазе клинических исследований находится ряд препаратов группы мультикиназных ингибиторов с антиангиогенной активностью: вандетаниб, дасатиниб, пазопаниб и акситиниб.
Большие надежды возлагаются на применение больными ТН РМЖ m-TOR ингибиторов (эверолимуса и темсиролимуса). Для больных BRCA-мутациями высокую эффективность показали PARP-ингибиторы, наиболее исследуемыми из которых являются инипариб, велипариб и олапариб.
Однозначных данных о преимуществах какого-либо препарата или режима при метастатическом ТН РМЖ на настоящий момент нет. Принимая во внимание отсутствие до настоящего времени принципов определения оптимального режима терапии больных ТН РМЖ даже в первой линии терапии метастатической болезни, выбор препаратов для второй и последующих линий лечения представляется очень сложной задачей.
Проблема выбора третьей и последующих линий терапии мРМЖ
Ведущее место в терапии мРМЖ давно заняли антрациклины и таксаны. Именно они являются базовыми для режимов первой и второй линий лечения мРМЖ. До последнего времени большинство рекомендаций, посвященных цитостатическому лечению мРМЖ, которые рано или поздно начинают получать все пациенты независимо от рецепторного и HER2 статуса опухоли, заканчивались на второй, максимум третьей линиях терапии.
В своем арсенале мы имеем ряд других цитостатиков, обладающих в той или иной мере эффективностью в третьей и более линиях. Однако эффективность в третьей и более линиях монотерапии такими препаратами, как абраксан, гемцитабин и винорельбин, невысока. Использование комбинированных режимов в большинстве случаев дает выигрыш во времени до прогрессирования и частоте непосредственных ответов, но не общей выживаемости и, что немаловажно для больных мРМЖ, ценой значимо более высокой токсичности.
Согласно рекомендациям I консенсусной конференции по терапии мРМЖ (1st International consensus guidelines for advanced breast cancer (ABC 1) [26], для больных, получавших и антрациклины, и таксаны, и не требующих (или в отсутствие возможности вследствие общего состояния) применения комбинации цитостатиков, терапией выбора долгое время являлся капецитабин.
Вне рамок всяких рекомендаций многие пациенты получали и продолжают получать терапию третьей, четвертой и последующих линий.
В США, например, больные мРМЖ за время болезни успевают получить в среднем 4–6 линий ХТ. Однако до последнего времени мы не имели четких доказательств того, что какие-либо варианты цитотоксической терапии, используемые после двух стандартных линий лечения, увеличивают выживаемость больных. В 2010 г. такой препарат появился. Более того, он показал преимущества в отношении не только непосредственной эффективности, но и общей выживаемости по сравнению со сводными результатами, отражающими рутинную практику более второй линии, применявшейся до сих пор.
Эрибулин (производное морской губки Halichondria okadai) ингибирует микротрубочки посредством секвестрирования тубулина в неактивные конгломераты. В доклинических исследованиях была показана его эффективность в отношении клеточных линий, имеющих мутации β-тубулина, определяющих резистентность к таксанам. В двух (n=103 и n=299) исследованиях II фазы [27, 28] у больных мРМЖ, получивших в среднем по 4 линии ХТ, была продемонстрирована не только непосредственная эффективность (частота объективного ответа составила 11,5 и 9,3%), но и большая для этих сроков лечения общая выживаемость (медиана составила 9,0 и 10,4 месяца).
Первым рандомизированным исследованием III фазы было исследование EMBRACE [29]. Отличительной особенностью этого исследования, ставшего регистрационным для эрибулина, было то, что первичной целью являлась именно общая выживаемость больных, получивших в среднем 2–5 линий ХТ, обязательно включавших антрациклины и таксаны.
Семьсот шестьдесят две пациентки, средний возраст которых составил 55 лет (27–85), получивших в анамнезе в среднем по 4 линии ХТ (2–7), причем длительность терапии на последней линии ХТ составила 3,5 месяца, были рандомизированы в соотношении 2:1 на получение эрибулина по 1,23 мг/м2 (эквивалентно эрибулина мезилату 1,4 мг/м2) внутривенно дни 1-й и 8-й каждого 3-недельного цикла (n=508) и проведение оговоренной до рандомизации ХТ по выбору врача (n=254). Как правило, в качестве ХТ «по выбору врача» использовались винорельбин, гемцитабин и капецитабин. Все больные стратифицировались по следующим факторам: предшествующее лечение капецитабином, HER2 статус опухоли и географический регион проведения исследования. Последний фактор был выбран для изучения различий в доступности препаратов и особенностей рутинной клинической практики в зависимости от географического региона.
HER2+ статус опухоли был подтвержден в отношении 16%, РЭ+/РП+ – 64%, 19% больных имели опухоль с ТН-фенотипом. Наиболее частой локализацией метастазов были кости (у 61%) и печень – (у 60% больных). Более половины включенных больных страдали метастазами трех и более локализаций.
Лечение проведено до прогрессирования болезни либо развития непереносимой токсичности. Первичной целью исследования стала общая выживаемость больных. Вторичными – выживаемость без прогрессирования, частота достижения объективного ответа и длительность ответа.
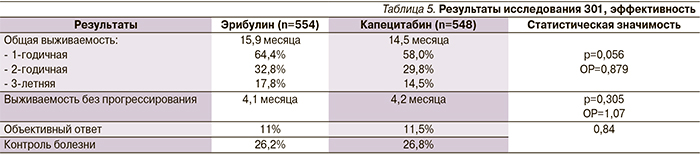
Медиана продолжительности лечения эрибулином составила 3,9 месяца (0,7–16,3 месяца), причем 5 и более циклов получили 59% больных. В то же время медиана длительности терапии «по выбору врача» составила 2,1 месяца (0,03–21,2 месяца). Ожидать значимого противоопухолевого ответа на этих сроках терапии, как правило, не приходится, тем не менее в группе эрибулина 12% больных, по мнению независимых экспертов, достигли объективный ответ (из них – 3 полных), а контроля болезни удалось добиться 23% пациенток. Для больных, получавших терапию «по выбору врача», эти цифры были ниже: 5% – частота достижения объективного ответа и 17% – контроль болезни (р=0,002).
Медиана выживаемости без прогрессирования в обеих группах выглядит довольно грустной (3,7 месяца при терапии эрибулином и 2,2 месяца в группе сравнения) и служит нам напоминанием о неудовлетворительных результатах лечения больных в n-ной линии терапии мРМЖ. И на этом фоне весьма неожиданными и обнадеживающими оказались результаты общей выживаемости больных, включенных в исследование. Медиана общей выживаемости составила 13,2 месяца (95% доверительный интервал [ДИ] – 11,8–14,3 месяца) в группе эрибулина и 10,5 (95% ДИ – 9,3–12,5 месяца) – в группе терапии «по выбору врача»; 1-годичная выживаемость – 53,9 и 43,7% соответственно (табл. 4). При анализе по стратификационным группам преимущество в отношении общей выживаемости больных в группе эрибулина сохранилось незавивисимо от HER2 статуса опухоли и наличия/отсутствия предшествующей терапии капецитабином.
Логично, что проведение противоопухолевого лечения больным, уже получившим 2 и более линий ХТ, как минимум не должно ухудшать их качество жизни. Как и в более ранних исследованиях, и в этом было продемонстрировано, что профиль токсичности у эрибулина хорошо управляем. Самым частым осложнением 3–4-й степеней для больных, получавших эрибулин, была нейтропения (52%), в то же время фебрильная нейтропения была зарегистрирована лишь в 5% случаев; прекращение лечения в связи с гематологической токсичностью потребовалось только 4 больным. Периферическая нейропатия возникла у 35% больных в группе эрибулина, что оказалось даже несколько ниже, чем у больных, получавших таксаны в качестве терапии «по выбору врача» (45%). Лишь у 8% больных, получавших эрибулин, отмечено развитие невропатии 3–4-й степеней и только 24 (5%) больных, получавших эрибулин, были вынуждены прекратить лечение.
Несмотря на то что те или иные нежелательные явления всех степеней отмечены практически всеми больными, получавшими эрибулин, следует отметить, что серьезные нежелательные явления возникли лишь у 25%, что оказалось сопоставимым с частотой их развития в контрольной группе (26%). Частота нежелательных явлений, потребовавших редукции дозы препаратов в обеих группах, была сопоставимой и составила 29% в группе эрибулина и 26% в группе больных, получавших терапию «по выбору врача». Отмена лечения в связи с осложнениями потребовалась 13% и 15% больных соответственно.
Результаты исследования EMBRACE показали, что обладая управляемой токсичностью, эрибулин позволяет существенно увеличивать общую выживаемость сильно предлеченных больных мРМЖ по сравнению с доступными вариантами терапии.
В связи с этим очень важным представлялась потребность выявления факторов, позволивших выделить подгруппу больных или подтипы опухоли, при которых продолжение терапии за пределами существующих стандартов приносит наибольшую пользу.
Вторым рандомизированным исследованием является исследование 301 (открытое рандомизированное многоцентровое III фазы с двумя параллельными группами терапии эрибулином и капецитабином в первой, второй или третьей линиях лечения по поводу рецидива болезни и/или отдаленных метастазов у больных, получавших антрациклины и таксаны).
Первичной целью исследования стала общая выживаемость и выживаемость без прогрессирования. В исследование были включены 1102 больных, рандомизированных в соотношении 1:1 в группу терапии эрибулином 1,23 мг/м2 внутривенно (эквивалентно эрибулина мезилату 1,4 мг/м2), дни 1-й и 8-й каждые 3 недели (n=554), и группу терапии капецитабином по 2500 мг/м2 в сутки внутрь, дни 1–14-й каждые 3 недели (n=548). Лечение проведено до прогрессирования или развития непереносимой токсичности. Все больные стратифицировались по географическому региону участников исследования и HER2 статусу.
Средний возраст составил 54 года (от 24 до 80 лет), подавляющее большинство больных на момент включения в исследование имели удовлетворительное состояние (ECOG – Eastern Cooperative Oncology Grou, 0–1). Среди включенных в исследование оказались более 15% больных, имевших отдаленные метастазы уже на момент первичного диагноза. Несмотря на это, медиана времени от первичного диагноза до включения в исследование составила 34 месяца (от 2 до 299 месяцев). Следует отметить, что больных HER2+-опухолями было несколько меньше, чем в общей популяции (15,5% в группе эрибулина и 15,1% в группе капецитабина), в то же время доля больных опухолями, не экспрессирующими ни РЭ, ни РП, ни HER2 (с ТН фенотипом), была больше, чем в общей популяции (27,1% и 24,5% соответственно).
Исследуемый вариант терапии (эрибулин или капецитабин) в качестве первой линии лечения метастатической болезни получили 20,9% и 19,0% пациенток соответственно; во второй линии – 50,5% и 53,5% соответственно. В третьей линии исследуемую терапию получили 27,8% в группе эрибулина и 26,6% в группе капецитабина в отличие от исследования EMBRACE, в котором 41% больных получали эрибулин в третьей линии. Следует отметить, что 45,1% больных группы эрибулина и 47,4% группы капецитабина на момент включения в исследование имели доказанную резистентность к таксанам.
Медиана длительности терапии в группах составила 4,1 месяца (0,7–45,1) и 3,9 месяца (0,69–47,4 месяца) соответственно. Медиана числа курсов в группе эрибулина была 6 (1–65), в группе капецитабина – 5 (1–61). Потребность в откладывании курса в обеих подгруппах составила 41%. Редукция дозы исследуемых препаратов была проведена у 32,5% больных.
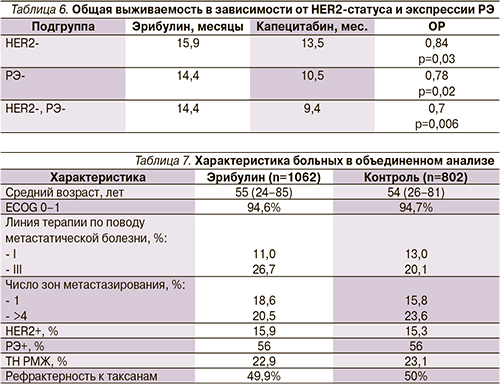
Анализ результатов исследования был проведен после наступления событий в отношении 82% больных [30]. Несмотря на сопоставимую непосредственную эффективность (ПР+ЧР), частоту достижения контроля болезни (ПР+ЧР+стабилизация болезни>6 месяцев) и выживаемость без прогрессирования, общая выживаемость больных в группе терапии эрибулином оказалась достоверно выше (табл. 5).
Данные различия в общей выживаемости можно объяснить тем фактом, что после окончания лечения в рамках исследования 70% больных группы эрибулина и только 62% группы капецитабина получили последующее лечение. Три и более линий было проведено 23,7% пациенток группы эрибулина и только 17,7% больных группы капецитабина. Интересным представляется анализ лечения больных после выхода из исследования. Практически 50% больных из группы эрибулина получали в дальнейшем капецитабин, в то время как возможности получать эрибулин больным группы капецитабина на тот момент не было, и наиболее частым вариантом последующего лечения для этих больных были винорельбин (24%), таксаны (21,5%) и др., в т.ч. таргетные препараты (27,0%).
Анализ переносимости терапии не выявил никаких новых нежелательных явлений, обусловленных применением эрибулина. Наиболее частым нежелательным явлением для больных группы эрибулина была нейтропения (54,2%) и алопеция (34,6%), в то время как в группе капецитабина частота этих нежелательных явлений составила 15,9 и 4,0% соответственно. В то же время ладонно-подошвенный синдром (45,1%) и диарея (28,8%) закономерно чаще встречались среди больных, получающих капецитабин. В группе терапии эрибулином частота ладонно-подошвенного синдрома составила лишь 0,2%, диареи – 14,3%. Таким образом, еще в одном исследовании был подтвержден благоприятный профиль безопасности эрибулина. Частота серьезных нежелательных явлений была несколько ниже в группе эрибулина: 17,5% и 21,1% – в группе капецитабина, соответственно [30].
Запланированный анализ выживаемости в зависимости от подтипа опухоли [31] показал, что наилучшие результаты общей выживаемости были получены у больных ТН РМЖ, получавших эрибулин (табл. 6)
На ASCO (American Society of Clinical Oncology) 2014 г. были доложены результаты объединенного анализа общей выживаемости в зависимости от подтипа опухоли (HER2+ и ТН) двух исследований (EMBRACE и Исследование 301), включившего более 1800 больных. Основные характеристики больных, вошедших в объединенный анализ, представлены в табл. 7.
По результатам объединенного анализа [32] было продемонстрировано достоверное улучшение общей выживаемости больных, получавших эрибулин: 15,2 и 12,8 месяца в контрольной группе соответственно (ОР=0,85, 95% ДИ – 0,77–0,95; р=0,003). При этом различия в общей выживаемости больных HER2-негативными опухолями составили 15,2 месяца в группе Эрибулина и 12,3 месяца – в контрольной группе (ОР=0,82, 95% ДИ – 0,72–0,93; р=0,002).
Закономерно худшая по сравнению с общей популяцией общая выживаемость была отмечена среди больных, опухоли которых не имели экспрессии ни эстрогенов, ни прогестерона, ни HER2 (ТН РМЖ). В то же время именно в этой подгруппе были получены наиболее выраженные различия общей выживаемости больных, получавших эрибулин, по сравнению с контрольной группой: 12,9 и 8,2 месяца соответственно (ОР=0,74, 95% ДИ – 0,60–0,92; р=0,006). В группе HER2+ различий в общей выживаемости получено не было.
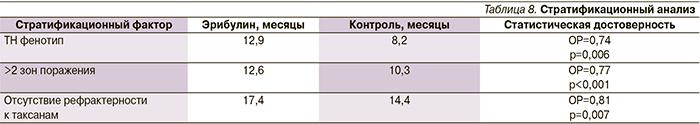
Стратификационный анализ показал достоверное улучшение общей выживаемости больных, получавших эрибулин, вне зависимости от стратификационного фактора. Тем не менее наиболее достоверные различия были выявлены в зависимости от числа зон поражения, наличия рефрактерности к таксанам (прогрессирование в течение 60 дней после последней дозы) и между больными ТН и не-ТН РМЖ (табл. 8).
Заключение
Эффективность эрибулина для больных РМЖ после применения антрациклинов и таксанов была подтверждена в двух рандомизированных исследованиях. Крайне важным остается то, что эрибулин, являясь хорошо переносимым препаратом, показал способность увеличивать общую выживаемость больных (чего не было показано в исследованиях других препаратов, до настоящего времени применявшихся в данной когорте больных).
Несмотря на то что при подгрупповом анализе эффект эрибулина отмечен практически у всех категорий больных, наибольший выигрыш от его использования получили пациентки с остающимся до настоящего времени наиболее прогностически неблагоприятным подтипом РМЖ – с тройным негативным фенотипом.
В связи с этим эрибулин можно назвать предпочтительным препаратом для лечения больных ТН РМЖ после прогрессирования на антрациклинах и таксанах.
Перспективы
В настоящее время эрибулин наиболее активно изучается при ТН РМЖ и HER2+-РМЖ. Ведутся исследования по изучению эффективности эрибулина в комбинации с различными цитостатиками (преимущественно в неоадъювантных режимах). Также инициирован ряд новых исследований I/Ib фазы по изучению переносимости и эффективности комбинации эрибулина с таргетными препаратами (эверолимусом и олапарибом при ТН РМЖ и трастузумабом и пертузумабом при HER2+РМЖ).



