Острые нарушения мозгового кровообращения (ОНМК) признаны редкой патологией среди пациентов молодого и детского возраста: встречаемость инсультов у них не превышает 2–12 случаев на 100 тыс. в год. В то же время по уровню смертности, склонности к рецидивированию, риску формирования инвалидизирующих последствий эти больные не отличаются от известных декретированных групп [1–4].
Известно, что наиболее вероятной стадией болезни для повторения ОНМК становится восстановительный период. Однако в дальнейшем риск рецидива острой цереброваскулярной катастрофы не становится меньше. Vijeva Ganesan и соавт. показали, что после первого эпизода ОНМК, произошедшего в возрасте от 21 дня до 19 лет, через пять лет только 59 % пациентов не имели повторного инсульта. При этом у каждого шестого больного отмечены изменения по результатам нейровизуализации в отсутствие клинических проявлений [5]. Средний риск рецидивирования инсульта в этой возрастной группе составляет около 20 %, при этом он нарастает при сочетании двух факторов риска, достигая 60 % у пациентов с серповидно-клеточной анемией, дефицитом протеина С, избытком липопротеина (а) [6–10].
В связи с относительной редкостью инсультов на ранних этапах жизни, а также вариативностью причин инсультов (их насчитывают более 70 только для ишемического типа ОНМК) речь о первичной профилактике заболевания практически не идет. Большинство исследователей этой проблемы сосредоточены на факте своевременного распознавания и фиксации сосудистого события, поиске причин заболевания и предикторов рецидивирования после свершившегося ОНМК, а также на мерах вторичной профилактики в описанных возрастных группах.
Система вторичной профилактики в традиционном для ОНМК возрасте определяется в первую очередь перечнем значимых и корригируемых факторов риска. В настоящее время доказана эффективность для взрослых пациентов гипотензивных препаратов, антиагрегантов, антикоагулянтов, статинов, каротидной эндартерэктомии. Несмотря на важность и научную обоснованность изменения образа жизни и хирургических подходов, медикаментозный способ вторичной профилактики остается наиболее используемым.
Ишемический инсульт (ИИ) в молодом возрасте отличает вариативный патогенетический полиморфизм и полиэтиологичность, однако инициирующим фактором нарушения перфузии и запуска ишемического каскада в мозговой ткани остается готовность тромбоцитов к агрегации. Именно этот факт обосновывает первостепенную значимость в медикаментозной профилактике препаратов с антиагрегантной направленностью. Представленные на сегодняшний день дезагрегантные препараты существенно различаются по точкам приложения. Так, ацетилсалициловая кислота (АСК) блокирует циклооксигеназу, предотвращая образование тромбоксана A2; дипиридамол влияет на концентрацию циклических нуклеотидов, аденозиндифосфорной кислоты (АДФ), тромбина, арахидоновой кислоты. Тиенопиридины являются необратимыми и селективными блокаторами АДФ-рецепторов тромбоцитов. Антагонисты и блокаторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa воздействуют на конечный этап формирования тромбоцитарного агрегата. При объединенном анализе результатов 21 исследования (более чем 18 тыс. больных) снижение риска повторных инсультов и транзиторных ишемических атак при применении антиагрегантов составляет 22 % [11].
Использование АСК может рассматриваться в качестве стандарта дезагрегантной терапии, которую назначают всем пациентам с высоким риском развития сосудистых событий в отсутствие противопоказаний. Так, по результатам мета-анализа 287 исследований показан первично протективный эффект длительного применения АСК [11]. В ходе прямых сравнительных исследований доказана одинаковая эффективность малых, средних и высоких доз препарата для больных с перенесенным инсультом или преходящим нарушением мозгового кровообращения [12–14]. Минимально эффективной для профилактики ИИ (как и для большинства сердечно-сосудистых заболеваний) у взрослых пациентов считается доза 75 мг/сут.
Вторым по клинической значимости становится препарат клопидогрел, эффективность которого оценена в ряде испытаний на взрослых пациентах с инсультом. Так, известное исследование CAPRIE выявило значительное снижение относительного риска ишемических событий на 8,7 % в пользу клопидогрела при сравнении его с АСК [15]. Проект CARESS и ряд других показали терапевтические возможности комбинированной терапии клопидогрелом и АСК. В ходе дальнейшего изучения было также установлено, что взрослыми пациентами клопидогрел лучше переносится, формирует менее значимые, чем АСК и тиклопидин, побочные эффекты и осложнения [16].
Итак, меры вторичной профилактики ИИ, показания к ней, выбор препаратов и их дозировки во взрослой практике определены. Число публикаций по этим вопросам достигает нескольких сотен, основные результаты исследований обобщены с помощью мета-анализа. Однако весь массив данных касается исключительно пожилой возрастной группы пациентов с типовыми этиологическими и патогенетическими вариантами ИИ. Относительно больных, перенесших ОНМК в молодом возрасте, имеющих до полусотни факторов риска и значительно отличающихся как клинически, так и по прогнозу [7], эти рекомендации могут существенно различаться.
В педиатрической практике ситуация с вторичной профилактикой тромботических событий остается практически нерешенной. «Существует достаточно много возрастных различий в причинах, проявлениях и ответах на лечение пациентов с инсультом, поэтому мы должны быть осторожными, пытаясь применить наше знание инсульта у взрослых к детям с острым нарушением мозгового кровообращения», – отмечают авторы руководства, выпущенного американской ассоциацией врачей-кардиологов в 2008 г. во главе со Стивом Роачем. В то же время мнение ведущих специалистов, занимающихся проблемой ИИ, единодушно: у всех пациентов с ИИ или транзиторной ишемической атакой, которые дебютируют в детском и молодом возрасте, следует назначать дезагреганты для вторичной профилактики инсульта, если нет показаний к антикоагулянтной терапии (уровень доказательности I) [2, 17].
В педиатрической практике доказательная база применения АСК ограничена разрозненными данными, которые показывают безопасность применения аспирина, но не дают оснований для заключения об эффективности его использования или оптимальности дозы. Одно нерандомизированое исследование показало, что дети, получавшие АСК, имели в целом меньшую частоту рецидивирования инсультов, чем дети без профилактики; другое – что частота рецидивирования у детей, принимавших АСК и антикоагулянты, была сопоставимой [1, 18]. В любом случае ясно, что вторичная медикаментозная профилактика должна проводиться: дети, не получавшие ее, имеют частоту рецидивов существенно выше, чем те, кто использовал хотя бы один препарат из профилактической линейки [1, 5, 9].
Несмотря на повсеместное применение АСК в качестве вторичной профилактики после ИИ, доза препарата и длительность его применения в детстве однозначно не определены. Наиболее часто упоминаемые для педиатрической практики дозы 3–5 и 1–3 мг/кг/сут [18, 19]. Продолжительность назначения АСК также остается предметом дальнейшего изучения, в настоящее время она составляет не менее 3–5 лет. Предполагается, что срок может быть продлен, если имеются симптомы рецидивирования ишемии или риск повторения ОНМК сохраняется, например, в связи с имеющимся стенозом церебральных сосудов или при большинстве врожденных заболеваний сердца [10, 20].
В то же время большинство педиатров смущает возможность серьезных, в т.ч. жизнеугрожающих, осложнений в ходе длительной и непрерывной терапии АСК, таких как синдром Рейе и аспирин-индуцированных язв в желудочно-кишечном тракте. Еще одной проблемой стала резистентность к аспирину, которую фиксируют у 5–45 % пациентов (в среднем у каждого третьего). Среди возможных причин устойчивости к аспирину рассматривают полиморфизм и/или мутацию генов рецепторов тромбоцитов, циклооксигеназы-1, активацию тромбоцитов другими путями и др. [21–23]. В настоящее время проведено мало исследований, чтобы оценить популяционную частоту, практическую значимость и выработать пути преодоления резистентности. Так, например, полиморфизм генов рецепторов тромбоцитов к фибриногену ITGB3: Т1565C, который считают одним из «виновников» резистентности к асприну, по нашим данным, встречается среди 23,4 % детей и 25,9 % молодых взрослых с ИИ [7, 24]. Несомненно, проблема резистентности к самому назначаемому препарату вторичной профилактики ИИ стала поводом для формирования индивидуального подхода к антитромботической терапии и подбора других препаратов антиагрегатной направленности.
Альтернативой препаратам АСК в ситуации непереносимости и резистентности может выступить клопидогрел. Исследования отработали дозирование клопидогрела на ранних этапах жизни: терапевтический диапазон составляет 0,2 мг/кг/сут у детей раннего возраста (до 24 месяцев) и до 2 мг/кг/сут в более старшем возрасте с максимальной суточной дозой в 75–81 мг. При необходимости разовая доза для приема может быть округлена до половины, трети или четверти таблетки, рекомендованная продолжительность приема составляет 3–6 месяцев. Показана хорошая переносимость, отсутствие серьезных побочных эффектов и осложнений при соблюдении рекомендованных режимов дозирования [17, 25–28]. К настоящему времени изучен доза-зависимый дезагрегантный эффект клопидогрела, отработаны критерии клинической и лабораторной эффективности применения препарата на ранних этапах жизни. При недостаточной коррекции показателей агрегатограммы возможно сочетание клопидогрела с варфарином, эноксапарином и аспирином [25–29]. Однако к комбинированной терапии должны быть выставлены строгие показания в связи с повышением риска кровотечения любой локализации.
Изучив все имеющиеся сведения и дискуссионные точки зрения, канадские специалисты дали наиболее четкие рекомендации по тактике назначения клопидогрела в качестве препарата вторичной профилактики при ИИ [17, 26]:
Клопидогрел может считаться альтернативой препаратам АСК для подростков и должен назначаться в дозе 1 мг/кг/сут (максимальная суточная доза – 75 мг/сут). Для детей младшего возраста терапевтические дозы следует рассматривать в пределах 0,2–0,5 мг/кг/сут (рекомендации уровня C).
Краткосрочное применение сочетания АСК и клопидогрела (до 90 дней) не сопровождается повышением риска кровотечений (рекомендации уровня B).
Подбор сочетаний АСК и дипиридамола (200 мг) или клопидогрела (75 мг) возможен и должен зависеть от клинической ситуации (рекомендации уровня А).
Ориентируясь на опыт ведущих европейских и северо-американских педиатрических школ [1, 2, 18, 19, 26, 27, 30], нами принята тактика активной тромбопрофилактики с помощью комплекса мер, включившего модификацию образа жизни, а также применение лекарственных средств группы дезагрегантов.
В течение 6 лет мы наблюдали 82 пациентов, перенесших ИИ, дебют которого пришелся на возраст до 18 лет. На момент первой оценки до внедрения тактики активной вторичной профилактики только 28,05 % ( n= 23) детей была назначена дезагрегантная терапия в стационаре или на выписку, а ее отсутствие не было обосновано. Уровень рецидивирования тромботических событий оказался сопоставимым с литературными данными: повторные ИИ зафиксированы у каждого пятого ребенка – 26,72 % (n = 22). После принятия концепции активного ведения пациентов с дебютом ИИ в детском возрасте всем больным назначали препараты антитромботической группы с целью вторичной профилактики сразу на этапе стационара или при первой встрече на амбулаторном этапе. Антитромботическая терапия была предписана во всех случаях, когда не было выявлено клинических или лабораторных противопоказаний. Выбор препарата определялся патогенетическим типом ИИ, сочетанием факторов риска рецидива, а также с учетом данных генетического и лабораторного профиля тромбофильности пациентов. В восстановительном периоде болезни (который продолжается до двух лет от дебюта инсульта) антитромботическую терапию получали 75,28 % детей, из них: аспирин – 41,57 %, варфарин – 10,12 %, сулодексид – 10,11 %, клопидогрел – 13,48 % пациентов.
Известно, что назначение современных антитромботических препаратов (кроме варфарина) не требует лабораторного контроля ввиду их рецепторной ориентированности, испытанного режима дозирования и множества исследований, показавших безопасность использования лекарственных средств в рекомендованных производителем дозировках. Однако эти утверждения, правомочные для популяции взрослых больных, не могут быть безоговорочно экстраполированы на ранние этапы жизни.
 С учетом комбинированности этиологических факторов ОНМК, лабильности системы гемостаза у детей, возможной резистентности к терапии, возрастных особенностей фармакокинетики препаратов, потенциально высокого риска осложнений, в т.ч. негеморрагического спектра, нами было принято решение о необходимости мониторинга профиля безопасности для наших пациентов. Все больные приглашались с периодичностью 1 раз в месяц для оценки переносимости и эффективности получаемой терапии. Помимо опроса, осмотра кожных покровов/слизистых на предмет геморрагических симптомов все пациенты были обследованы на уровень агрегации с арахидоновой кислотой/коллагеном (если принимали аспирин) и АДФ (если получали клопидогрел) на аппарате импедансного агрегометра Multiplate analyzer (Roche, Швейцария). Титрование дозировки препаратов вели из расчета на килограмм массы тела и начиналось с минимально рекомендованной: у АСК – 2 мг/кг/сут, у клопидогрела – 0,2. Целевые значения агрегации считали достигнутыми при снижении показателей ниже 30 U [31, 32, 33]. До достижения целевых показателей пациенты пересдавали уровень агрегации с периодичностью 1 раз в месяц, затем 1 раз в полгода. Терапевтический диапазон составил 3,5 ± 0,12 и 1,2 ± 0,11 мг/кг/сут для аспирина и клопидогрела соответственно. Изменение режима дозирования, смена препарата или назначение комбинированной антитромботической терапии осуществлялись при условии повторения тромботических событий, непереносимости или появления побочных явлений, при подозрении на резистентность в проводимой терапии. Такие коррективы понадобились 35,37 % (n = 29) детей с ИИ: при этом пришлось снизить дозировку трем, назначить комбинированную терапию четырем, поднять дозировку восьми, сменить препарат четырнадцати больным.
С учетом комбинированности этиологических факторов ОНМК, лабильности системы гемостаза у детей, возможной резистентности к терапии, возрастных особенностей фармакокинетики препаратов, потенциально высокого риска осложнений, в т.ч. негеморрагического спектра, нами было принято решение о необходимости мониторинга профиля безопасности для наших пациентов. Все больные приглашались с периодичностью 1 раз в месяц для оценки переносимости и эффективности получаемой терапии. Помимо опроса, осмотра кожных покровов/слизистых на предмет геморрагических симптомов все пациенты были обследованы на уровень агрегации с арахидоновой кислотой/коллагеном (если принимали аспирин) и АДФ (если получали клопидогрел) на аппарате импедансного агрегометра Multiplate analyzer (Roche, Швейцария). Титрование дозировки препаратов вели из расчета на килограмм массы тела и начиналось с минимально рекомендованной: у АСК – 2 мг/кг/сут, у клопидогрела – 0,2. Целевые значения агрегации считали достигнутыми при снижении показателей ниже 30 U [31, 32, 33]. До достижения целевых показателей пациенты пересдавали уровень агрегации с периодичностью 1 раз в месяц, затем 1 раз в полгода. Терапевтический диапазон составил 3,5 ± 0,12 и 1,2 ± 0,11 мг/кг/сут для аспирина и клопидогрела соответственно. Изменение режима дозирования, смена препарата или назначение комбинированной антитромботической терапии осуществлялись при условии повторения тромботических событий, непереносимости или появления побочных явлений, при подозрении на резистентность в проводимой терапии. Такие коррективы понадобились 35,37 % (n = 29) детей с ИИ: при этом пришлось снизить дозировку трем, назначить комбинированную терапию четырем, поднять дозировку восьми, сменить препарат четырнадцати больным.
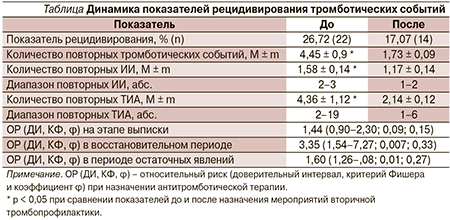
Продолжительность применения лекарственной терапии на регулярной ежедневной основе, без «лекарственных каникул», была рекомендована сроком на три года от достижения терапевтического значения лабораторных данных и отсутствия повторения тромботических событий. По окончании этого срока вставал вопрос об отмене антитромботических средств. Пациенты проходили спектр лабораторного обследования, отвечающий их патогенетическому типу ОНМК и известному перечню факторов риска. Если показатели всех лабораторных исследований оставались в пределах референсных значений, риск повторных тромбозов любой локализации расценивался как относительно низкий, мы проводили отмену терапии на полгода с повторной явкой и оценкой всех профильных показателей через полгода. В настоящее время (через шесть лет от старта программы в Екатеринбурге) таким условиям соответствовали 48,78 % детей (n = 40). Остальные пациенты продолжали получать антитромботическую терапию в связи незавершенным трехлетним сроком терапии, носительством комбинации тромбофильных полиморфизмов генов высокого риска, лабораторными признаками тромбофильной настроенности, сохранявшимся эмбологенным синдромом, повторявшимися эпизодами транзиторных ишемических атак (ТИА) и/или ИИ. Эффективность выбранной тактики ведения детей мы оценивали по уровню рецидивирования тромботических событий (см. таблицу).
Очевидно, что примененная нами политика активного сопровождения пациентов с ишемическим типом ОНМК показала себя эффективной как в индивидуальном плане, так и в виде динамики статистических показателей. Среднее число повторных тромботических событий, ишемических инсультов, ТИА и их диапазон достоверно уменьшились на фоне организованных мероприятий вторичной профилактики. И наоборот, несоблюдение мер по профилактике повторного тромбообразования сказывалось драматическим образом. Так, из 14 детей, перенесших повторный ИИ (у некоторых он был 3 или 4 по счету), у семерых отмена антитромботической терапии произошла по собственной инициативе или по решению родителей. Факт назначения или отсутствия назначения средств антитромботической направленности на всех этапах наблюдения показал относительно сильную связь между этим модифицируемым фактором риска и повторными ОНМК (по коэффициенту φ согласно рекомендациям Rea & Parker) и повышение вероятности рецидивирования ОНМК в 1,6–3,3 раза.
Таким образом, нами внедрена практика амбулаторного сопровождения пациентов, перенесших ИИ в нетипичном возрасте, в условиях крупного промышленного центра. Предложенная система мер подразумевала не только мониторинг тромботических событий, но и активное управление назначением препаратов антитромботического спектра с оценкой их эффективности по клиническим и лабораторным данным. Такой индивидуальный подход к мониторингу профиля эффективности и безопасности антитромботической терапии привел к изменению в тактике медикаментозного сопровождения детей в каждом третьем случае. Оценка результатов введенной схемы наблюдения показала снижение числа повторных ИИ и ТИА, а также их диапазона в 2 раза, несмотря на целый перечень факторов риска немодифицируемого круга (носительство комбинаций тромбофильных полиморфизмов генов, пороки сердца и т.д.).
За последние десятилетия произошел мощный прорыв в понимании патогенеза повторных сосудистых событий, сформировалось новое направление их фармакологической профилактики инсультов, основанное на знании свойств тромбоцитов и понимании механизмов тромбообразования. Несмотря на наличие широкого арсенала средств антитромбоцитарного действия, остается ряд нерешенных вопросов, а использование дезагрегантов в практике врачей-педиатров во многом ограничено. Продолжаются дискуссии вокруг режима дозирования, продолжительности терапии, оценки профилактического воздействия и вариантов комбинаций препаратов на детей и пациентов молодого возраста.
Практически отсутствуют данные о резистентности к дезагрегантам у больных инсультами. Важно, считают исследователи, что данные, представленные в когортных исследованиях, могут быть положены в основу разработки длительной стратегии изучения эффективности препаратов дезагрегантного спектра в качестве мер вторичной профилактики при ТИА и ИИ у детей и в молодом возрасте.



