Нестероидные противовоспалительные средства (НПВС) широко используются в медицинской практике лечения боли и воспаления. Наиболее часто НПВС назначают для лечения хронических заболеваний суставов. В различные периоды жизни боль, возникающая в результате поражения компонентов опорно-двигательного аппарата, встречается среди 20–45 % населения земного шара, чаще среди женщин, чем среди мужчин и в старших возрастных группах [1]. С учетом частого применения НПВС лицами старшего возраста вопросы безопасности их применения широко обсуждаются в литературе.
Наиболее часто описываются нежелательные явления (НЯ) НПВС со стороны желудочно-кишечного тракта (ЖКТ). Это связано и с большой частотой развития НПВС-гастропатии [2], и с тем, что использование НПВС именно лицами с воспалительными заболеваниями суставов чаще всего сопряжено с желудочно-кишечными осложнениями [3]. Внедрение в клиническую практику селективных ингибиторов циклооксигеназы 2 (ЦОГ-2) позволило значительно уменьшить частоту развития НПВС-гастропатии.
Сообщение о более высоком, чем в группе плацебо-контроля, риске кардиоваскулярных осложнений (КВО) на фоне применения целекоксиба в дозах 400–800 мг/сут в течение нескольких лет [4], полученные в поисковом исследовании «Профилактика колоректального рака», и данные исследования VIGOR [5], показавшие более высокую частоту КВО при применении рофекоксиба по сравнению с напроксеном, вызвали настороженность врачей к использованию селективных НПВС больными кардиоваскулярными (КВ) заболеваниями. По настоящее время для врачей лечение НПВС лиц, имеющих сопутствующую патологию со стороны сердечно-сосудистой системы, вызывает затруднения. Оценка КВ-безопасности НПВС актуальна и в связи с высокой частотой сопутствующей патологии у пациентов с заболеваниями опорно-двигательного аппарата, в первую очередь у больных остеоартрозом (ОА).
Например, в исследовании случай–контроль [6], проведенном в Великобритании, при сравнении частоты развития коморбидности у 11 375 больных ОА по сравнению с 11 780 лицами без ОА было выявлено увеличение частоты ожирения в 2,25 раза, гастрита – в 1,98, флебитов – в 1,8, грыж диафрагмы – в 1,8, ишемической болезни сердца (ИБС) – в 1,73, дивертикулеза кишечника – в 1,63 раза. В табл. 1 приведены данные различных авторов по частоте выявления сопутствующей патологии у больных ОА [7–11].
Видно, что наиболее частой сопутствующей патологией, по данным всех авторов, являются артериальная гипертензия (АГ), ИБС и диабет.
Известно, что для безопасного применения НПВС большое значение имеет своевременная оценка факторов риска развития осложнений. Наличие сопутствующих сердечно-сосудистых заболеваний – общеизвестный фактор риска непереносимости НПВС. В данном сообщении обобщены результаты рандомизированных контролируемых (РКИ) и наблюдательных исследований по КВ-безопасности НПВС.
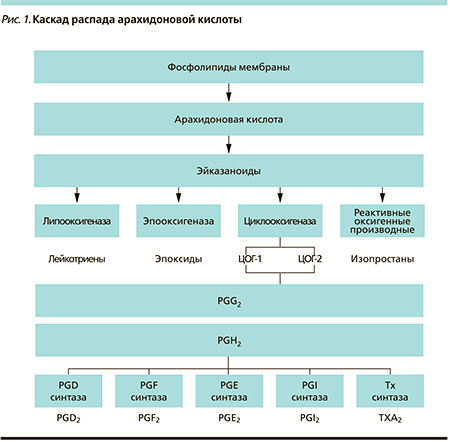
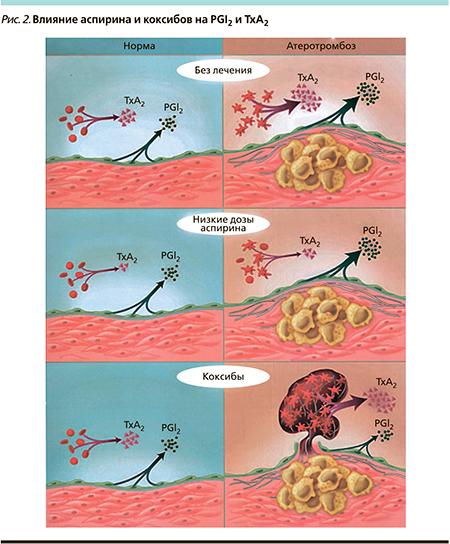
Хорошо известно, что увеличение КВ-риска, связанное с применением большинства НПВС, определяется механизмами их действия. Первичным свойством НПВС является ингибиция ЦОГ, приводящая к продукции простагландинов – PG [12, 13]. Обе изоформы ЦОГ (ЦОГ-1 и ЦОГ-2) участвуют в распаде арахидоновой кислоты до PGН2. Далее другие энзимы модифицируют этот продукт с генерацией биоактивных липидов (простаноидов), таких как простациклин (PGI2), тромбоксан А2 и PGD2, PGЕ2, PGF2 (рис. 1). С момента открытия возможности аспирина ингибировать функцию тромбоцитов антитромботический эффект НПВС занял важное место в стратегии лечения атеротромботической болезни. Эндотелиальный простаноид PGI2 обладает антитромботическим, а тромбоцитарный простаноид тромбоксан А2 – протромботическим действиями. Классические аспириноподобные НПВС подавляли ЦОГ в обоих типах клеток, что приводило к антитромботическому эффекту. Используемые в настоящее время дозы неселективных НПВС определяют превышение подавления синтеза тромбоксана А2 над таковым синтеза PGI2. В результате необратимая ингибиция ЦОГ аспирином и различия в периоде полужизни ингибируемых тромбоцитов и эндотелиальных клеток определяют возможность низких доз аспирина осуществлять достаточную атеротромботическую селективность для первичной и вторичной профилактики атеротромботических событий (рис. 2). Было установлено, что ЦОГ-2 экспрессируется нормальными эндотелиальными клетками в ответ на повреждение и что ингибиция ЦОГ-2 ассоциируется с подавлением синтеза PGI2 [14], который защищает эндотелиальные клетки и становится избыточно регулируемым при стрессе, следовательно, ЦОГ-2 оказывает протективный эффект на сосудистую систему. Недавние исследования показали, что ЦОГ-2 играет важную роль при повреждении или воспалении, а также участвует в поддержании гомеостаза через секрецию электролитов [15, 16]. Тромбоциты также играют важную роль в КВ-гомеостазе, но их действие связано с ЦОГ-1. Через ЦОГ-1 продуцируется тромбоксан (ТхА2), стимулирующий агрегацию тромбоцитов, вазоконстрикцию, увеличивающий сосудистое и кардиальное ремоделирование. Ингибиция ЦОГ-1 – наиболее важный фактор развития осложнений со стороны верхних отделов ЖКТ, в т.ч. кровотечения, развития НПВС-энтеропатии.
Таким образом, изоформы ЦОГ находятся в разных тканях и дифференцированно воздействуют на гомеостаз через различные простаноиды [17, 18]. При атеросклеротическом повреждении у человека определяются обе изоформы ЦОГ, а данные по их селективной ингибиции противоречивы.
И низкие дозы аспирина, и селективные ингибиторы ЦОГ-2 могут демонстрировать и улучшение [19, 20], и ухудшение [21] при гиперхолестеринемии и гипертензии. В экспериментах на гиперхолестеринемических мышах было показано, что ингибиция ЦОГ-2 может ухудшать, замедлять либо не оказывать влияния на течение атеросклероза [22–24]. Таким образом, объяснение тромбоза вследствие ингибиции ЦОГ не до конца доказано.
Тем не менее имеется ассоциация между степенью ингибиции ЦОГ-2 и тенденцией к тромбозу при лечении [23, 25, 26]. Гомеостаз КВ-системы определяется равновесием между PGI2 и ТхА2, и влияние НПВС определяется нарушением этого равновесия. Подавление ЦОГ-2 приводит к доминированию ТхА2, а ЦОГ-1 – к повышенному количеству PGI2. На этом и основано мнение о нарушении при ингибиции ЦОГ-2 протромботического/антитромботического баланса на эндотелии с последующим тромбозом [13, 25]. Кроме того, задержка натрия и жидкости приводит к отекам, нарастанию сердечной недостаточности (СН) и гипертензии, что также рассматривается как нарастание риска КВ-осложнений при ингибиции ОГ-2 [14].
Селективные ингибиторы ЦОГ-2 были внедрены в практику в 1990-е гг.
Первоначально внимание исследователей было привлечено к оценке безопасности препаратов этого класса в отношении ЖК-осложнений. Как уже упоминалось выше, внимание к изучению риска КВ-осложнений при применении ингибиторов ЦОГ-2 было привлечено после публикации данных исследования VIGOR в 2000 г., в котором впервые было показано увеличение КВ-риска селективных НПВС по сравнению с неселективными [5]. Однако данные параллельно проводимых контролируемых исследований возможностей целекоксиба в профилактике семейного аденоматозного полипоза (по сравнению с плацебо) и болезни Альцгеймера (по сравнению с плацебо) и напроксена показали отсутствие увеличения КВ-риска на фоне применения целекоксиба [27, 28].
Более того, риск КВ-осложнений был в 2 раза увеличен при использовании неселективного препарата напроксен (440 мг/сут – крайне низкая доза). Также детальный анализ данных исследования VIGOR показал несопоставимость больных в группах по КВ-анамнезу, т.к. основной целью сравнительного исследования было оценить ЖК-переносимость препаратов. Тем не менее исследование APPROVE [29] подтвердило, что рофекоксиб в дозе более 12,5 мг значимо увеличивает риск КВ-осложнений, что послужило основанием вывода этого препарата из клинической практики.
Было проведено сравнительное когортное исследование частоты тромботических осложнений при применении мелоксикама 19 087 больными (декабрь 1996 – март 1997 г.), рофекоксиба 15 268 (июль–ноябрь 1999 г.) [30] и целекоксиба 17 458 больными (май – декабрь 2000 г.) [31]. При стратификации больных в группах по полу и возрасту было выявлено, что более высокий риск цереброваскулярных осложнений имеется на фоне применения рофекоксиба по сравнению с мелоксикамом – 1,68 (95 % доверительный интервал [ДИ] – 1,15–1,46) и отсутствуют различия по КВ-тромбоэмболическим явлениям между ними.
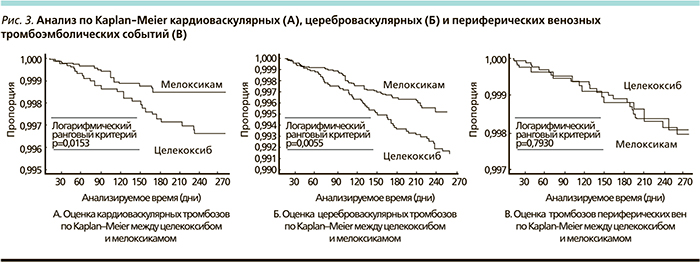
Кроме того, более высокий риск цереброваскулярных событий показал целекоксиб (относительный риск [ОР] = 1,66, 95 % ДИ – 1,10–2,51) по сравнению с мелоксикамом без явных различий риска развития КВ или периферических тромботических и тромбоэмболических явлений (рис. 3). В 2006 г. в исследовании MEDAL, в котором сравнивали эторикоксиб с диклофенаком, не было найдено различий в частоте тромботических КВ-событий [32].
При оценке течения сопутствующей патологии у 27 039 больных было показано, что мелоксикам не ухудшает течение АГ, ИБС, не увеличивает отеки, частоту инфаркта миокарда (ИМ) или тромботических явлений [33].
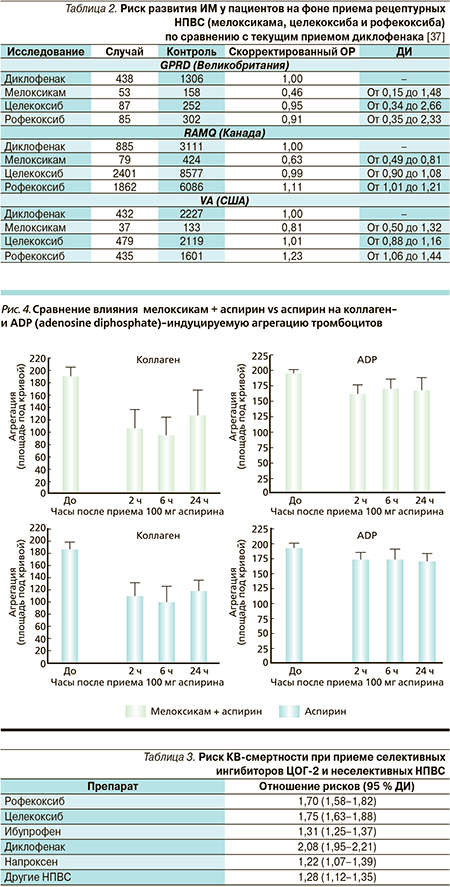
В соответствии с современными рекомендациями у пациентов с риском КВ-осложнений применение селективных НПВС должно сочетаться с приемом низких доз аспирина. Примечательно, что одновременное применение мелоксикама и аспирина не влияло на дезагрегантное действие последнего [34] (рис. 4).
При оценке риска развития острого ИМ при приеме различных НПВС в сочетании с низкими дозами аспирина [35] было показано, что наименьший риск зарегистрирован в группе больных, получавших мелоксикам, и составил 0,53 (0,26–1,10) по сравнению с сулиндаком 0,77 (0,32–1,85), целекоксибом 0,88 (0,76–1,02), рофекоксибом 1,03 (0,86–1,24), ибупрофеном 1,20 (0,94–1,51) и индометацином 1,21 (0,65–2,27).
Было проведено пилотное исследование сравнения гепарина, аспирина + плацебо (1-я группа) или + мелоксикам 15 мг внутривенно, затем перорально (2-я группа) в лечении нестабильной стенокардии без поъема сегмента ST: отмечено, что рецидивы стенокардии, ИМ достоверно ниже при присоединении мелоксикама (р = 0,007); 15 против 38,3 % только на гепарине и аспирине [36]. Эти данные свидетельствуют об относительной безопасности использования мелоксикама больными с риском КВ-осложнений. Хотя эти больные нуждаются в тщательном мониторинге.
Риск развития острого ИМ при использовании селективных и неселективных НПВС был оценен в трех популяциях трех стран (Великобритания, Канада и США) [37]. Целью исследования была оценка риска развития ИМ у пациентов, принимающих ингибиторы ЦОГ-2, мелоксикам и другие НПВС, по сравнению с диклофенаком; проверить сопоставимость данных по трем популяциям (когортам). Всего было проанализировано 60 473 случая лечения НПВС и 248 768 случаев контроля.
Получены следующие результаты:
В одной когорте мелоксикам был связан со сниженным риском развития ИМ, а в двух не было установлено какого-либо эффекта (хотя ОР в обоих исследованиях был снижен).
В одной когорте напроксен был связан со сниженным риском развития ИМ, а в двух риск был несколько повышен.
В двух когортах риск развития ИМ при приеме рофекоксиба был несколько повышен по сравнению с диклофенаком.
В одной когорте было обнаружено небольшое увеличение риска для ибупрофена по сравнению с диклофенаком.
Не было обнаружено различий между целекоксибом и диклофенаком.
В GPRD (Великобритания) не было обнаружено значительных различий, хотя ОР для мелоксикама был ниже 1,0, а для напроксена был несколько повышен.
В RAMQ (Канада) было обнаружено небольшое статистически значимое увеличение риска при приеме рофекоксиба и снижение риска при приеме мелоксикама и напроксена.
В VA (США) было обнаружено небольшое, но статистически значимое увеличение риска для рофекоксиба, напроксена и ибупрофена и снижение риска для мелоксикама.
Риск развития ИМ у пациентов не фоне приема рецептурных НПВС (мелоксикама, целекоксиба и рофекоксиба) по сравнению с текущим приемом диклофенака представлен в табл. 2.
Видно, что во всех трех когортах мелоксикам продемонстрировал меньший риск ИМ, чем препараты сравнения.
Наблюдательные исследования подтвердили данные РКИ по рофекоксибу, показали некоторые расхождения результатов при использовании целекоксиба и показали нарастание КВ-риска при использовании высоких доз неселективных традиционных НПВС [23, 27, 38–40]. Результаты некоторых из этих исследований свидетельствуют, что целекоксиб может быть более токсичным для пациентов с исходно более высоким КВ-риском [27, 41]. КВ-риск возрастает также при использовании высоких доз целекоксиба [27]. Мета-анализ РКИ [42] показал, что селективные ЦОГ-2-ингибиторы по сравнению с плацебо увеличивают риск КВ-осложнений (ОР = 1,42, 95 % ДИ – 1,13–1,78) и ИМ (ОР = 1,86, 95 % ДИ – 1,33–2,59). При сравнении селективных ингибиторов ЦОГ-2 с неселективными НПВС различий в КВ-риске не выявлено: 1 %/год при применении селективных ингибиторов ЦОГ-2 и 0,9 %/год при применении неселективных НПВС. Была выявлена гетерогенность между частотой КВ-событий в исследованиях, сравнивавших ингибиторы ЦОГ-2 с напроксеном или сравнивавших их с другими неселективными НПВС (χ2 = 10,2, р = 0,001). Сравнение неселективных НПВС с плацебо выявило увеличение КВ-риска при использовании ибупрофена (ОР = 1,51; 95 % ДИ – 0,96–2,37) и диклофенака (ОР = 1,63, 95 % ДИ – 1,12–2,37), но не напроксена (ОР = 0,96; 95 % ДИ – 0,67–1,26). Для ибупрофена и диклофенака мета-анализ установил дозозависимое увеличение риска КВ-осложнений, риск увеличивался при использовании суточных доз ибупрофена ≥1800 мг и для диклофенака ≥150 мг. В данный мета-анализ включены РКИ длительностью более 4 недель (9 длительных исследований > 1 года, в среднем 139 недель, и 112 коротких исследований, в среднем по 11 недель). Исследования проведены в различных популяциях больных: болезнь Альцгеймера, полипозная болезнь и ревматоидный артрит.
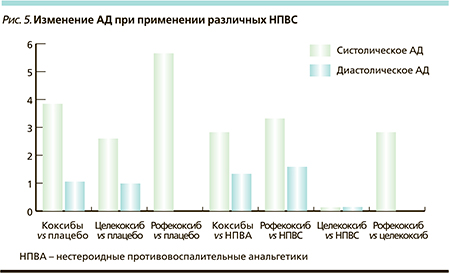
Применение ряда неселективных НПВС, в первую очередь производных индолуксусной кислоты, ассоциировалось с увеличением артериального давления (АД). Хорошо известен факт, что неселективные НПВС уменьшают гипотензивный эффект большинства препаратов, используемых для снижения АД, кроме блокаторов кальциевых каналов. В мета-анализе, включившем 19 РКИ, в которых оценивали АД при лечении НПВС (всего 45 451 пациент), использовался метод определения взвешенной разницы (ВР) АД за время интервенции (Cohen метод) [43]. Было показано, что коксибы недостоверно увеличивают систолическое и диастолическое АД по сравнению с плацебо (ВР 3,85/1,06) и неселективными НПВС (ВР 2,83/1,34) (рис. 5). Лечение коксибами ассоциировалось с недостоверным нарастанием риска развития АГ по сравнению с плацебо (ОР = 1,61, 95 % ДИ – 0,91–2,84; p = 1,0) и неселективными НПВС (ОР = 1,25, 95 % ДИ – 0,87–1,78; р = 2,3). Рофекоксиб достоверно больше, чем целекоксиб, увеличивал ВР АД и риск АГ. Как видно из рис. 5, в наибольшей степени увеличение ВР касалось систолического, а не диастолического АД. Изменение именно пульсового давления приводит к увеличению КВ-риска. Поскольку селективные ингибиторы ЦОГ-2 используются наиболее широко при ревматических заболеваниях и преимущественно пожилыми пациентами, зачастую имеющими сопутствующие КВ-болезни, даже небольшое изменение АД может оказаться клинически значимым. При назначении НПВС любого класса необходим мониторинг АД, особенно при наличии коморбидных состояний.
Оценка влияния приема НПВС на течение сердечной недостаточности (СН) была проведена при помощи мета-анализа наблюдательных исследований и РКИ [44]. По данным 5 исследований по методу случай–контроль (4657 пациентов и 45 862 контроль), выявлена недостоверная ассоциация между приемом НПВС и СН (OР = 1,36; 95 % ДИ – 0,99–1,85). Два когортных исследования (27 419 пациенто-лет и 55 367 контроль-лет) продемонстрировали достоверное увеличение риска СН (OР = 1,97; 95 % ДИ – 1,73–2,25). Шесть РКИ (по сравнению напроксена, рофекоксиба и целекоксиба с плацебо) при неревматических заболеваниях (15 750 пациентов) показали нарастание СН при использовании НПВС по сравнению с плацебо (OР = 2,31; 95 % ДИ – 1,34–4,00). Шесть РКИ, сравнивавших неселективные и селективные НПВС (62 653 пациента), не выявили различий в риске СН между группами препаратов (OР = 1,14; 95 % ДИ – 0,85–1,53).
Таким образом, наблюдательные исследования и РКИ показали, что использование НПВС сопряжено с увеличением риска СН, но этот иск мал и схож с традиционными НПВС и коксибами. Наличие у больного предшествующей назначению НПВС СН увеличивает риск ее нарастания. Более того, наличие СН у больного и необходимость использования НПВС увеличивают смертность от КВ-событий (ИМ или СН) [45]. Риск увеличения КВ-смертности при приеме различных НПВС приведен в табл. 3.
Заключение
НПВС увеличивают риск КВ-ослож-нений и КВ-смертности независимо от их селективности в отношении ингибиции ЦОГ-2. Среди селективных ингибиторов ЦОГ-2 наименьшим риском развития ИМ обладает мелоксикам, хотя большинство мета-анализов рассматривали сравнительные аспекты увеличения КВ-риска при приеме коксибов или традиционных НПВС. Среди неселективных НПВС наименьшим КВ-риском обладает напроксен. Тем не менее развитие любого КВ-осложнения возможно при использовании любого НПВС, особенно у лиц с коморбидными сердечно-сосудистыми заболеваниями. В связи с этим рекомендации использования как можно более низких доз НПВС и в более короткие сроки представляются весьма обоснованными.



