Актуальность проблемы фиброза печени
За последние десятилетия вопросам оценки фиброза печени (ФП) посвящена масса как клинических, так и экспериментальных исследований. Предприняты попытки стандартизации правил ведения пациентов с продвинутым фиброзом и циррозом печени (ЦП), определена тактика применения ряда патогенетических препаратов. Однако остаются нерешенными вопросы прогрессирования фиброза как прогностического маркера фатальных осложнений и методы коррекции подобных нарушений.
Во многом результаты проведенных исследований остаются довольно противоречивыми, что значимо затрудняет работу клинициста.
Смертность от терминальной стадии ФП – цирроза – занимает 9-е место в мире среди всех причин смерти и 6-е – среди лиц наиболее трудоспособного возраста, составив от 14 до 30 случаев на 100 тыс. населения.
В России эти показатели значительно выше и, по разным источникам, достигают 60,5 случая на 100 тыс. населения [1]. Крайне неблагоприятным остается наличие высокого риска развития гепатоцеллюлярной карциномы у пациентов с ФП – почти в 30 раз чаще. Именно поэтому ранняя диагностика, разработка критериев прогрессирования ФП и методов его коррекции представляются чрезвычайно важной и жизнеобеспечивающей задачей.
Механизмы формирования ФП
Механизм развития ФП вытекает из многогранности морфологической реакции печени на повреждение, а именно: стеатоза, пигментного отложения, тромбоза, апоптоза, некроза, адаптации, пролиферации гепатоцитов и собственно фиброзных изменений. При этом независимо от этиологического фактора только выраженность фиброгенеза определяет, на какой стадии находится заболевание, т.е. фиброз служит именно тем показателем, который отражает темпы прогрессирования хронических диффузных поражений печени.
Новые взгляды на формирование процессов ФП и ЦП рассматривают тот факт, что фиброз в настоящее время не является билетом в один конец до цирроза: возможен регресс, обратное развитие [2–4].
Эволюция фиброза в ЦП – это не просто процессы рубцевания и замещения соединительной тканью, а часть хронического заболевания печени, включающая воспаление, ангиогенез, ремоделирование и образование коллагена. То есть ведущим фактором формирования ЦП является не рост соединительной ткани, а ангиогенез. Так, в эксперименте распространенность фиброза коррелировала с сосудистым показателем портальной гипертензии HVPG (hepatic venous pressure gradient – градиент венозного давления в печени).
По сути, выраженность фиброза и размеры узлов являются предикторами значимой портальной гипертензии (ПГ) (более 10 мм рт. ст.), с которой и связан дальнейший прогноз заболевания. Исходя из известных данных об особенностях строения портального русла, его связей с другими сосудистыми системами организма, а также сведений о факторах, влияющих на состояние сосудистой стенки, можно сформулировать основные физиологические механизмы, определяющие уровень давления в воротной вене [5, 6].
К ним относятся:
- Внутрипеченочная и портальная сосудистая резистентность.
- Объем крови в портальном сосудистом русле печени.
- Состояние сердечно-сосудистой системы.
Внутрипеченочная и портальная сосудистая резистентность
На этот наиболее важный механизм поддержания портального давления влияют:
- Взаимоотношение клеток синусоидального компартмента (клеток Ито, макрофагов Купфера, эндотелиоцитов). Клетки Ито, подвергаясь регулирующим влияниям вегетативной нервной системы (ВНС), вазоактивных веществ, цитокинов, хемокинов, интегринов, способны сокращаться, изменяя просвет синусоидов. Эндотелиальные клетки при этом играют роль сфинктеров. Макрофаги в свою очередь выделяют вазоактивные субстанции, влияющие на функциональную активность клеток Ито и эндотелиоцитов [7, 8].
- Состояние ВНС. Медиаторы ВНС оказывают непосредственное влияние на рецепторы клеток синусоидов, а также сосудов внутрипеченочного и общего сосудистого русла.
- Соотношение гуморально-метаболических факторов (вазоактивных субстанций). Вазодилататоры (оксид азота, оксид углерода, простациклин, глюкагон, простагландин Е2, предсердный натрийуретический гормон) и вазоконстрикторы (эндотелины ЕТ1, ЕТ2, адреналин, ангиотензин II, вазопрессин, цитокины – интерлейкин IL-1, серотонин) воздействуют на клетки синусоидального компартмента и рецепторы сосудистой стенки.
- Реологические свойства крови в синусоидах и внутрипеченочных сосудах.
Степень фиброзных нарушений коррелирует с тяжестью микроциркуляторных расстройств как на уровне крупных сосудов печени, так и на синусоидальном этапе, усугубляя состояние гипоксии, радикального окисления, эндотелиальной дисфункции и стимуляции в этих условиях фиброгенеза.
Объем крови в портальном сосудистом русле печени
Известно, что величина портального кровотока зависит от двух основных факторов:
- Градиента давления между капиллярной системой брюшной полости и синусоидальным руслом печени. Важно подчеркнуть, что уровень давления в первой капиллярной сети составляет 110 мм рт. ст., во второй – всего 10. Следовательно, основную роль в изменении портального кровотока играет капиллярная система органов брюшной полости, которая, по сути, является мощным «физиологическим краном», регулирующим перепад системного и внутрипеченочного давления [9].
- Гидромеханического сопротивления сосудов портальной системы, величина которого определяется суммарным сопротивлением первой и второй капиллярных систем. Изменение сопротивления на уровне хотя бы одной капиллярной системы приводит к перемене суммарного сопротивления и увеличению или уменьшению портального кровотока. Значительные колебания гидромеханического сопротивления происходят в результате изменения просвета сосудов под влиянием нервной и гуморальной регуляции.
Состояние сердечно-сосудистой системы
Наиболее существенное значение в поддержании портального давления имеют:
- Тип центральной гемодинамики. Через портальное русло в норме протекает около 30 % минутного объема кровотока. Увеличение последнего при гиперкинетическом типе центральной гемодинамики может приводить к росту давления в воротной вене за счет повышения портального кровотока [29].
- Сердечный выброс и уровень артериального давления. Кровоток в системе воротной вены зависит от градиента давления между чревной артерией, системой синусоидов и печеночных вен. Уровень артериального давления в мезентеральных артериях в свою очередь связан с величиной сердечного выброса, т.е. с систолическим давлением. Повышение последнего может, вероятно, приводить к нарастанию давления в портальной системе за счет увеличения портального кровотока, что приводит с компенсаторной стимуляции ренин-ангиотензин-альдостероновой системы (РААС).
Нарушение равновесия между тонкими физиологическими механизмами, влияющими на фиброгенез, и связанное с ним состояние кровотока в воротной вене приводят к возникновению ПГ и ЦП.
Согласно современным генетическим исследованиям, установлена значимость полиморфизма генов в прогрессировании фиброза при хронических заболеваниях печени. В основе формирования фиброзных изменений в органе лежит количественный и качественный дисбаланс составляющих экстрацеллюлярного коллагенового матрикса (ЭКМ). Уже при умеренной 2-й стадии фиброза ЭКМ печени (коллагены [1-й, 3-й и 4-й типов], фибронектин, ундулин, эластин, ламинин, гиалуронан и протеогликаны) превышает нормальные значения в 3–4 раза, что обусловлено как интенсивным его синтезом, так и снижением деградации его элементов [10].
Основной источник ЭКМ в поврежденной ткани печени – это звездчатые клетки печени (ЗКП), в норме располагающиеся в пространстве Диссе.
В результате длительного хронического повреждения любой природы развивается активация ЗКП, дифференцировка их в миофибробластоподобные структуры, обладающие сократительными, провоспалительными и фиброгенетическими характеристиками. Активированные ЗКП мигрируют и локализуются в очаге повреждения, секретируя при этом массу ЭКМ (см. рисунок).
Важен тот факт, что ряд других печеночных клеток, таких как миофибробласты из мелких портальных сосудов, также могут иметь фиброз-продуцирующую способность, которая активируется вокруг билиарного тракта печени при холестазе, что обусловливает дополнительное накопление коллагена. В целом холестаз принципиально меняет прогноз заболевания печени, являясь независимым фактором фиброза.
Кроме этого ЗКП и портальные миофибробласты дифференцируются в специфические клетки, отвечающие на стимулы апоптоза. Научная и, возможно, практическая важность каждого клеточного типа при ФП может зависеть от этиологии гепатоцеллюлярного повреждения. Так, ЗКП – основная единица, участвующая в фиброгенезе перицентральной области, а портально расположенные миофибробласты превалируют при повреждении печени вокруг портальных трактов. При этом необходимо отметить, что в процессе фиброгенеза существует сложное взаимодействие между различными типами печеночных клеток [11].
Непосредственными факторами управления фиброгенезом являются универсальные, а в ряде случаев специфические цитокины, вырабатываемые клетками синусоидального компартмента и регулирующие воспалительный ответ на повреждение гепатоцитов.
К известным стимуляторам фиброгенеза можно отнести моноцитарный хемотаксический белок 1-го типа, фактор роста TGF-β1, способствующий трансформации ЗКП в миофибробластоподобные клетки, стимулируя синтез ЭКМ и ингибируя его деградацию. Именно поэтому продолжается поиск лекарственных средств, воздействующих на TGF- β1, что значимо могло бы снизить темпы фиброза [12].
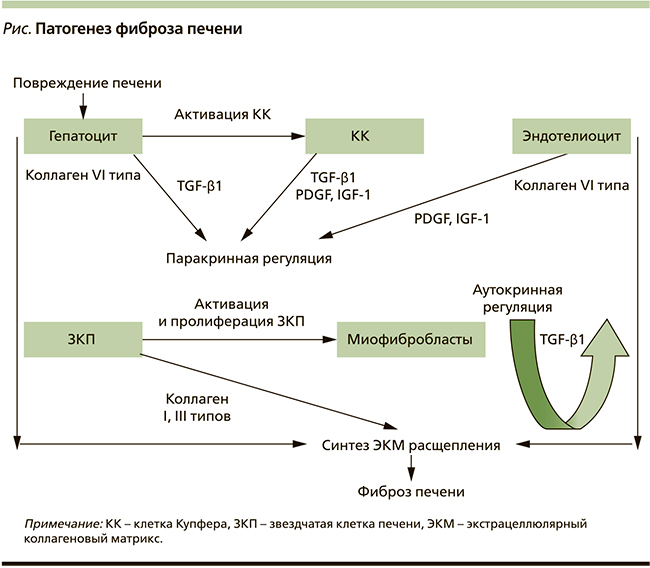
К фиброгенным субстанциям относят и мощный митоген ЗКП – PDGF, который приводит к нарушению их регуляции в печени с последующим прогрессированием фиброзных изменений. Провоспалительный IL-10 и интерферон-γ при этом оказывают мощное антифибротическое действие [13].
Цитокины с вазоактивными свойствами также играют важную роль в процессе формирования и прогрессирования ФП. Так, вазодилатирующие субстанции, такие как оксид и нитрит азота, релаксин, обладают антифибротическими свойствами, в то время как вазоконстрикторы норадреналин и ангиотензин II, которым, по данным ряда авторов, принадлежит главенствующая роль в фиброгенезе печени, способствуют ускорению патологического процесса синтеза соединительной ткани в печени. Мощный вазоконстриктор эндотелеин-1 тоже стимулирует темпы прогрессирования фиброзных изменений в ткани печени, воздействуя на рецепторы типа А.
Таким образом, патогенез ФП на сегодняшний день рассматривается как эволюционный процесс, включающий интимные взаимодействия клеток портального континуума и представляющий собой последовательную цепь событий: повреждение, активацию фиброз-продуцирующих клеток, эндотелиальную дисфункцию, развитие внутрипеченочной (синусоидальной) ПГ, стимуляцию ангиогенеза и последующее накопление соединительной ткани в органе. Соответственно, предикторами активного фиброгенеза будут являться не только факторы, стимулирующие рост соединительной ткани, но и причины, усугубляющие вышеописанные факторы этого многоуровневого процесса [14].
Предикторы ФП:
- Холестаз во всех проявлениях.
- Возраст старше 45 лет, т.к. к этому моменту самостоятельно накапливается множество соединительной ткани и процессы заместительного фиброгенеза протекают быстрее.
- Мужской пол как фактор риска развития ПГ.
- Вирусная нагрузка при НВV-инфекции.
- Синдром перегрузки железом.
- Злоупотребление алкоголем.
- Инсулинорезистентность.
- Некорригируемая ПГ.
- Сопутствующая сердечная недостаточность.
Методы оценки ФП
В настоящее время предлагается множество методов оценки фиброза, которые можно разделить на несколько групп:
I. Лабораторные методы
1) Прямые маркеры фиброза – характеризуют метаболизм внеклеточного матрикса (фиброгенез и фибринолиз) и/или изменения в ЗКП:
- гиалуроновая кислота – полисахарид, присутствующий в ЭКМ и повышающийся в сыворотке пациентов с фиброзом печени;
- проколлагеновые пептиды, N-терминальный пептид проколлагена III – продукт расщепления коллагена;
- коллагены IV и VI, матриксные металлопротеиназы – семейство ферментов, расщепляющих белки клеточного матрикса, когда таких белков в избытке (фибринолиз);
- TIMP-I – тканевый ингибитор металлопротеиназы-1, опосредованно способствующий синтезу белков матрикса;
- YKL-40 – гликопротеин, участвующий в расщеплении ЭКМ;
- ламинин и пепсин-резистентный фрагмент ламинина – основные неколлагеновые гликопротеины, сывороточный уровень которых увеличивается при хронических заболеваниях печени независимо от этиологии и отражает наличие перисинусоидального фиброза.
2) Непрямые маркеры фиброза. Это традиционные сывороточные маркеры, т.е. молекулы, высвобождаемые в кровь из-за воспалительного процесса, осуществляющегося в печени:
- аминотрансферазы: АЛТ (наиболее чувствительный и специфичный индикатор гепатоцеллюлярного повреждения [воспаление и некроз гепатоцитов] и АСТ; соотношение уровней АСТ/АЛТ (коэффициент Де Ритиса);
- молекулы, синтезируемые, регулируемые или секретируемые печенью, например:
- аполипопротеин А1. Установлено, что с повышением стадии фиброза сывороточный уровень аполипопротеина А1 снижается;
- альфа-2-макроглобулин (А2М). Повышенный А2М – маркер тяжести воспалительного процесса в печени;
- количество тромбоцитов. Используется как показатель тяжести фиброза, хотя также отражает выраженность гиперспленизма;
- гаптоглобин. Связывает свободный гемоглобин (высвобождающийся из эритроцитов), является важным реактантом острой фазы. Имеет отрицательную связь с ФП. Пониженный гаптоглобин – маркер тяжести воспалительного процесса в печени;
- гамма-глутамилтранспептидаза (ГГТП). Известно 5 патологических процессов, способствующих повышению активности ГГТП: цитолиз, холестаз, интоксикация алкоголем, опухолевый рост в печени, воздействие гепатотоксичных препаратов (лекарственный гепатит) и др.
В настоящее время наиболее актуальны непрямые маркеры, методом дискриминантного анализа объединенные в комплексные тесты (фиброакти-тест, фибромакс-тест, стеатоскрин и др.) [15].
II. Инструментальные методы оценки ФП
1) Визуализирующие методы обследования. Широко распространенные и доступные методы визуального неинвазивного обследования (ультразвуковая диагностика и компьютерная томография) могут применяться для установления диагноза ФП, признаков ПГ, ряда сосудистых нарушений (допплерография сосудов портальной системы), однако их диагностическая информативность низка.
2) Эластография печени. Элас-тография – неинвазивная технология улучшения визуализации неоднородностей мягких тканей по их сдвиговым характеристикам. На исследуемую ткань воздействует дополнительное давление, из-за неодинаковой эластичности неоднородные элементы ткани сокращаются в разной степени. Скорость распространения упругих волн определяется эластичностью печеночной ткани, что позволяет выявлять патологические участки в органе. Косвенная инструментальная оценка выраженности фиброза посредством измерения эластичности печени с помощью аппарата «ФиброСкан» основана на генерации низкочастотных колебаний, передающихся на ткань печени. Принципом методики является использование колебаний низкой частоты для количественной оценки эластичности как показателя состояния печени и процентного содержания в ней соединительной ткани. Доказана положительная корреляционная связь между результатами, полученными при эластографии, и такой ведущей диагностической процедурой, как биопсия печени [16, 17]. Перспективным может считаться магнитно-резонансная эластография – прямой метод определения плотности печени, позволяющий определить F0, что доказывает высокую точность оценки фиброза.
3) Биопсия печени. На основании результатов данной процедуры можно диагностировать ФП с достаточно высокой степенью специфичности. Столь важное инвазивное исследование проводится только в специализированных лечебных учреждениях, требует высокого профессионализма гепатолога-клинициста и патоморфолога. Нельзя забывать, что при проведении гепатобиопсии возможно развитие осложнений (до 3 % случаев). Существуют и определенные трудности, т.к. в 15–35 % наблюдений при выполнении пункционной биопсии печени получают неизмененную ткань печени, в 1,5 % – неинформативный материал [18–20].
Классификация ФП
Классификация ФП, которой большинство авторов пользуется до настоящего времени, была предложена на конгрессе гепатологов в 1994 г. в Лос-Анджелесе. Она рассматривает наличие фиброза, стадию заболевания:
0 – фиброз отсутствует;
1 – слабовыраженный перипортальный фиброз;
2 – умеренный фиброз с портопортальными септами;
3 – выраженный фиброз с портоцентральными септами;
4 – ЦП.
Все последующие классификации включают вышеизложенную как составную часть, имея особенности при отдельных нозологических формах [21, 22].
Принципы терапии ФП
Еще в 2003 г. R. Safadi и S.L. Friedman разработали принципы идеальной антифибротической терапии, которая должна включать воздействие на все патогенетические звенья фиброгенеза. К основным направлениям антифибротической терапии были отнесены следующие:
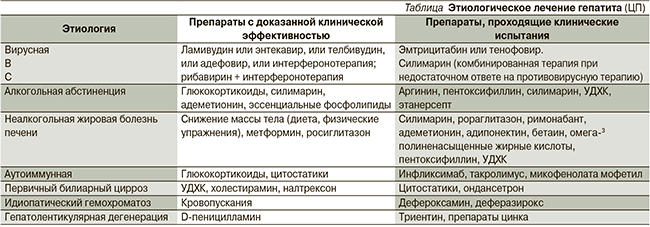
I. Устранение этиологического фактора (см. таблицу), которое включает:
- лечение хронической вирусной инфекции;
- отмену препаратов гепатотоксического действия;
- устранение приема алкоголя;
- нормализацию обменных и метаболических нарушений;
- эрадикацию паразитарной инвазии;
- устранение билиарной обструкции.
II. Устранение воспалительных изменений в печени, включающее:
- препараты урсодезоксихолевой кислоты (УДХК);
- глюкокортикостероиды и иммунодепрессанты;
- антагонисты цитокиновых рецепторов;
- ингибиторы ангиотензин-превращающего фермента;
- ингибиторы цитохрома Р450 (малотилат);
- селективные ингибиторы ЦОГ-2;
- блокаторы клеток Купфера.
III. Ингибирование активации ЗКП:
- антиоксиданты (витамин Е, фосфатидилхолин);
- цитокины;
- антагонисты эндотелин-рецеп-торов;
- сафиронил;
- препараты растительного происхождения (силибинин);
- антагонисты клеточного «фибронектина».
IV. Подавление эффектов активированных ЗКП:
1. Подавление антипролиферативной активности:
- антагонисты цитокиновых рецепторов;
- ингибиторы липогеназы, тирозинкиназы;
- симвастатин;
- пентоксифиллин;
- парамицин.
2. Антифибротическое действие:
- ингибиторы пропилгидроксилазы;
- фактор роста гепатоцитов;
- IL-10;
- антагонисты трансформирующего фактора роста-β1;
- ингибиторы тканевых протеаз;
- ингибиторы ангиотензин-превра-щающего фермента;
- релаксин;
- галофугинон.
3. Антиконтрактильное действие:
- антагонисты эндотелин-рецеп-торов;
- донаторы NO.
V. Повышение репарации тканей:
- антагонисты трансформирующего фактора роста-β1;
- релаксин;
- металлопротеиназы;
VI. Стимуляция клеточного апоптоза:
- глиотоксин;
- «интегрированные» антагонисты.
При этом перечень направлений для лечения ФП в своем большинстве является больше перспективным и не может адекватно применяться в клинической практике. Поэтому чрезвычайно актуальным остается поиск новых подходов к коррекции данного состояния.
До настоящего времени каких-либо стандартов лечения ФП не разработано, хотя существует ряд экспериментальных моделей исследования.
Основные подходы терапии фиб-роза:
- лечение основного заболевания или прерывание патогенетической цепи в случаях неустановленной этиологии хронических заболеваний печени (аутоиммунные заболевания, например) с целью устранения этиологического фактора фиброза [23–26];
- уменьшение активности воспалительного процесса в печени;
- «торможение активации», стимулированный апоптоз ЗКП;
- активация механизмов фибролиза для разрушения избытка белков ЭКМ;
- воздействие на ПГ.
Лекарственные средства, используемые для терапии ФП
Все лекарственные средства терапии ФП теоретически можно разделить на две большие группы – это препараты, действующие на конкретные механизмы фиброгенеза, и препараты неспецифического действия [27].
К препаратам, действующим на конкретные механизмы фиброгенеза, относят:
- интерфероны;
- синтетические аналоги нуклеозидов;
- УДХК;
- препараты, снижающие концентрацию TNF-α (пентоксифиллин, глицирризиновая кислота, бигуаниды);
- препараты, подавляющие избыточную активацию макрофагов и снижающие уровень TGF-β (ингибиторы рецепторов ангиотензина);
- антагонисты эндотелина (амбрисентан, бозентан, ситаксентан, тезосентан);
- ингибиторы: каспаз (GS9450); апоптоза (TRO19622); фосфодиэстеразы (ASP9831).
К препаратам неспецифического действия относят:
- мембраностабилизаторы и антиоксиданты (препараты янтарной кислоты);
- флавоноиды;
- фосфатидилхолин.
Для эффективного воздействия на многокомпонентный механизм развития фиброзных изменений печени целесообразно применение препаратов, воздействующих на большинство значимых этапов фиброгенеза. Именно поэтому в основных требованиях к идеальному гепатопротектору (согласно R. Preisig) одним из пунктов является адекватное подавление фиброгенеза.
Так, такие лекарственные средства, как УДХК, эссенциальные фосфолипиды и глицирризиновая кислота, витамин Е, силимарин, и S-аденозил-L-метионин, ингибируют активацию ЗКП, защищают гепатоциты от апоптоза, блокируют синтез TGF-β и таким образом способствуют уменьшению экспериментального ФП.
Урсодезоксихолевая кислота (Урдокса) – гидрофильная нетоксичная третичная желчная кислота, образующаяся под действием бактериальных ферментов из 7-кето-литохолевой кислоты, поступающей из тонкой кишки. Урсодезоксихолевая кислота (Урдокса) является на сегодняшний день единственным билиарным реокорректором. Более того, препараты желчных кислот по заключению управления контроля качества продуктов и лекарственных средств США (FDA) – единственные, зарегистрированные как лекарственное средство. Антифибротический эффект УДХК доказан при холестазе, когда она уменьшает высвобождение цитохрома С, щелочной фосфатазы и лактатдегидрогеназы, подавляет активность ЗКП и перисинусоидальное коллагенообразование, в итоге предупреждая развитие ФП. Существует также ряд дополнительных эффектов УДХК, опосредованно связанных с антифибротический действием:
- цитопротективный – вследствие наличия гидрофильности улучшает текучесть фосфолипидного бислоя мембраны гепатоцитов, восстанавливает структуру клеток и защищает их от повреждений;
- антиоксидантный – УДХК предупреждает оксидативное повреждение клеток печени и желчных путей вследствие блокирования высвобождения свободных ОНz радикалов, подавляет процессы перекисного окисления липидов;
- гепатопротективный – УДХК образует двойные молекулы, которые встраиваются в фосфолипидный биослой мембраны гепатоцитов, в результате происходит стабилизация ее структуры;
- иммуномодулирующий – снижается синтез иммунокомпетентного IgM, в меньшей степени – IgG, уменьшается экспрессия антигенов гистосовместимости на гепатоцитах и холангиоцитах, что в свою очередь предотвращает активацию цитотоксических Т-лимфоцитов, а также уменьшает продукцию аутоантител и способствует снижению иммунопатологичесих реакций;
- антиапоптотический – регуляция апоптоза, за счет уменьшения концентрации ионизированного Са++ в клетках блокируется выход цитохрома С из митохондрий, что в свою очередь предотвращает активацию каспаз и, соответственно, апоптоз холангиоцитов.
Фосфатидилхолин как составляющая часть эссенциальных фосфолипидов (ЭФЛ) также располагает антифибротическим действием, способствуя его регрессу путем подавления активности коллагеназы и трансформации звездчатых клеток в коллагенпродуцирующие, что дополняется противовоспалительным действием за счет уменьшения синтеза провоспалительных цитокинов (TNF-α, Il–1b).
Глицирризиновая кислота (ГК) как препарат, действующий на конкретные механизмы фиброгенеза, изучалась еще в начале XX в. японскими учеными в качестве потенциального антифибротического препарата. Гистологические и биохимические исследования показали, что введение ГК восстанавливает функциональную активность клеток печени (K. Fakahashi, 1982), нормализует ферментный спектр крови у больных острыми и хроническими гепатитами. Глицирризиновая кислота дополняет гепатопротекторное действие фосфолипидов, обладая высокой биологической и детергентной активностью (Y. Kageuama et al., 1994). Кроме того, ГК является синергистом кортикостероидов, а также обладает антиаллергическим действием (О.Ю. Абакумова и соавт., 1996) (ГК – антагонист ацетилхолина, гистамина и других медиаторов воспаления).
Основные эффекты ГК, опосредованно связанные с противофибротическим действием, включали противовоспалительные, когда она ингибировала гистаминовую, серотониновую, брадикининовую, формалиновую и другие воспалительные реакции, при этом уменьшая проницаемость сосудов.
Дополнительно к противовоспалительному действию ГК обладает антиоксидантной активностью, которую связывают с усилением перекисного окисления липидов через фосфорилирование 5-липоксигеназы. Действие ГК тормозит этот процесс. Кроме того, ГК способна связываться с прооксидантом – простагландином Е2.
Прямые антифибротические механизмы ГК были доказаны на экспериментальной модели ФП крыс, вызванного подкожными инъекциями ССl4. С помощью RT-PCR-анализа (reverse transcription – polymerase chain reaction или РТ-ПЦР-анализ) было показано увеличение экспрессии генов (smurf2, PTAFR, CYP2D6, FGG), связанных с воспалением. На основании полученных данных было доказано антифиброзное действие ГК на животных моделях, которое реализовывалось восстановлением активности тканевых металлопротеиназ и снижением их ингибиторов. Эта гипотеза была подтверждена в последующих экспериментальных и клинических исследованиях. Введение глицирризина и глицирризиновой кислоты подавляет активацию промотора гена коллагена COL1A2 и прогрессирование ФП, вызванного повторным введением тетрахлористого углерода. Глицирризиновая кислота подавляет синтез коллагена 1-го типа на уровне транскрипции гена, а также подавляет активацию ЗКП, регулирующих баланс между процессами синтеза и деградации ЭКМ.
В ходе рандомизированных исследований было показано, что по сравнению с плацебо прием глицирризина приводит к значительному снижению уровня трансфераз печени и улучшению гистологической картины. Эти сведения о краткосрочной эффективности данных препаратов были подтверждены в ходе ретроспективного исследования, которое показало, что длительный прием глицирризина препятствует развитию ЦП и гепатоклеточной карциномы на фоне хронического гепатита С.
При исследовании влияния ГК на синтез и пролиферацию ДНК в первичной культуре гепатоцитов взрослых крыс было продемонстрировано, что глицирризин стимулирует фосфорилирование рецепторов эпидермального фактора роста и p42 MAP-киназы, активирует синтез ДНК гепатоцитов. Кроме этого ГК ингибировали рост опухолей у мышей за счет опосредованного противоопухолевого эффекта. Так, было показано защитное действие ГК в отношении индуцированного канцерогенами повреждения ДНК, а также возможность понижающей регуляции рецептора эпидермального фактора роста. Входящие в состав солодки полифенолы (ГК) индуцируют апоптоз раковых клеток.
Отечественный препарат, представляющий комбинацию высокобиодоступных ЭФЛ и ГК, – Фосфоглив, на сегодняшний день является одним из стандартных средств для лечения ФП любой этиологии.
В качестве перспективных направлений антифибротической терапии в эксперименте была доказана клиническая значимость назначения факторов роста (IGF, фактор роста гепатоцитов, кардиотропин) и факторов, стимулирующих гены, ответственные за их продукцию.
Блокаторы эндотелеина-1 рецепторов типа А и назначение вазодилататоров (таких как простагландин Е2 и донорский нитрит азота) продемонстрировали хорошую антифибротическую активность у грызунов, однако у людей их эффекты не оценивались.
Альтернативный подход к лечению ФП заключается в применении ингибиторов коллагена и промоутеров их деградации. Так, ингибиторы пролил-4-гидроксилазы и галофуджинона предупреждают развитие экспериментального ЦП ингибированием синтеза коллагена. Такой фактор, как ММР-8, активаторы плазминогена и урокиназы стимулируют деградацию коллагена in vivo.
В эксперименте с инфузией мезенхимальных стволовых клеток было получено уменьшение индуцированного фиброза, что потенциально может быть использовано в будущем в лечении хронических заболеваний печени [28].
В целом разработка путей воздействия на активированные ЗКП может способствовать разрешению проблем, связанных с формированием и прогрессированием фиброза. Так, обещающие предварительные результаты были получены путем использования различных носителей (циклические пептиды в совокупности с альбумин- распознающими коллагеновые рецепторы типа 4 и/или PDGFR). Для подтверждения этих данных необходимы масштабные клинические испытания.
В настоящее время проведено достаточное количество научных исследований, в которых подтверждена важность ингибирования РААС как фактора, влияющего на ПГ и уменьшающего темпы прогрессирования ФП, что может стать многообещающей стратегией в лечении этого состояния. Этот факт подтверждается тем, что данная группа препаратов в качестве антифибротических агентов вошла в стандарты лечения и широко используется пациентами с хроническими заболеваниями сердца и почек.
По отчетам отделений трансплантологии, пациенты после проведения трансплантации печени, принимающие ингибиторы РААС и антигипертензивные препараты, имеют менее выраженное прогрессирование фиброза, чем пациенты, получающие другие виды лечения. Однако многоцентровые клинические исследования в настоящее время еще не окончены и результаты не обработаны.
Пентоксифиллин (ингибитор фосфодиэстеразы), амилорид (ингибитор натрий-водородной помпы), S-фарниезилтиосалициловая кислота (антагонист Ras) как субстанции, ингибирующие ключевые сигнальные пути фиброгенеза печени, также имеют потенциальное значение в комплексной терапии данного состояния. Для конкретных форм поражения печени, в частности при неалкогольном стеатогепатите, воздействие на специфические лиганды, например на cнижение экспрессии гена SREPB-1c и увеличение активности PPRAα, оказывает положительный эффект на регресс ФП преимущественно у пациентов с нарушениями углеводного обмена (S16).
Лечение ПГ у больных ФП следует начинать на самом раннем этапе, когда появляются первые расстройства воротного кровоснабжения. На стадии начальной ПГ гемодинамические расстройства происходят преимущественно на функциональном уровне с развитием нарушений парасимпатической регуляции сосудистого тонуса и преобладанием симпатикотонии, появлением расстройств микроциркуляции и реологических свойств крови [29]. Для коррекции начальной ПГ рекомендуется применение β-блокаторов, антагонистов альдостерона и рецепторов ангиотензина, пентоксифиллина, антиоксидантов.
По существу, реальной и универсальной схемой антифибротической терапии, в особенности пациентов с продвинутым фиброзом и ПГ, на сегодняшний день являются:
- комбинация пероральной и парентеральной форм (5,0 внутривенно, 3–5 раз в неделю) Фосфоглива;
- УДХК (Урдокса) в дозе 15–20 мг/кг/сут;
- пропранолол 40–80 мг/сут. Показателем эффективности и достаточности дозы препарата является снижение ЧСС на 25 % по сравнению с исходной. Длительность курсов приема определяется индивидуально от 1 до 6 месяцев с повторным курсом через 1–6 месяцев;
- верошпирон в дозе нейрогормонального модулятора 12,5–25,0 мг/сут продолжительностью, аналогичной анаприлину;
- токоферол (100–150 мг/сут) курсом до 4–8 недель;
- трентал (2 % – 5 мл в/в капельно) и реополиглюкин (400 мл). Лечение следует проводить курсами до 5–10 процедур.
Таким образом, комплексная терапия фиброза и снижение темпов его прогрессирования при хронических заболеваниях печени остаются сложной, филигранной, но жизненно необходимой задачей с целью предотвращения фатальных полиорганных нарушений.



