Диабетическая невропатия (ДП) – осложнение сахарного диабета, существенно снижающее качество жизни и сокращающее ее продолжительность. Распрост-раненность ДП составляет 10 % в дебюте заболевания и достигает 50 % через 25 лет. Чувствительные нарушения, такие как боли, парестезии, потеря чувствительности, отмечаются у 50 % пациентов, страдающих сахарным диабетом [8].
Полиневропатия остается самой частой формой невропатии при сахарном диабете. Эта форма представляет собой симметричную дистальную сенсомоторную полиневропатию, связанную с метаболическими и микроциркуляторными нарушениями, возникающими в результате хронической гипергликемии. К более редким формам ДП относятся краниальные мононевропатии и фокальные невропатии, такие как проксимальная моторная. Диабетическая полиневропатия начинается с пальцев стоп и неуклонно распространяется в проксимальном направлении. Захватив стопы и голени, чувствительные нарушения развиваются в кистях. Двигательные нарушения развиваются, как правило, на поздних стадиях заболевания.
Чувствительные нарушения при ДП складываются из «позитивных» симптомов различной модальности (персистирующая жгучая или тупая боль, пароксизмальная колющая, стреляющая боль, дизестезии [парестезии, вызывающие неприятное ощущение], вызванная боль [гипералгезия, аллодиния]) и «негативных» симптомов (гипоалгезия, аналгезия, снижение температурной, вибрационной чувствительности, ощущение давления).
Болевыми симптомами, такими как жжение, ощущение покалывания, парестезии, прострелы или пронизывающая боль, страдает треть пациентов с ДП. Как правило, эти симптомы усиливаются в ночное время, будят пациента. Болевая ДП сопряжена с выраженным дистрессом, часто сопровождается развитием тревожно-депрессивных нарушений.
Важно отметить, что выраженность болевого синдрома не служит маркером тяжести повреждения периферических нервов. Более того, симптомы ДП могут флюктуировать, тогда как повреждение нервов неуклонно нарастает. Болевые нарушения часто сочетаются с выпадением чувствительности, которая приводит к травматизации стоп и является фактором риска ампутации стопы.
Диагностика ДП должна включать детальное исследование сенсорной системы при помощи микрофиламента, проверку вибрационной и температурной чувствительности. Наибольшую диагностическую значимость имеет электронейромиография, позволяющая выявлять невропатию на ранних стадиях.
Факторы риска ДП активно обсуждаются. В исследовании EURODIAB IDDM Complications Study, проведенном в 16 странах и включившем более 3000 пациентов с сахарным диабетом 1 типа, было показано, что риск ДП связан как с гликемическим контролем, так и с длительностью заболевания. Семилетнее наблюдение за когортой пациентов, включенных в EURODIAB, показало, что у четверти развивается ДП, а основными факторами риска были возраст пациента, длительность заболевания и плохой контроль уровня глюкозы. В других исследованиях среди факторов риска были отмечены кардиоваскулярная патология, лишний вес, артериальная гипертензия, гипергликемия, курение [8].
До недавнего времени причина ДП – метаболические нарушения или микроангиопатия, оставалась дискутабельной. В настоящее время доказано: играют роль оба патологических процесса. Биопсия большеберцового нерва показала, что для ДП характерна гибель нервных волокон. В оставшихся волокнах отмечаются микроваскулярные дефекты эндоневральных нервов, истончение базальной мембраны, пролиферация и гипертрофия эндотелиальных клеток, снижение уровня кислорода. Микроваскулярные нарушения отмечаются также в эпиневральных артериях и венах. При помощи флуоресцентной ангиографии выявляется артериолосклероз на поверхности нерва и нарушение кровотока. Активно обсуждается роль иммунных механизмов в развитии ДП. Развитие болевого синдрома при ДП связано с повреждением кальциевых и натриевых каналов, нарушением выделения нейропептидов, что приводит к периферической, а затем и к центральной сенситизации [7].
В настоящее время для лечения диабетической невропатии обсуждается эффективность нескольких десятков препаратов и методов. Однако доказаны действием лишь некоторые. Несомненно, для лечения и профилактики диабетической невропатии необходима коррекция уровня глюкозы. Дискутабельным остается вопрос: необходимо ли «агрессивно» снижать уровень глюкозы (целевой уровень гликированного гемоглобина < 6 %) или достаточно умеренного снижения (уровень гликированного гемоглобина 7,0–7,9 %)? В исследованиях DCCT/EDIC показано, что интенсивный контроль глюкозы в дебюте заболевания снижает риск развития ДП через механизм метаболической памяти [10].
В то же время у пациентов с сахарным диабетом 2 типа проведение интенсивной терапии диабета не влияет на риск развития ДП, однако обусловливает тенденцию к более высокому риску вегетативной невропатии в течение 5,6 года [6]. Более того, интенсивная терапия сахарного диабета 2 типа при наличии ДП увеличивает риск смертности [5]. Таким образом, при сахарном диабете 1 типа рекомендовано интенсивное снижение уровня глюкозы, тогда как при сахарном диабете 2 типа – стандартная терапия.
Для профилактики ДП не менее важна коррекция других метаболических нарушений – уровня холестерина, триглицеридов. В исследовании F. Arrieta наряду с контролем уровня глюкозы контроль холестерина и триглицеридов приводил к уменьшению риска развития невропатии [3].
Одной из ключевых задач в ведении пациентов с диабетической невропатией является и коррекция сопутствующих нарушений. Активный образ жизни, ограничение приема алкогольных напитков, отказ от курения, диета, контроль артериального давления – стандартные рекомендации при сахарном диабете. Если пациент с ДП занимается спортом, например бегом или ходьбой, следует особое внимание уделять гигиене стоп, подбирать удобную обувь с целью профилактики травматизации и образования мозолей.
Для патогенетической терапии диабетической невропатии используются препараты α-липоевой кислоты – природного антиоксиданта и ко-антиоксиданта. Этот препарат нейтрализует действие свободных радикалов как на мембране клеток, так и в клеточной цитоплазме, участвует в восстановлении других антиоксидантов через тканевой глутатион и убихинон, уменьшает дефицит энергии в тканях, предотвращает образование конечных продуктов гликирования, тем самым снижая выраженность окислительного стресса. Нейропротективный эффект препарата обусловлен не только его антиоксидантными свойствами, но и способностью повышать уровень миоинозитола и креатинфосфата в ткани нерва.
В клетках эндотелия α-липоевая кислота блокирует активацию, поступление в ядро NF-κB и экспрессию генов, находящихся под его контролем, за счет чего происходят регресс эндотелиальной дисфункции и нарушения микроциркуляции. Препарат обладает и противовоспалительным действием, снижает уровень интерлейкинов-6 и -17, пролиферацию Т-клеток [1].
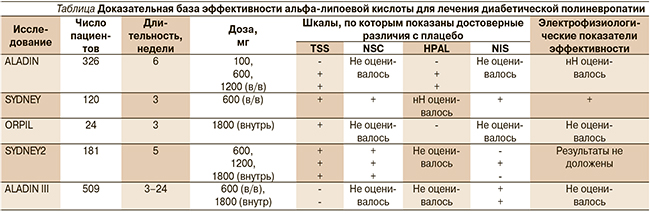
На сегодняшний день α-липоевая кислота – единственное средство патогенетической терапии ДП, эффективность которого доказана несколькими крупными контролируемыми исследованиями и мета-анализами ALADIN-I, -II, -III (Alpha-Lipoic Acid in Diabetic Neuropathy – α-липоевая кислота при диабетической невропатии), DECAN (германское исследование кардиальной вегетативной невропатии), NATAN (неврологическая оценка тиоктовой кислоты при диабетической невропатии), ORPRIL и SYDNEY2 [11–13]. Результаты основных исследований показаны в таблице.
Таким образом, было показано, что α-липоевая кислота уменьшает выраженность невропатических симптомов, уменьшает невропатический дефицит, улучшает течение кардиоваскулярной вегетативной невропатии, улучшает электрофизиологические показатели. Патогенетическая терапия направлена на замедление прогрессирования ДП, следовательно, должна быть длительной (4–5 лет), что было доказано в исследовании NATAN-1.
В мета-анализе, включившем 15 контролируемых исследований, показано, что α-липоевая кислота улучшает электрофизиологические характеристики – скорость проведения по чувствительным и двигательным волокнам, что является наиболее значимым маркером эффективности препарата [7].
Препарат характеризуется высоким уровнем безопасности. Частота развития побочных эффектов в различных исследованиях составила 0,83–37,9 % для дозы 600 мг/сут внутривенно, 0–46,1 % для дозы 1800 мг внутрь. Важно отметить, что частота побочных эффектов на фоне лечения α-липоевой кислотой была сопоставимой с таковой при приеме плацебо. Наиболее частые побочные эффекты: тошнота, рвота, головокружение. Лекарственных взаимодействий выявлено не было, поэтому α-липоевая кислота может быть рекомендована пожилым пациентам с сопутствующими заболеваниями [8].
Для пациентов с диабетической невропатией доступны различные препараты α-липоевой кислоты, в т.ч. Эспа-липон. Эспа-липон выпускается в виде раствора для инъекций (150, 300 или 600 мг) и таблеток (200 или 600 мг).
Данные, полученные в исследованиях с α-липоевой кислотой, воспроизводятся и с Эспа-липоном. Так, 20 пациентам с ДП вводился Эспа-липон первые 3 недели внутривенно в дозе 600 мг/сут, затем внутрь (600 мг/сут) 3–6 месяцев. В результате лечения Эспа-липоном уже через неделю отмечено статистически достоверное (р < 0,0001) увеличение вибрационной чувствительности и уменьшение интенсивности болей [2]. Боли в нижних конечностях полностью исчезли через 4–5 месяцев лечения у 25 % пациентов и значительно уменьшились у остальных. Улучшение показателей вибрационной чувствительности, достигшее максимума через 3 месяца, выявлено у всех больных.
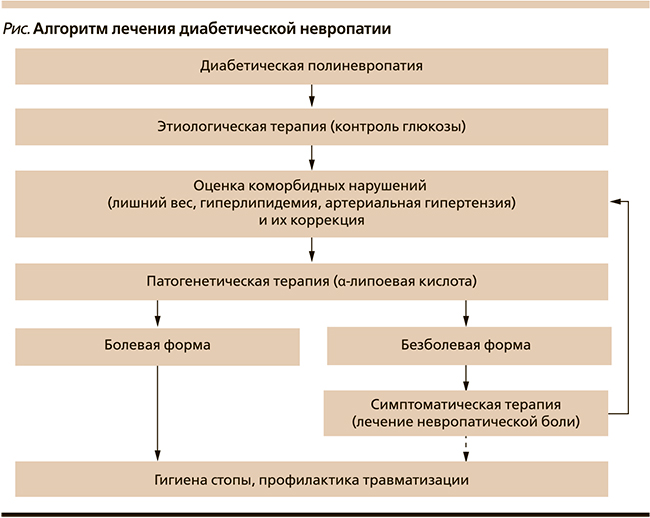
Симптоматическое лечение ДП включает терапию невропатической боли. Доказанным эффектом обладает несколько препаратов: трициклические антидепрессанты (амитриптилин), антиконвульсанты с противоболевым действием (прегабалин, габапентин), селективные ингибиторы обратного захвата серотонина и норадреналина (дулоксетин). Выбор средства вновь заставляет обратить внимания на сопутствующие расстройства (см. рисунок). Так, прием амитриптилина ограничен при глаукоме, ортостатической гипотензии, ишемической болезни сердца и нарушении сердечной проводимости, неустойчивости и падениях. Дулоксетин противопоказан при нарушении функции печени. Прегабалин с осторожностью используют при отеках. Амитриптилин и габапентин могут вызывать увеличение массы тела [14].
Важно отметить, что α-липоевая кислота воздействует и на болевой синдром. Введение 600 мг α-липоевой кислоты внутривенно в течение 3 недель приводит к достоверному регрессу невропатической боли (категория доказательности А) [9].
Гигиена стопы остается важным аспектом ведения пациентов с ДП. Нарушения чувствительности при безболевой форме приводят к тому, что микротравмы стопы остаются незамеченными, а трофические нарушения замедляют заживление. Это приводит к образованию язв и в конце концов – к ампутации стопы. Для профилактики ампутации стопы необходим комплексный подход – как уменьшение выраженности симптомов, в первую очередь безболевых, так и замедление прогрессирования заболевания, что возможно лишь при использовании патогенетического подхода.
Оптимальным способом ведения пациентов с диабетической стопой является наблюдение мультидисциплинарной командой специалистов, включающей эндокринолога, невролога, хирурга, ортопеда, подолога. Такой способ ведения позволяет снижать риск ампутации стопы и значимо повышать качество жизни пациентов с ДП [4].



