Патогенез синдрома раздраженного кишечника (СРК) остается предметом дискуссий, поскольку в его формировании принимают участие разные механизмы. В 1973 г. Ritcher первым описал висцеральную гиперчувствительность пациентов с СРК, которая является ведущим звеном в патогенезе клинических проявлений заболевания [1]. Последующие исследования показали, что при СРК порог болевой чувствительности снижен на 50–70 % по сравнению с нормой. В соответствии с концепцией гиперчувствительности пациенты с СРК сильнее, чем группа контроля, реагируют на сократительную активность кишки [2]. В исследованиях W.E. Whitehead с помощью баллонного теста был подтвержден феномен висцеральной гиперчувствительности, которая не распространяется на восприятие соматической боли [3]. В интересном эксперименте с погружением кисти руки в холодную воду t = 4 ºС было показано, что и общая чувствительность при функциональных расстройствах кишечника повышена у пациентов с СРК: они быстрее, чем контрольная группа, испытывали неприятные ощущения и раньше заканчивали эксперимент. Однако нарушение толерантности, продемонстрированное в тесте с холодной водой, не имело связи с возрастом, типом функциональных расстройств и тяжестью гастроинтестинальных симптомов [4]. Тем не менее большинство авторов расценивают висцеральную гиперчувствительность как биологический маркер СРК, а баллонный тест – как специфичный (95 %) и чувствительный (70 %) метод диагностики СРК, а также оценки эффективности лекарственных препаратов при их клинических испытаниях [5].
С помощью позитронной эмиссионной томографии было показано, что в ответ на проведение баллонного теста у здоровых лиц отмечается активация передней части ободка перешейка коры. Эта зона лимбической системы связана с активными опиатными соединениями, что, возможно, в норме обеспечивает снижение восприятия входящих болевых стимулов. У больных СРК активируются другие отделы коры головного мозга, особенно префронтальная зона, которая не связана с опиатами. Предполагается, что при СРК нарушен процесс нисходящего подавления восприятия боли, т.е. имеется центральная антиноцицептивная дисфункция [6]. Возникла гипотеза, объясняющая возникновение абдоминальной боли при СРК нарушением контроля ЦНС над восходящими болевыми импульсами [7].
Полагают, что в генезе висцеральной гиперчувствительности и нарушенной моторики при СРК ведущую роль может играть вовлечение в этот процесс серотонинергических механизмов [8]. Серотонинергическая система мозга участвует в регуляции общего уровня активности ЦНС, двигательной активности, сна и памяти, в существенной степени определяет эмоциональное поведение человека [9]. Несмотря на значительное разнообразие серотониновых рецепторов, в серотонинергической системе головного мозга и желудочно-кишечном тракте определяются сходные рецепторные типы. В кишечнике образуется 80 % серотонина организма, и источником его в значительной мере является кишечная микробиота.
 Исследования последних лет характеризуют СРК как заболевание, сопровождаемое изменениями микроэкологического статуса толстой кишки. Способность индигенной кишечной микрофлоры вырабатывать нейротрансмиттеры, влияющие на ЦНС и тем самым изменяющие секрецию, моторику кишечника и порог висцеральной чувствительности, свидетельствует о важности дисбиотических изменений при СРК [10]. К настоящему времени получены убедительные доказательства того, что микрофлора кишечника больных СРК существенно отличается от таковой здоровых лиц [11]. A. Kassinen и соавт. [12] обнаружили существенные различия в содержании некоторых родов бактерий в разных библиотеках клонов, что подтверждено методом количественной полимеразной цепной реакции филотипов родов Coprococcus, Collinsella и Coprobacillus. По данным отечественных авторов, результаты микробиологического анализа микрофлоры толстой кишки при СРК свидетельствуют о существенном снижении бифидо-, лактобактерий, энтерококков. У 30–85 % больных СРК, согласно разным источникам, был обнаружен синдром избыточного бактериального роста (СИБР) [13]. Развившийся по той или иной причине СИБР инициирует воспалительный ответ, который в свою очередь усиливает клинические проявления кишечных дисфункций. Синдром избыточного бактериального роста может быть одной из причин развития микроскопического воспаления слизистой оболочки кишечника [14].
Исследования последних лет характеризуют СРК как заболевание, сопровождаемое изменениями микроэкологического статуса толстой кишки. Способность индигенной кишечной микрофлоры вырабатывать нейротрансмиттеры, влияющие на ЦНС и тем самым изменяющие секрецию, моторику кишечника и порог висцеральной чувствительности, свидетельствует о важности дисбиотических изменений при СРК [10]. К настоящему времени получены убедительные доказательства того, что микрофлора кишечника больных СРК существенно отличается от таковой здоровых лиц [11]. A. Kassinen и соавт. [12] обнаружили существенные различия в содержании некоторых родов бактерий в разных библиотеках клонов, что подтверждено методом количественной полимеразной цепной реакции филотипов родов Coprococcus, Collinsella и Coprobacillus. По данным отечественных авторов, результаты микробиологического анализа микрофлоры толстой кишки при СРК свидетельствуют о существенном снижении бифидо-, лактобактерий, энтерококков. У 30–85 % больных СРК, согласно разным источникам, был обнаружен синдром избыточного бактериального роста (СИБР) [13]. Развившийся по той или иной причине СИБР инициирует воспалительный ответ, который в свою очередь усиливает клинические проявления кишечных дисфункций. Синдром избыточного бактериального роста может быть одной из причин развития микроскопического воспаления слизистой оболочки кишечника [14].
Кишечная микрофлора в результате жизнедеятельности может образовывать свободные (деконъюгированные) желчные кислоты, гидроксиды жирных кислот, бактериальные токсины, протеазы и различные метаболиты (фенолы, биогенные амины и др.), влияющие на моторику кишечника и состояние его рецепторного аппарата [15]. У пациентов с СРК снижена концентрация как отдельных, так и суммарных короткоцепочечных жирных кислот. Кроме того, изменяется бактериальный протеолиз, что влияет на слизеобразование. При СРК с запором увеличивается протеолиз, что приводит к ухудшению вязкости слизи и увеличению ее количества. При СРК с диареей протеолиз снижается, что лишает микрофлору кишечника пептидов. Вследствие нарушения энергообеспечения слизистой оболочки кишечника развивается гипоксия, нарушается трофика, усугубляется дисбактериоз, отмечается изменение функции бокаловидных клеток и состава гликопротеинов, которые предохраняют слизистую оболочку от потенциально вредных факторов и влияют на порог чувствительности рецепторов.
В результате создается порочный замкнутый круг, способствующий поддержанию возникших изменений моторики и чувствительности рецепторного аппарата кишечника.
Таким образом, развитие СРК связано с несколькими возможными механизмами: висцеральной гиперчувствительностью, нарушением моторики, кишечным дисбиозом, центральной дисрегуляцией. Каков вклад каждого из них, остается не ясно, поэтому не ясно, какая терапия может считаться оптимальной.
Целью настоящего исследования стало проведение сравнительной оценки эффективности терапии пробиотиками или препаратами, координирующими моторику кишечника (тримебутином), с учетом показателей висцеральной гиперчувствительности, микробных нарушений и признаков хронического воспаления в толстой кишке.
Материал и методы
Под нашим наблюдением находился 121 пациент (61 мальчик и 60 девочек) в возрасте от 5 до 17 лет с нарушениями, соответствующими клиническим критериям СРК. Согласно Римским критериям III, клиническая симптоматика соответствовала следующим типам СРК: СРК с запорами – у 36 (29,8 %) человек, СРК с диареей – у 48 (39,7 %), смешанный тип СРК – у 6 (4,9 %), недифференцированный тип СРК – у 31 (25,6 %) человека.
СРК развился у 28 детей после перенесенной инфекции – постинфекционный СРК (23,1 %). Этиология предшествующего острого гастроэнтерита, после которого развился постинфекционный СРК, установлена у 17 (63 %)пациентов, по данным иммунологического обследования и посева кала. Доминировал ротавирусный гастроэнтерит у 11 детей, сальмонеллез был диагностирован у 1 ребенка, кишечный йерсиниоз – у 1, псевдотуберкулез – у 1, эшерихиоз – у 2, кампилобактериоз – у 1. В исследование были включены дети, не получавшие антибактериальной терапии по поводу других заболеваний, а также про- и пребиотичекой терапии в течение трех месяцев, предшествовавших госпитализации.
Всем пациентам проведены следующие исследования: фибросигмоскопия с биопсией слизистой оболочки толстой кишки (СОТК) (2 биоптата); морфологическое исследование биоптатов СОТК (окраска гематоксилин-эозином); определение уровня провоспалительных цитокинов интерлейкина-8 (IL-8), интерферона-γ (IFN-γ) в СОТК; определение объемно-пороговой чувствительности (ОПЧ) прямой кишки баллонным методом; исследование уровня кальпротектина в кале (ELISA); водородный дыхательный тест с помощью прибора «Лактофан-2» (АМА, Санкт-Петербург) с нагрузкой лактулозой для диагностики СИБР в тонкой кишке; микробиологическое исследование кала. После окончания курса терапии проведена повторная оценка ОПЧ прямой кишки, исследование кишечного микробиоценоза методом посева кала на дисбактериоз и водородного дыхательного теста, определен уровень кальпротектина. Статистическая обработка результатов осуществлена с использованием компьютерной программы Statistica 6.0 для Windows.
В зависимости от проводимой терапии больные были разделены на семь групп:
- 1-я группа (20 человек) получала пробиотик Рела Лайф в возрастной дозировке курсом 1 месяц;
- 2-я группа (15 человек) получала Линекс в возрастной дозировке курсом 1 месяц;
- 3-я группа (15 человек) получала тримебутин в возрастной дозировке курсом 1 месяц;
- 4-я группа (16 человек) получала Энтерол в возрастной дозировке курсом 1 месяц;
- 5-я группа (20 человек) получала комбинированную терапию Закофальком в сочетании с пробиотиком в возрастной дозировке курсом 1 месяц;
- 6-я группа (15 человек) получала комбинированную терапию тримебутином в сочетании с пробиотиком в возрастной дозировке курсом 1 месяц;
- 7-я группа (20 человек) получала плацебо курсом 1 месяц.
Результаты и их обсуждение
 У всех обследованных нами детей была повышена ОПЧ прямой кишки, которая в среднем составила 102,00 ± 4,11 (медиана – 100) мл. Максимальная гиперчувствительность наблюдалась при СРК с диареей и СРК с запором (102,44 ± 11,06 и 102,31 ± 12,48 мл соответственно); несколько ниже – при недифференцированном типе (108,5 ± 9,19 мл); минимальная – при смешанном типе СРК (113,33 ± 120,0 мл).
У всех обследованных нами детей была повышена ОПЧ прямой кишки, которая в среднем составила 102,00 ± 4,11 (медиана – 100) мл. Максимальная гиперчувствительность наблюдалась при СРК с диареей и СРК с запором (102,44 ± 11,06 и 102,31 ± 12,48 мл соответственно); несколько ниже – при недифференцированном типе (108,5 ± 9,19 мл); минимальная – при смешанном типе СРК (113,33 ± 120,0 мл).
Наибольшее повышение ОПЧ отмечено при СРК, не связанном с перенесенной инфекцией, чем при СРК после перенесенной инфекции (101,05±35,87 и 111,88±13,98 мл соответственно). Таким образом, полученные нами данные подтверждают мнение других авторов, будто висцеральная гиперчувствительность может рассматриваться в качестве обязательного признака СРК у детей.
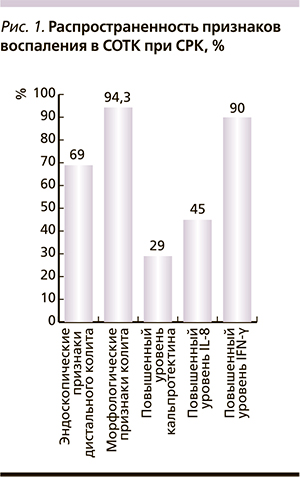
Эндоскопически у большинства детей с СРК (66,9 %) были выявлены минимальные признаки дистального колита: незначительная гиперемия, сгущение сосудистого рисунка, гиперплазия лимфоидных фолликулов. Во всех случаях изменения локализовались только в дистальных отделах кишечника – прямой и сигмовидной кишке. Несмотря на нормальную или минимально измененную эндоскопическую картину, гистологические признаки хронического воспаления в биоптатах СОТК были обнаружены почти у всех детей (97,5 %) (рис. 1). Это отек стромы, инфильтрация плазматическими клетками, лимфоцитами, эозинофилами, нейтрофилами; повышенное количество межэпителиальных лейкоцитов с преобладанием лимфоцитов; диффузный фиброз стромы.
У большинства они были незначительны, реже – умеренно выражены. То есть у большинства детей с СРК имеет место микроскопический хронический дистальный колит.
Косвенным подтверждением наличия слабых воспалительных изменений в кишечнике при СРК стали также полученные нами данные о повышении уровня фекального кальпротектина (рис. 1). Уровень кальпротектина у детей, больных СРК, в нашем исследовании был повышен в 27,3 % случаев (среди всех детей с СРК средний уровень кальпротектина составил 83,51 ± 18,22 [медиана – 33,0] мкг/г кала). Это многократно ниже, чем при воспалительных заболеваниях кишечника, но все же почти в 2 раза превышает верхнюю границу нормы, что свидетельствует о невысокой, но присутствующей активности хронического воспаления. Приблизительно у половины детей с СРК (45 %) был повышен уровень провоспалительного цитокина IL-8, он в среднем составил 214 ± 104,4 пг/мл (норма – менее 50 пг/мл), а уровень провоспалительного цитокина IFN-γ в СОТК был повышен у 90 % больных и составил в среднем 83,5 ± 26,7 пг/мл (норма – менее 50 пг/мл) (рис. 1). Уровень провоспалительных цитокинов коррелировал с выраженностью абдоминального синдрома и степенью отклонения висцеральной гиперчувствительности от возрастной нормы. Увеличение уровня провоспалительных цитокинов (IL-8, IFN-γ), обнаруженное в СОТК большинства обследованных пациентов, наряду с гистологическими данными и повышением уровнем фекального кальпротектина подтверждает наличие слабого воспаления в СОТК, не зависимое от типа и этиологии СРК. Однако отсутствие четкой корреляции активности воспаления по морфологическим данным и уровня провоспалительных цитокинов скорее указывает на некоторые особенности иммунологических механизмов, лежащих в основе хронического воспаления при СРК, и на участие других механизмов в формировании заболевания.
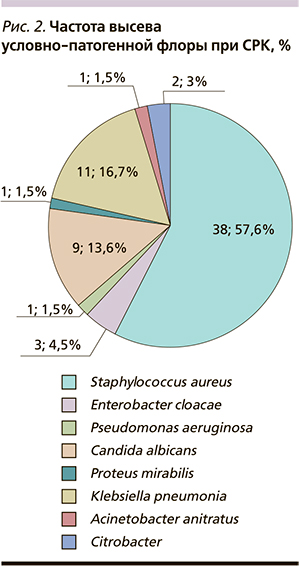
Признаки кишечного дисбактериоза, по данным посева кала, наблюдались у всех детей (100 %). Было выявлено снижение общего количества бифидобактерий в среднем на 2–3 порядка, лактобацилл – на 4–5, типичной кишечной палочки – на 1–2 порядка от возрастных норм; уровень энтерококков был на нижней границе нормы. Почти у всех детей с СРК (113 человек – 93,4 %) высеивались клостридии, у 36 человек (29,8 %) присутствовала лактозонегативная кишечная палочка. Условно-патогенная флора была обнаружена у 66 (54,5 %) детей: Staphylococcus aureus обнаружен у 38 (57,6 %) пациентов, Enterobacter cloacae – у 3 (4,5 %), Pseudomonas aeruginosa – у 1 (1,5 %), Candida albicans – у 9 (13,6 %), Proteus mirabilis – у 1 (1,5 %), Klebsiella pneumonia – у 11 (16,7 %), Acinetobacter anitratus – у 1 (1,5 %), Citrobacter – у 2 (3 %) пациентов (рис. 2).
На основании данных водородного дыхательного теста с лактулозой СИБР был диагностирован у 85,1 % детей с СРК. В среднем при всех типах СРК базальный уровень водорода в выдыхаемом воздухе составил 18 ± 3 ppm, через 30 минут – 33 ± 4 ppm, через 60 минут – 50 ± 6 ppm. Нами установлено, что наличие условно-патогенной флоры достоверно повышает уровень кальпротектина в кале, что косвенно подтверждает роль нарушений микробиоты кишечника в развитии хронического воспаления. У 93,4 % детей с СРК присутствовали клостридии, уровень которых коррелировал с уровнем провоспалительных цитокинов в СОТК, особенно с уровнем провоспалительного цитокина IL-8. Снижение лактобактерий существенно влияло на состояние СОТК (при их значительном снижении в кишке обнаруживались признаки катарального воспаления); между уровнями лактобактерий и IL-8 в СОТК существовала обратная зависимость. Таким образом, наши данные подтверждают следующий факт: кишечная микрофлора оказывает прямое воздействие на иммунную систему кишечника – облигатные микробы препятствуют, а условные патогены способствуют провоспалительному ответу, поддерживая хроническое воспаление.
Результаты открытого рандомизированного плацебо-контролируемого исследования эффективности различных схем терапии СРК у детей, проведенного нами, показали, что по сравнению с плацебо достоверное улучшение наблюдалось во всех группах лечения – при лечении как пробиотиками, так и координирующими моторику препаратами. Наибольший эффект по купированию симптомов СРК (абдоминальная боль, вздутие, нарушение стула) был достигнут в группе комбинированной терапии (тримебутин + пробиотик). Наилучшего результата в коррекции висцеральной гиперчувствительности прямой кишки удалось достичь также после курса комбинированной терапии (тримебутин + пробиотик) и монотерапии тримебутином (48,6 ± 2,8 и 36,7 ± 1,7 % соответственно). Среди пробиотиков при монотерапии разными препаратами наилучший результат получен после курса лечения Энтеролом (27,1 ± 2,5 %) по сравнению с курсом лечения Рела Лайфом и Линексом (11,2 ± 2,5 и 5,6 ± 1,4 % соответственно). После курса лечения пребиотиком Закофальком в сочетании с пробиотиком увеличение произошло на 20,9 ± 1,2 %, что выше, чем в группах с применением только пробиотика. В группе плацебо произошло ухудшение показателя ОПЧ (-3,2 ± -6,1 %), т.е. в данной группе после лечения висцеральная чувствительность еще более возросла (p < 0,05).
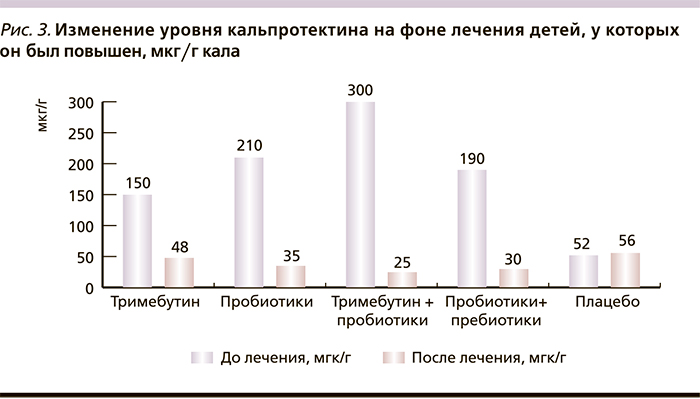
Уровень фекального кальпротектина после окончания лечения нормализовался у всех пациентов, кроме получавших плацебо (p < 0,05), и составил в среднем 36,0 ± 4,8 (медиана 29,0) мкг/г кала (рис. 3).
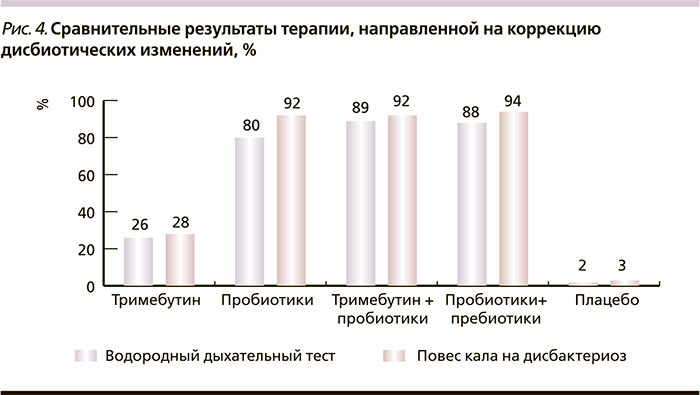
По данным водородного дыхательного теста, пробиотическая моно- и комбинированная терапия была достоверно эффективнее плацебо и спазмолитиков в устранении СИБР. На фоне комбинированной терапии пробиотиком и тримебутином улучшения удалось достичь 81,8 % пациентов, на фоне монотерапии пробиотиками – 76,9 %, при сочетании пробиотика с пребиотиком – 77,8 %. Коррекции дисбиотических нарушений в толстой кишке, по данным посева кала, удалось достичь в результате назначения пробиотиков как в виде монотерапии, так и в сочетании с тримебутином или пребиотиком (рис. 4).
В группе плацебо уровень кальпротектина остался на прежнем уровне, улучшения показателей ОПЧ и коррекции дисбиотических изменений не было достигнуто, а в ряде случаев отмечено ухудшение показателей.
Таким образом, проведенное нами исследование 121 ребенка с нарушениями, которые по клиническим данным соответствовали международным критериям СРК, показало, что у абсолютного большинства пациентов с СРК имеются признаки слабого хронического воспаления в кишечнике: по данным микроскопии, уровню кальпротектина в кале и провоспалительных цитокинов в СОТК. При этом все больные СРК страдают изменениями кишечного микробиоценоза, в 85 % – в сочетании с СИБР; у всех больных СРК имеет место висцеральная гиперчувствительность прямой кишки. То есть наше исследование подтвердило участие воспалительного компонента в формировании СРК. Вероятно, кишечный дисбиоз с увеличением условно-патогенных и снижением облигатных бактерий может поддерживать хроническое воспаление, одновременно усиливая чувствительность рецепторного аппарата кишки и формируя порочный круг СРК. Понимание этих механизмов, принимающих участие в формировании симптомокомплекса СРК, приводит к логичному выводу о возможном терапевтическом подходе с помощью традиционных препаратов, не только влияющих на моторику кишечника, но и корректирующих его микробиоту. Не случайно пробиотическая терапия оказалась эффективной не просто в коррекции дисбиоза и СИБР, но и в устранении признаков воспаления (кальпротектина, провоспалительных цитокинов) и нормализации ОПЧ.
Полученные нами результаты примерно равной эффективности тримебутина и пробиотиков с наилучшими показателями применения комбинированной терапии в отношении как снижения висцеральной гиперчувствительности, так и купирования воспалительных и дисбиотических изменений подтверждают целесообразность воздействия на ключевые точки «порочного круга», свойственного СРК. Разрыв этого круга и улучшение симптоматики возможны через коррекцию как моторики, так и микробиоценоза и устранение СИБР, что и было нами продемонстрировано.
Оказавшееся наиболее эффективным комбинированное лечение тримебутином в сочетании с пробиотиком направлено на ключевые звенья патогенеза СРК: дисбиоз, воспаление, гипералгезию, аллодинию, нарушение моторики. Коррекция этих основных механизмов способна косвенно поправлять и другие важные составляющие синдрома СРК: повышенную проницаемость СОТК и снижение защитного кишечного барьера, а также нарушения пищеварения, продукцию нежелательных метаболитов и газов, тем самым купируя весь свойственный СРК симптомокомплекс.



