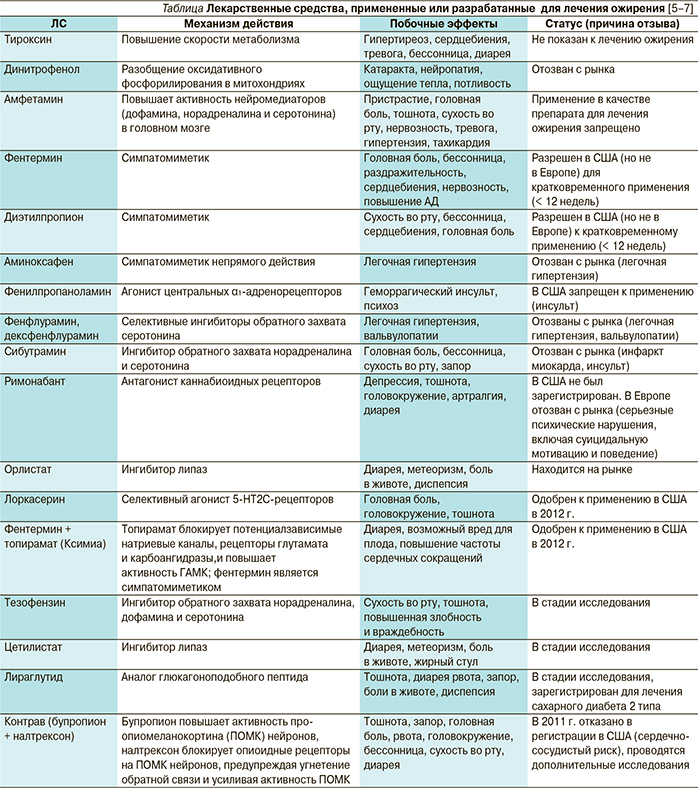
На фармацевтический рынок США поступило два новых препарата для лечения ожирения – Белвик (лоркасерин, Eisai/Arena Pharmaceuticals) и Ксимиа* (комбинация фентермина и топирамата с контролируемым высвобождением действующего вещества, Vivus). Оба препарата были одобрены к медицинскому применению год назад (в июне и июле 2012 г.) и стали первыми зарегистрированными в стране за последние 13 лет лекарственными средствами (ЛС) длительной терапии ожирения [1]. Регистрация лоркасерина и комбинации фентерамина с топираматом была отнесена журналом Nature к числу самых значимых достижений в области фармации в 2012 г. [2], что обусловлено широкой распространенностью ожирения, его клиническими, социальными и экономическими последствиями, а также недостатком препаратов с хорошим соотношением польза/риск для его лечения. Несмотря на многочисленные попытки разработать эффективные ЛС для лечения ожирения, большинство из них или не были одобрены к применению по данному показанию, или отозваны с рынка из-за серьезных нежелательных реакций (см. таблицу). После отзыва сибутрамина единственным ЛС, разрешенным к длительному применению больными ожирением, стал орлистат, тоже не лишенный серьезных недостатков (невысокая эффективность, желудочно-кишечные побочные эффекты, редкие случаи гепатотоксичности) [3, 4].
Лоркасерин и комбинация фентермин/топирамат не были одобрены FDA с первого раза. В 2010 г. FDA оценило соотношение польза/риск лоркасерина как неблагоприятное в связи с его недостаточной эффективностью в клинических исследованиях и повышенным риском развития некоторых опухолей (аденокарцином молочной железы у самок и астроцитом головного мозга у самцов), наблюдавшихся в экспериментах на крысах, а также риска развития вальвулопатий, психических, когнитивных и серотонинергических побочных эффектов [6].
Согласно стандартам FDA, препарат для лечения ожирения должен снижать массу тела в течение года не менее чем на 5 % по сравнению с плацебо, а число пациентов, у которых достигнуто 5-процентное снижение веса, должно не менее чем в 2 раза превышать таковое в группе плацебо [3]. Лоркасерин не отвечал первому критерию – среднее снижение веса при его применении составило 5,8 % по сравнению с 2,5 % в группе плацебо, т. е. разница между группами (3,3 %) не достигала необходимого уровня. Однако он удовлетворял другому критерию – число пациентов, у которых спустя 1 год лечения масса тела снизилась не менее чем на 5 %, составило в группе активного препарата 47 % по сравнению с 22 % в группе плацебо [8]. В письме производителю FDA определило клиническую эффективность препарата как «минимальную» [9]. Отказав в регистрации препарата в 2010 г., FDA рекомендовало производителю предоставить заключительный отчет исследования BLOOM-DM (Behavioral modification and Lorcaserin for Overweight and Obesity Management in Diabetes Mellitus) [10].
Результаты этого исследования, а также тщательный анализ других клинических и экспериментальных данных независимыми экспертами, показали, что применение лоркасерина позволяют достигать клинически значимого снижения массы тела, отвечающего требованиям регуляторных органов США, и ассоциировалось с рядом других благоприятных эффектов на кардиометаболические и антропометрические параметры, в т. ч. на артериальное давление, уровень холестерина ЛПНП, объем талии и гликированный гемоглобин у пациентов с сахарным диабетом [6, 8]. Также было показано, что опухоли молочной железы, выявленные у животных, значительно чаще носили доброкачественный характер, чем предполагали ранее [6]. Концентрации препарата в центральной нервной системе у людей были низкими [11], что позволило предположить низкую вероятность развития опухолей головного мозга у человека [5]. Результаты исследований in vitro указывали на то, что в рекомендуемых терапевтических дозах влияние лоркасерина на рецепторы 5-HT2B, стимуляция которых может приводить к развитию легочной гипертензии и вальвулопатиям, маловероятно [11]. В клинических испытаниях недостоверно повышенный риск вальвулопатий наблюдался лишь в одном из трех исследований III фазы (2,9 % в конце 52-й недели при применении в дозе 10 мг 2 р/сут против 0,5 % в группе плацебо, р = 0,122) [10]. По результатам анализа объединенных данных трех исследований (n = 5249), частота вальвулопатий достоверно не различалась в группах лоркасерина и плацебо [12]. Отношение рисков развития вальвулопатии при применении лоркасерина в разных дозах составляло от 1,03 до 1,16 и по крайней мере частично могло быть связано с более выраженным снижением массы тела в группе активного препарата.
На основании данных повторного анализа FDA пришло к заключению, что польза от применения лоркасерина превышает риски, и наряду с диетой и физической активностью рекомендовало его для длительного контроля веса взрослым лицам с индексом массы тела (ИМТ) 30 кг/м2 и более, а также лицам с ИМТ 27 кг/м2, имеющим по крайней мере одно из сопутствующих повышенному весу состояний, – сахарный диабет, артериальную гипертензию или дислипидемию. Следует отметить, что результаты голосования Консультативной комиссии FDA при повторном рассмотрении заявки на регистрацию лоркасерина не были единогласными (18 – «за», 4 – «против») – преимущественно из-за опасений по поводу сердечно-сосудистого риска.
Препарату присвоена категория IV в классификации контролируемых веществ Управления по борьбе с наркотиками (Drug Enforcement Agency) США (достаточно низкий потенциал развития зависимости). Это связано с тем, что стимуляция 5-HT2A-рецепторов может приводить к развитию галлюциногенных эффектов и эйфории, что наблюдалось в единичных случаях при применении лоркасерина [13]. В классификации безопасности применения во время беременности FDA он отнесен к категории X (выявлены нарушения развития плода или имеются доказательства риска отрицательного воздействия данного лекарства на плод человека, применение абсолютно противопоказано – не существует ситуаций, когда польза для матери превышала бы риск для плода) [14]. С целью повышения безопасности применения препарата в реальной медицинской практике FDA обязало производителя разработать стратегию REMS (Risk Evaluation and Mitigation Strategies), направленную на выявление рисков в пострегистрационном периоде, и внедрение адекватных мер по минимизации их последствий.
Примерно такой же путь к регистрации в США пришлось преодолеть комбинации фентермина и топирамата. При рассмотрении первой заявки FDA отказало в ее регистрации из-за соображений безопасности, несмотря на убедительные доказательства эффективности (средняя потеря веса в течение года – около 10 %) [15]. В частности, опасения членов Консультативной комиссии вызвали нежелательные явления со стороны сердечно-сосудистой системы, особенно повышение частоты сердечных сокращений в покое, а также психические расстройства, включая суицидальные мысли, когнитивные расстройства, в т. ч. нарушения памяти, врожденные аномалии и метаболический ацидоз [3]. FDA не потребовало от производителя проведения новых исследований, но запросило дополнительную информацию, позволяющую более точно оценить риски [16]. После повторного рассмотрения представленных материалов Консультативная комиссия подавляющим большинством голосов (20 против 2) рекомендовала одобрение применения комбинации фентермина и топирамата под новым торговым наименованием «Ксимиа» по тем же показаниям, что и лоркасерин, с рядом предостережений. В частности, в инструкции по медицинскому применению Ксимии подчеркивается, что ее влияние на сердечно-сосудистую заболеваемость и смертность не установлено. Фентермин/топирамат не рекомендован больным с нестабильной стенокардией и цереброваскулярной болезнью, при его применении необходимо мониторировать частоту сердечных сокращений [5].
Препарат отнесен к категории Х по классификации безопасности применения во время беременности. Это связано с повышенным риском тератогенности (преимущественно ротолицевые расщелины), выявленным при применении топирамата в виде монотерапии больных эпилепсией [17]. Ксимиа может также вызывать метаболический ацидоз, негативно влияющий на оксигенацию и развитие плода, и таким образом повышать риск других неблагоприятных исходов беременности, включая внутриутробную смерть. Кроме того, фентермин относится к контролируемым веществам: в классификации Управления по борьбе с наркотиками США он относится к категории III, т. е. риск развития зависимости при его применении оценивается выше, чем при применении лоркасерина. Для оценки и минимизации всех рисков, связанных с применением Ксимии, производителем разработана стратегия REMS.
В Европе, где требования регуляторных органов к регистрации препаратов для лечения ожирения отличаются большей строгостью, чем в США (10-процентное снижение массы тела от исходного уровня, которое должно поддерживаться на протяжении 1 года и на 5 % превышать уровень, достигнутый в группе плацебо) [15], обоим новым препаратам для лечения ожирения было отказано в регистрации. Производитель лоркасерина отозвал заявку на регистрацию препарата в Европе, указав в качестве причины невозможность решить с регуляторным агентством вопросы, касающиеся данных экспериментальных исследований, во временных рамках регистрационного процесса [18].
Однако возможно, что основной причиной отказа от регистрации в Евросоюзе является умеренная эффективность препарата, не удовлетворяющая критериям EMA. Что касается комбинации фентермина с топираматом, то EMA дважды отказывало в ее регистрации, потребовав от производителя провести дополнительные исследования по изучению его безопасности со стороны сердечно-сосудистой системы и ЦНС при долгосрочном применении [19].
Фармакологические свойства и результаты клинических исследований лоркасерина
Лоркасерин является мощным агонистом рецепторов 5-гидрокситриптамина (серотонина) с избирательным действием на 5-HT2C-рецепторы, расположенные преимущественно в центральной нервной системе, в т. ч. в гипоталамусе. Предполагают, что последние играют основную роль в серотонинэргическом контроле аппетита [20]. Стимуляция 5-HT2C-рецепторов в гипоталамусе приводит к устранению чувства голода и быстрому появлению ощущения насыщения даже после приема небольшого количества пищи. При этом сродство препарата к другим серотонинэргическим рецепторам 5-HT2A и 5-HT2B, соответственно, в 15 и 100 раз ниже, чем к 5-HT2C-рецепторам [11].
Эффективность и безопасность лоркасерина изучались в трех больших многоцентровых исследованиях III фазы клинических испытаний – BLOOM ((Behavioral Modification and Lorcaserin for Overweight and Obesity Management) (n = 3800) [21], BLOSSOM (Behavioral modification and Lorcaserin Second Study for Obesity Management) (n = 4008) [22] и BLOOM-DM (Behavioral Modification and Lorcaserin for Obesity and Overweight Management in Diabetes Mellitus) (n = 604) [10]. В первых двух препарат изучали на лицах с повышенной массой тела или ожирением без осложнений (т. н. здоровые), в третьем – у больных с повышенной массой тела/ожирением и сахарным диабетом. К концу 52-й недели применения лоркасерина снижение массы тела по отношению к плацебо составило у «здоровых» лиц в первом исследовании 3,6 кг (3,6 % массы тела) [21], во втором – 2,9 кг [22], у больных сахарным диабетом – 3,1 кг [10]. Пятипроцентное снижение массы тела было соответственно достигнуто у 27,2 %; 22,2 и 21,4 % участников, принимавших активный препарат. Согласно результатам мета-анализа рандомизированных контролируемых исследований препарата продолжительностью год, среднее снижение массы тела под его влиянием по отношению к плацебо составило 3,23 кг, снижение ИМТ – 1,16 кг/м² [23].
При применении лоркасерина в течение 8 и 12 недель соответствующие показатели снижения массы тела были равны 1,6 и 2,9 кг. Таким образом, полученные результаты существенно не отличались от результатов исследования неселективного агониста серотониновых рецепторов дексфенфлурамина [24], и предположение о том, что избирательное действие на 5-HT2C-рецепторы будет способствовать более выраженному влиянию на вес, не подтвердилось [15]. Лоркасерин в меньшей степени снижал массу тела, чем отозванные с рынка римонабант [25–27] или сибутрамин [28, 29].
В клинических исследованиях III фазы снижения массы тела не менее чем на 5 % удалось достичь лишь 45 % участников, получавших лоркасерин [30]. Однако его применение ассоциировалось с другими благоприятными эффектами – уменьшением объема талии, снижением АД, общего холестерина, холестерина ЛПНП, триглицеридов и гликированного гемоглобина у больных сахарным диабетом [10, 23].
Лоркасерин в целом хорошо переносился. Основной причиной выбывания из исследований (45–50 % пациентов) была недостаточная эффективность, а не проблемы с переносимостью [31]. В клинических исследованиях лоркасерин чаще по сравнению с плацебо вызывал головную боль, тошноту и головокружение, реже – диарею [23]. Применение лоркасерина ассоциировалось с повышенным риском острых нарушений зрения, легких депрессивных и когнитивных расстройств, включая нарушения памяти [21, 22]. При одновременном применении лоркасерина с другими серотонинэргическими или антидопаминергическими препаратами существует риск развития серотонинового синдрома [32]. Лоркасерин противопоказан беременным и женщинам, планирующим беременность, а также матерям, кормящим грудью.
Препарат рекомендуется отменять пациентам, которым в первые 12 недель лечения не удается достичь снижения массы тела на 5 %, т. к. клинические исследования показали, что в этом случае вероятность достижения эффекта при более длительной терапии крайне низка [31].
Фармакологические свойства и результаты клинических исследований комбинации фентермина с топираматом
Компоненты комбинации фентермин/топирамат давно используются в медицинской практике для снижения массы тела. Симпатомиметик фентермин официально разрешен в США только для кратковременного (до 12 недель) применения, т. к. его эффективность и безопасность при длительном использовании не изучались. Применение противоэпилептического препарата топирамата по данному показанию является off-label, хотя его способность снижать массу тела была показана в рандомизированных контролируемых исследованиях. Согласно результатам мета-анализа этих исследований, он достоверно снижает массу тела в среднем на 3,95 кг [33]. Точный механизм действия топирамата, приводящего к снижению массы тела, не известен. Предполагают, что он опосредован через блокаду потенциалзависимых натриевых каналов, рецепторов глутамата и митохондриальной карбоангидразы, повышение активности ГАМК [34]. Комбинация фентермина с топираматом вызывает подавление аппетита и усиливает ощущение насыщения [30]. Не исключено, что препарат также повышает затраты энергии, что было показано в экспериментах на животных [35].
Комбинация предназначена для однократного приема в сутки внутрь. В клинических исследованиях она изучалась в трех дозах – 3,75 мг фентермина/23 мг топирамата (низкая доза), 7,5/46 мг (средняя доза) и 15/92 мг (полная доза) соответственно.
В 6-месячном исследовании II фазы был продемонстрирован синергидный эффект компонентов комбинации, 42 % пациентов достигли снижения массы тела более чем на 10 % по сравнению с плацебо [23]. При сравнении с результатами клинических исследований других препаратов фентермин/топирамат по эффективности превосходил орлистат, сибутрамин и римонабант [25, 27, 36, 37], а также лоркасерин [38].
В трех больших клинических исследованиях III фазы с участием в общей сложности более 4500 взрослых лиц с ожирением, в т. ч. с сопутствующими заболеваниями (сахарный диабет 2 типа, гипертензия, дислипидемия), снижение массы тела не менее чем на 5 % по отношению к плацебо было достигнуто примерно 75 % участников, получавших фентермин/топирамат [30]. К концу 56-й недели лечения среднее снижение массы тела составляло 10,6 %, 8,4, и 5,1 % при применении доз 15/92 мг, 7,5/46 и 3,75/23 мг соответственно по сравнению с 2,5 % в группе плацебо (p < 0,0001) [38]. У участников, получавших активный препарат в средней и полной дозе, отмечено снижение по сравнению с группой плацебо систолического давления, уровня триглицеридов и инсулина натощак, повышение холестерина ЛПВП [3]. Снижение уровня общего холестерина и холестерина ЛПНП, а также диастолического давления наблюдалось только в подгруппе, получавшей фентермин/топирамат в дозе 15/92 мг. Благоприятное влияние препарата на массу тела сохранялось не менее двух лет [39].
Среди нежелательных явлений, зарегистрированных в клинических исследованиях, преобладали эффекты, характерные для компонентов комбинации, – сухость во рту, запор, бессонница, сердцебиения, головокружение, парестезии, нарушение внимания в сочетании с головной болью, нарушение вкусовых ощущений, алопеция и гипокалиемия. Из них с частотой более 5 % встречались парестезии, головокружение, нарушения вкуса, бессонница, запор и сухость во рту [38]. Препарат может провоцировать острые нарушения зрения и закрытоугольную глаукому. Возможно развитие симптомов депрессии, суицидальных мыслей и нарушение когнитивных функций, особенно в начале лечения. Так же как лоркасерин, фентермин/топирамат противопоказан беременным и кормящим грудью женщинам, а женщинам репродуктивного возраста в период лечения рекомендуется применение надежных средств контрацепции.
Таким образом, на рынке США появилось два новых препарата для лечения ожирения. Один из них, фентермин/топирамат, представляется более эффективным, чем все другие ЛС, применявшиеся для лечения ожирения, однако его эффективность, как и в целом эффективность фармакотерапии при данном состоянии, оценивается экспертами как умеренная [38]. Второй препарат – лоркасерин, по-видимому, по эффективности уступает фентермину/топирамату, но превосходит его по переносимости [40]. Поскольку непрямое сравнение результатов клинических исследований сложно и некорректно, это необходимо доказать в непосредственных сравнительных исследованиях. Кроме того, оба препарата вызывают опасения с точки зрения безопасности, особенно при длительном применении.
К существенным недостаткам обоих препаратов относится их неблагоприятное влияние на плод, требующее специального обучения женщин детородного возраста – значительной части потребителей ЛС для лечения ожирения [23]. Сумеют ли новые препараты внести существенный вклад в терапию ожирения и профилактику его осложнений, покажут новые клинические и фармакоэпидемиологические исследования, в т. ч. программы по выявлению и минимизации рисков, проводящиеся их производителями.


