Впоследние годы появилось множество публикаций, свидетельствующих о значительной частоте остеопенических состояний у детей. По данным Н.В. Корнилова и соавт. (2003), частота остеопении у подростков в возрасте от 15 до 18 лет, по данным рентгеновской денситометрии (DEXA – L2–L4), составляет 44 % [1]. А.П. Будова (2003) показала, что в Мурманской области снижение минеральной плотности костной ткани (МПК) зарегистрировано у 29 % детей в возрасте от 8 до 17 лет, в т. ч. у 23 % практически здоровых пациентов [2]. Проведенные в ФБГУ «Научный центр здоровья детей» РАМН выборочные денситометрические исследования школьников (более 500 детей 10–16 лет) выявили снижение МПК у 43,4–9,3 % пациентов [3]. Исследования практически здоровых детей в возрасте от 5 до 16 лет позволили обнаружить снижение МПК у 10–30 % обследованных [4], степень выраженности которой зависела от возраста детей. Выявлено, что остеопения достоверно чаще регистрировалась в подростковом возрасте [5, 6]. По данным ультразвуковой денситометрии костей, у детей 6–16 лет частота остеопении в костях предплечья и голени составляла 49,5 % [5].
Немногочисленные российские исследования показали, что среди практически здоровых детей в возрасте от 5 до 16 лет снижение МПК различной степени наблюдается у 10–30 % обследованных, причем значительно чаще у подростков [4, 5].
Методические рекомендации Рос-сийской ассоциации по остеопорозу, разработанные в соответствии с требованиями доказательной медицины, свидетельствуют о том, что наиболее значимыми пищевыми факторами, влияющими на костную минерализацию, являются кальций, фосфор и витамин D [7]. Подтверждено, что кальций, поступающий с пищей, замедляет потери костной массы с возрастом [8]. Изменения характера питания, пищевых привычек в последнее десятилетие привели к тому, что обеспечение оптимального поступления кальция с пищей в соответствии с возрастом представляет трудную задачу [10].
С обменом кальция тесно связан обмен фосфора. В организме взрослого человека содержится около 600–700 г фосфора (около 1 % массы тела). Около 90 % фосфора, подобно кальцию, находится в скелете – костях и зубах. Вместе с кальцием фосфор составляет основу твердого вещества кости [11].
Не менее важны для формирования костного матрикса и его минерализации такие микроэлементы, как медь, марганец, цинк и бор. Бор, влияя на активность некоторых ферментов, принимает участие в обмене веществ. Имеются данные о том, что бор обеспечивает регуляцию действия паратгормона и таким образом косвенно влияет на метаболизм магния, кальция, фосфора и холекальциферола [12]. Недостаточное содержание бора в организме женщин влияет на состояние минерального обмена и костной ткани [13].
Дефицит меди снижает скорость синтеза эластина и образование поперечных сшивок коллагена, что ставит под угрозу целостность органического матрикса костей и соединительной ткани между клетками, несмотря на то что само деление клеток является не медь-, а цинкзависимым процессом. Для выполнения своей функции коллаген должен «созреть» в процессе образования внутренних поперечных сшивок, требующего наличия медьсодержащей лизилоксидазы – фермента, очень чувствительного к дефициту меди. Последствия дефицита меди развиваются медленно и также медленно устраняются [14]. Дефицит меди сопровождается ухудшением состояния костной ткани с нарушением минерализации и развитием остеопороза [3, 11, 13, 15, 16].
Цинк в организме активизирует около 200 ферментов, регулирующих костеобразование, деление и созревание клеток, формирование иммунитета, синтез гормонов – инсулина и тестостерона. Цинк ускоряет заживление внутренних и наружных ран, он необходим для нормального роста волос, ногтей, предупреждает образование белых пятен на ногтях [11].
Марганец участвует в обмене гормонов щитовидной железы, обеспечивает развитие костной и соединительной ткани, хрящей, задействован в нормальном функционировании мышечной ткани, в регуляции обмена витаминов С, Е, группы В и холина. Дефицит марганца проявляется замедлением роста, нарушением метаболизма углеводов и липидов. При дефиците марганца возможно аномальное формирование и нарушение эндохондрального роста кости, возникновение переломов, сочетающихся с деформацией сухожилий [11].
Повышенная чувствительность организма детей и подростков к дефициту или избытку макро- и микроэлементов показана в многочисленных исследованиях [3, 17, 18]. Выявлено, что у детей с дисбалансом микроэлементов (марганца, меди, цинка, кадмия, свинца) обнаруживали значительные нарушения в состоянии здоровья.
Среди них чаще, чем среди здоровых детей, встречались пациенты с дисгармоничным физическим развитием, часто и длительно болеющие острыми респираторными заболеваниями, страдающие аллергической, нефрологической патологией, имеющие вегетативные и психоневрологические расстройства, нарушения деятельности желудочно-кишечного тракта (ЖКТ) [19, 20].
Дефицит таких микроэлементов, как цинк, железо, медь, селен, сказывается на морфофункциональном состоянии слизистой оболочки желудка и двенадцатиперстной кишки, свойствах пристеночной слизи, являющейся «первой линией» защиты гастродуоденальной зоны от агрессивных факторов воздействия [19, 21].
В Ставропольском крае проведено исследование содержания макро- и микроэлементов у подростков с хроническим гастродуоденитом и язвенной болезнью двенадцатиперстной кишки. На основании изучения элементного анализа волос авторы обнаружили снижение уровня магния в 2,2, цинка – в 1,5 раза. При этом установлено, что степень выраженности данного дисбаланса влияет на тяжесть течения заболевания, частоту рецидивов хронического гастродуоденита и язвенной болезни двенадцатиперстной кишки у подростков [22].
Целью настоящей работы стали комплексное исследование микроэлементного статуса, анализ внутриэлементных взаимоотношений, выявление взаимосвязей между микроэлементозом и МПК у подростков с патологией верхних отделов ЖКТ.
Материал и методы
В исследование были включены 30 подростков в возрасте 12–16 лет женского (4 человека) и мужского (26 человек) пола с патологией ЖКТ.
У 14 (46,7 %) больных диагностирован поверхностный гастрит, у 10 (33,3 %) – поверхностный гастродуоденит, у 6 (20 %) – гипертрофический гастродуоденит. С целью динамического изучения содержания микроэлементов (бора, меди, марганца) в волосах применен метод масс-спектрометрии с индуктивно связанной плазмой; для цинка – метод атомно-эмиссионной спектрометрии [11]. Определение микроэлементов проведено в Центре биотической медицины (д.м.н., проф. А.В. Скальный). МПК оценивалась методом двухэнергетической рентгеновской абсорбциометрии поясничного отдела позвоночника L2–L4 на денситометре HOLOGIC (модель QDR 4500С) с оценкой Z-критерия по величине отклонения от стандартных величин (SD) и BMD (bone mineral density; МПК в г/см2).
Индивидуальная интерпретация показателей МПК осуществлена путем стандартизации в зависимости от пола, роста и возраста [23].
При проведении статистического анализа полученных данных нами использовались пакеты прикладных программ MS Excel и STATISTICA. При расчете достоверности различий результатов применен t-критерий Стьюдента. Определение корреляционных взаимосвязей между содержанием микроэлементов осуществлено с помощью определения коэффициента корреляции. Точность аппроксимации (воспроизведения) МПК через микроэлементный статус проведена с помощью метода линейной регрессии с вычислением R-квадрата [24].
Результаты и их обсуждение
При обследовании подростков выявлено наличие факторов риска остеопении, в т. ч. такие внешнесредовые факторы, как курение (4 %), низкая физическая активность (40,5 %), избыточная двигательная активность (16 %), «скачок» роста за последний год (24, 5 %), избыточная масса тела (41 % пациентов).
Было обнаружено низкое потребление кальцийсодержащих продуктов всеми подростками. При этом суточное потребление кальция составляло в среднем 415 ± 80 мг, в то время как в возрасте 9–18 лет его нормальной суточной потребностью являются 1300 мг [7]. Состав пищевого рациона был несбалансированным по белку у 40 % подростков. В семейном анамнезе переломы костей верхних и нижних конечностей у родственников первой линии родства имели место у 29 % подростков. Более того, клинические признаки дефицита кальция в виде изменения ногтей (слоистость, ломкость) отмечены у 61 %, множественного кариеса, изменения эмали зубов – у 15 %, выпадения, ломкости волос – у 5 % обследуемых.
По данным денситометрии у 50 % пациентов имелись сниженные значения МПК. Индивидуальный анализ результатов определения МПК и Z-критерия показал, что степень деминерализации костной ткани соответствовала у них остеопении.
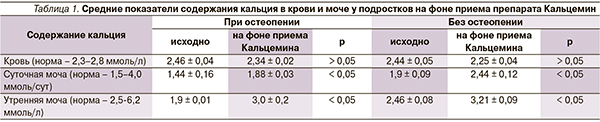
У пациентов с остеопенией уровень кальция в моче (как в суточной, так и в утренней порциях) был снижен, в то время как у подростков без остеопении вышеуказанные показатели соответствовали нормальным значениям (табл. 1). Результаты подтверждают следующее положение: адаптация организма к дефициту кальция осуществляется путем увеличения его всасывания в кишечнике и уменьшения почечной экскреции [11]. Уровень кальция в сыворотке крови не был изменен практически у всех детей.
У пациентов со сниженными показателями МПК выявлена достоверно сильная положительная корреляционная связь между МПК и уровнем кальция в утренней моче (r = 0,72) и связь средней силы между МПК и кальцием крови (r = 0,54). У подростков с нормальными показателями МПК отмечена средняя положительная корреляция между МПК и кальцием в утренней моче, а также между МПК и кальцием в сыворотке крови (r = 0,47 и 0,3 соответственно) во всех случаях p < 0,01.
При исследовании микроэлементов в волосах были выявлены всего два пациента с нормальным содержанием всех четырех исследуемых микроэлементов. Изменения в содержании одного микроэлемента отмечены у 4 человек, двух – у 6, трех – у 14, четырех – у 4. Среднее содержание микроэлементов в волосах подростков приведено в табл. 2.
Из данных, приведенных в табл. 2, следует, что у пациентов с остеопенией наблюдалось выраженное достоверное снижение уровней бора и марганца в волосах (p < 0,05), а содержание меди и цинка обнаруживало тенденцию к повышению. При нормальных показателях МПК у подростков наблюдалось умеренное снижение уровня бора, уровни марганца и цинка имели тенденцию к повышению, содержание меди оказалось повышенным (p < 0,05).
Полученные данные свидетельствуют о том, что при остеопении в организме подростков наблюдается дисбаланс микроэлементов за счет сдвигов в содержании бора, меди, марганца и цинка. У подростков без остеопении, но имеющих факторы риска ее развития, в основном отмечается тенденция к сдвигам содержания исследуемых микроэлементов.
При анализе индивидуальных фактических данных у обследуемых пациентов изменения содержания микроэлементов носили разнонаправленный характер. Чаще всего встречался дефицит бора и марганца: соответственно у 19 (63 %) и 12 (40 %) человек. Дефицит цинка наблюдался реже – у 9 (30 %) подростков. Избыточное содержание меди было обнаружено у 13 (43 %), цинка – у 8 (28 %) человек.
Дефицит ряда микроэлементов, очевидно, можно объяснить не только их низким потреблением с продуктами питания, но и зависимостью от темпов поступления кальция [25]. У подростков в условиях накопления костной массы темпы потребления кальция в организме значительно опережают темпы потребления бора, меди, марганца, цинка, что повышает их выведение и, соответственно, приводит к их относительному дефициту. Более того, патология ЖКТ у обследуемых пациентов способствует формированию дисэлементоза и усугубляет нарушения метаболизма костной ткани. Повышенные уровни цинка и меди, вероятно, обусловлены образованием комплексов микроэлементов с белком-металлопротеином и их накоплением в различных тканях, в т. ч. и в волосах. По данным I. Bremner (1980), комплексы белка с микроэлементом значительно снижают скорость оборота микроэлемента и затрудняют его быстрое встраивание в микроэлементзависимые функции организма [26].
Полученные результаты свидетельствуют о том, что при остеопении дисбаланс микроэлементов наблюдается гораздо чаще, что подтверждает их значимость в процессе остеогенеза. В условиях интенсивного развития и роста подростков даже в отсутствие остеопении наличие дисбаланса микроэлементов является неблагоприятным прогностическим фактором, во многом определяющим прочность и качество костной ткани.
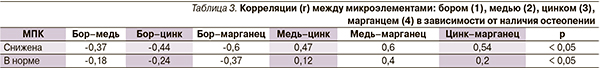
Поскольку микроэлементы обладают широким спектром синергических и антагонистических взаимоотношений в организме, нами проведен анализ корреляционных связей между исследуемыми микроэлементами в зависимости от наличия остеопении (табл. 3). При остеопении выявлены достоверные корреляционные связи средней силы: прямая – между медью, цинком, марганцем, обратная – между бором и указанными выше элементами.
У пациентов без остеопении корреляционные взаимосвязи между исследуемыми микроэлементами имели аналогичную направленность, однако их сила была слабой. Исходя из полученных результатов следует, что при остеопении происходит усиление взаимосвязей между микроэлементами. Отмеченная отрицательная взаимосвязь между бором и медью, цинком, марганцем указывает на значимость бора в регуляции микроэлементного звена гомеостаза, ответственного за архитектонику костной ткани.
В то же время при остеопении наиболее часто наблюдаемый дефицит бора развивается в условиях избытка меди, цинка и марганца. Сказанное подтверждает факт наличия взаимосвязи между микроэлементами, когда дисбаланс даже одного из них инициирует цепную реакцию развития нарушений микроэлементного состава в целом. Кроме того, нельзя исключить и физиологические конкурентные отношения между микроэлементами в организме.
Определение частного коэффициента корреляции позволило выявить влияние отдельной конкретной корреляционной связи МПК–микроэлемент на силу связи между МПК, кальцием и микроэлементами в целом. Так, у пациентов со сниженной МПК отмечено влияние корелляционной связи кальций–МПК на связь марганца с МПК, частный коэффициент корреляции при этом увеличивался в 5 раз. Кроме того, выявлено влияние корреляционных связей бор–МПК, медь–МПК, цинк–МПК на связь кальция с МПК.
Возможность оценки состояния костной ткани по содержанию микроэлементов подтверждена методом исследования линейной регрессии с вычислением R-квадрата, отражающего точность воспроизведения факта через другие показатели. Высокая точность воспроизведения (апроксимация) характеризуется значениями R-квадрата, приближающимися к единице. В качестве модели для воспроизведения МПК взяты содержание кальция в утренней моче, фосфора в суточной моче и кальций-креатининовый индекс с последующим присоединением к модели показателей микроэлементов, полученных при исследовании.
Выяснилось, что у детей с остеопеническим синдромом исходная модель имела удовлетворительную точность аппроксимации, при этом значение R-квадрата составило 0,54. При добавлении показателей микроэлементов модель становилась более устойчивой (увеличение R-квадрата – до 0,6–0,7) и значимой (значимость критерия Фишера < 0,05). При включении в модель показателей всех исследуемых микроэлементов уровень R-квадрата оказался наиболее высоким (0,8), что свидетельствует о хорошей аппроксимации (модель в целом адекватна описываемому явлению), значимость критерия Фишера < 0,05. При этом у детей без остеопенического синдрома показатели были значительно ниже (R-квадрат – 0,27), причем при добавлении показателей микроэлементов увеличение R-квадрата было незначительным.
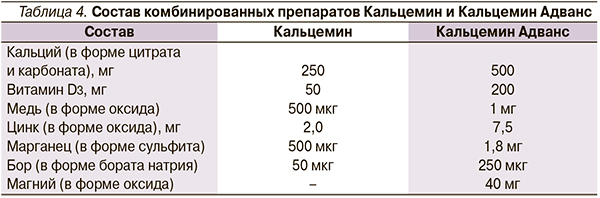
Всем пациентам с патологией ЖКТ назначался комплекс лечебных мероприятий, включивший обеспечение полноценного питания, повседневные, адекватные возрасту и состоянию здоровья физические нагрузки, использование лекарственных средств. В связи с дефицитом потребления алиментарного кальция особое внимание уделено его содержанию в рационе питания. После обследования определены рекомендации по ежедневной физической нагрузке. С целью эффективной коррекции дисэлементоза и остеопении подросткам назначался комбинированный препарат Кальцемин, в состав которого кроме двух солей кальция (цитрата, карбоната) и витамина D входят микроэлементы – бор, медь, марганец, цинк. Кальцемин имеет две лекарственные формы – Кальцемин и Кальцемин Адванс (табл. 4). Выбор препарата был обусловлен высоким уровнем биодоступности и безопасностью применения, а также оптимальной комбинацией в одной таблетке солей кальция, витамина D (холекальциферола) и микроэлементов, важных для костеобразования.
Для профилактики дефицита кальция и дисмикроэлементоза Кальцемин рекомендуется детям с пятилетнего возраста и подросткам. Длительность применения не ограничена. При коррекции остеопении, как правило, назначается Кальцемин Адванс, при остеопорозе препарат является базовым и входит в состав комплексной терапии.
При наличии остеопении нами назначался Кальцемин Адванс по 1 таблетке 2 раза в день, в ее отсутствие – Кальцемин или Кальцемин Адванс в зависимости от суточного потребления кальция с продуктами питания и возрастной суточной потребности, а также от наличия факторов риска остеопении и выраженности дисбаланса микроэлементов, подтвержденного лабораторно. На фоне приема препарата динамические исследования содержания микроэлементов в волосах, показателей фосфорно-кальциевого обмена МПК проводились через 8–12 месяцев.
Отмечено, что после приема препарата в течение 8–12 месяцев у подростков с остеопенией имела место отчетливая положительная динамика МПК, при этом среднее ее значение достоверно увеличилось с 0,818 до 0,9079 г/см2 (р < 0,05). Однако анализ индивидуальных данных показал, что МПК, несмотря на позитивную динамику, у большинства пациентов не достигала нормативов в зависимости от пола, роста и возраста.
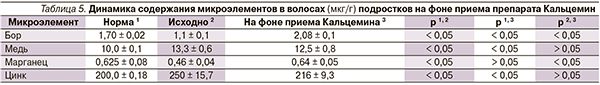
Оценка динамики микроэлементов на фоне приема препарата показала, что уровень бора и марганца достоверно увеличился до нормативных значений. Исходно повышенные показатели меди и цинка имели тенденцию к снижению, при этом уровень цинка приближался к норме (табл. 5).
При назначении Кальцемина пациентам с исходно повышенным содержанием цинка и меди динамика их уровней отслеживалась каждые 3 месяца, для того чтобы при выраженном повышении показателей отменить препарат и проводить коррекцию кальциевого дефицита одной из солей кальция с витамином D3. Однако при динамическом исследовании содержание исследуемых микроэлементов имело тенденцию к снижению, которая через 6–8 месяцев реализовывалась в достоверное снижение уровня цинка, значения которого приближались к норме, концентрация меди сохраняла тенденцию к снижению. Установленный факт, очевидно, обусловлен тем, что дотация микроэлементов явилась толчком к увеличению скорости их оборота, столь необходимого для формирования и минерализации костного матрикса в условиях растущего организма. Сказанное согласуется с существующей точкой зрения, согласно которой уровень микроэлементов в биологических субстратах не всегда отражает потребность организма в них [11].
Наблюдаемая умеренная тенденция к снижению содержания меди, возможно, обусловлена тем, что коррекция сдвигов в ее уровне – процесс очень длительный, который может составлять 18 месяцев и более [11].
Анализ динамики показателей кальциевого обмена показал, что при остеопении на фоне приема Кальцемина исходно сниженная экскреция кальция с мочой стала нормальной. Наиболее значимые позитивные сдвиги наблюдались в содержании кальция в утренней моче. Уровень суточной экскреции кальция с мочой также достоверно увеличился (р < 0,05). У подростков без остеопении содержание кальция в утренней и суточной моче, исходно находившееся на нижней границы нормальных значений, повысилось до средней возрастной нормы. Результаты динамических исследований позволяют подтвердить положение о способности кальция в комплексе с витамином D тормозить повышенную резорбцию костной ткани на ранней стадии остеопении, предотвращая потерю костной массы [27].
В практической работе при назначении препаратов кальция с целью профилактики либо коррекции остеопении очень часто возникает вопрос: безопасен ли длительный прием кальция, не увеличивается ли при этом кристаллизация оксалатов и уратов с риском формирования конкрементов?
С целью изучения влияния солей кальция на риск развития метаболических нарушений с формированием оксалурии/уратурии и/или кристаллурии проведено исследование экскреции уратов и оксалатов с мочой, кристаллурии и теста на антикристаллобразующую способность мочи до назначения и через 6–8 месяцев приема Кальцемина.
Результаты исследования показали, что экскреция уратов с мочой до и после 6–8-месячного применения Кальцемина оставалась в пределах нормальных величин, составив соответственно 3,1 ± 0,05 и 2,2 ± 0,07 ммоль/сут (норма – 2–4 ммоль/сут). Следует отметить, что на фоне приема препарата имела место тенденция к снижению содержания уратов в моче почти до нижней границы нормы. Это, вероятно, обусловлено более низким потреблением животного белка с пищей, а также одним из эффектов кальция, проявляющимся блокадой предшественников мочевой кислоты.
Анализ динамического исследования экскреции оксалатов с мочой не выявил повышения их уровня на фоне приема Кальцемина. Более того, исходный уровень оксалатов, близкий к верхней границе референтных значений (у 9 пациентов) на фоне приема Кальцемина Адванс, снизился более чем в 2 раза и достиг средней нормальной величины. Протективный эффект кальция, по-видимому, обусловлен тем, что он, связывая оксалаты в кишечнике, предотвращает их избыточную экскрецию с мочой. На подобный механизм нормализации уровня оксалатов в моче и снижения риска формирования конкрементов при достаточном потреблении кальция указывают эпидемиологические исследования [28]. При оценке влияния кальция на появление оксалатно-кальциевой кристаллурии отмечено, что до приема Кальцемина кристаллурия имела место у 8 подростков при нормальной экскреции оксалатов с мочой. На фоне приема препарата кристаллурия сохранялась лишь у 2 пациентов.
Положительной динамике исследуемых показателей способствовали рекомендации по исключению из пищевого рациона оксалогенных продуктов, достаточный питьевой режим, а также прием Кальцемина Адванс, в состав которого входят магний, корригирующий кристаллурию, а также цитратная соль кальция, предупреждающая кристаллизацию исследуемых метаболитов и, соответственно, образование конкрементов. Суточная доза магния при приеме Кальцемина Адванс сопоставима с лечебной дозой солей магния, применяемых при оксалурии. Кроме того, имеются данные, будто бор снижает содержание оксалатов в моче [11]. Исходя из изложенного, Кальцемин Адванс можно считать препаратом выбора при остеопении, сочетающейся с оксалурией и/или кристаллурией.
Заключение
Совокупность полученных данных подтверждает значимость макро- и микроэлементов в формировании костного матрикса и его минерализации, позволяет полагать, что дисэлементоз является одним из патогенетических факторов формирования остеопении у подростков с патологией верхних отделов ЖКТ. Выраженные сдвиги в содержании комплекса основных микроэлементов, принимающих непосредственное участие в остеогенезе, – бора, меди, марганца и цинка, могут отражать снижение МПК и позволяют выявлять остеопению либо прогнозировать ее развитие. Для коррекции остеопении и профилактики ее развития целесообразно длительное (6–8 месяцев и более) назначение комбинированных препаратов, содержащих не только кальций и витамин D3, но и микроэлементы. Применение подростками с патологией верхних отделов ЖКТ комбинированного препарата Кальцемин способствовало восстановлению нарушенного элементного гомеостаза и повышению прочности костной ткани, не вызывая обострений этих заболеваний. Своевременная коррекция дисбаланса микроэлементов и дефицита кальция путем назначения рационального питания в сочетании с длительным применением комбинированных препаратов дает возможность не только нивелировать сдвиги в содержании макро- и микроэлементов, но и предотвращать прогрессирование остеопении.