Хроническая обструктивная болезнь легких (ХОБЛ) – прогрессирующее заболевание с не полностью обратимой бронхиальной обструкцией, возникающее под воздействием различных факторов (главным из которых является курение) [1]. По данным ряда недавно выполненных исследований, распространенность ХОБЛ в мире среди людей старше 40 лет составляет 10,1 % (11,8 % мужчин и 8,5 % женщин) [3]. В Российской Федерации ХОБЛ страдают около 16 млн человек [3]. ХОБЛ является одной из наиболее актуальных медикосоциальных проблем. Это обусловлено не только широкой распространенностью заболевания, но и высоким риском серьезных осложнений, которые приводят к инвалидизации и смертности, в т. ч. среди трудоспособного населения [1].
Современная терапия ХОБЛ
Современный уровень развития клинической медицины дает возможность эффективно воздействовать на течение ХОБЛ. Спектр лекарственных средств (ЛС), рекомендованных в качестве длительной поддерживающей терапии ХОБЛ, включает коротко- и длительнодействующие бронходилататоры, ингаляционные глюкокортикостероиды (ИГКС), комбинированные препараты (ИГКС/длительно действующие β2-агонисты), антиоксиданты (N-ацетилцистеин) и вакцины [1, 4]. Особое место среди ЛС, используемых в терапии стабильного периода ХОБЛ, занимают длительнодействующие бронходилататоры (ДДБД). Согласно руководству GOLD (Global Strategy of Chronic Obstructive Lung Disease), ДДБД более эффективны и удобны, чем короткодействующие бронходилататоры (КДБД) (уровень доказательности А) [1]. В настоящее время к ДДБД относятся всего три препарата: формотерол, салметерол (длительнодействующие β2-агонисты – ДДБА) и тиотропия бромид (длительнодействующий антихолинергический препарат – ДДАХП).
Достоинство тиотропия бромида (Спиривы) заключено в его селективности по отношению к М1- и М3-рецепторам и длительной продолжительности его действия [5, 6]. Препарат обеспечивает бронходилатацию и протекцию против холинергических бронхоконстрикторных стимулов в течение 24 часов, что делает возможным его применение один раз в сутки. Такие свойства препарата значительно упрощают режим дозирования и улучшают приверженность больных терапии.
Прирост функциональных легочных показателей больных ХОБЛ на фоне терапии тиотропием во всех исследованиях превышал таковой пациентов, получавших препараты сравнения, и данное улучшение поддерживалось на протяжении всего периода исследования без развития тахифилаксии [7]. Тиотропий оказался первым препаратом с положительным влиянием на легочную гиперинфляцию, подтвержденным рандомизированными контролируемыми исследованиями (РКИ) [8]. Улучшение функциональных параметров на фоне терапии тиотропием сопровождалось улучшением клинической картины, переносимости физических нагрузок, качества жизни больных, снижением кратности приема КДБД [6]. Среди больных, принимавших тиотропий, было отмечено меньшее число обострений ХОБЛ, значительно увеличивалось время до первого обострения, уменьшалось число госпитализаций [6].
Согласно современным международным и национальным рекомендациям по лечению ХОБЛ, любой из ДДБД – тиотропий или формотерол, или салметерол – должен назначаться всем больным ХОБЛ, начиная со средней степени тяжести заболевания (II стадии по классификации GOLD) [1]. Существуют ли различия между данными препаратами?
Безусловно, на сегодня тиотропий – единственный препарат 24-часового действия, и он считается, пожалуй, наиболее изученным ЛС при ХОБЛ [1]. Однако в течение ближайших лет в нашем арсенале ЛС лечения ХОБЛ появятся новые препараты ультрадлительного действия (не менее 24 часов) как ДДБА (индакатерол, кармотерол, милветерол и др.), так и ДДАХП (аклидиниума бромид, даротропиума бромид, гликопирролиума бромид и др.) [9]. Так, первые исследования, посвященные новому ДДБА, индакатеролу, продемонстрировали, что новый препарат, так же как и тиотропий, улучшает функциональные легочные показатели, симптомы, физическую работоспособность, качество жизни больных ХОБЛ, уменьшает число обострений заболевания [10–19].
Тем не менее только терапия тиотропием продемонстрировала следующие преимущества, пока не показанные при изучении всех других известных ДДБД:
- замедление прогрессирования ХОБЛ;
- уменьшение летальности больных ХОБЛ;
- снижение риска сердечно-сосудистых событий;
- высокая эффективность при всех изученных фенотипах ХОБЛ.
Терапия тиотропием замедляет прогрессирование ХОБЛ
Прогрессирование обструктивных заболеваний легких обычно оценивается по скорости снижения показателя объема форсированного выдоха за 1 секунду (ОФВ1), у здоровых он равен около 20–30 мл/год, у больных ХОБЛ – 40–80 мл/год [20, 21]. Для оценки скорости прогрессирования заболевания необходимо исследование множества больных (обычно более 100 человек) в течение довольно продолжительного срока (несколько лет) [22].
Долгое время единственным мероприятием, способным приостанавливать прогрессирование ХОБЛ, был ранний отказ от курения [23, 24]. Изучению влияния длительной поддерживающей терапии тиотропием на клиническое течение ХОБЛ (ежегодное снижение функциональных показателей, качество жизни, частоту обострений и летальность больных) было посвящено глобальное исследование UPLIFT (Understanding the Potential Long-term Impacts on Function with Tiotropium) [25]. Исследование UPLIFT имело рандомизированный контролируемый двойной слепой дизайн, продолжалось 4 года, в нем участвовало 490 исследовательских центров из 37 стран мира, и в общей сложности в него были включены 5993 больных ХОБЛ. В данном исследовании все больные были рандомизированы в две группы терапии: прием тиотропия 18 мкг 1 раз в сутки (2986 больных) или плацебо (3006 больных). Дизайн исследования был максимально приближен к условиям “реальной жизни”, т. е. больным, принявшим участие в исследовании, разрешался прием любых препаратов (включая ИГКС, ДДБА и теофиллины), за исключением антихолинергических (АХП).
Несмотря на то что в нескольких годичных исследованиях были получены обнадеживающие результаты замедления прогрессирования ХОБЛ на фоне приема тиотропия по сравнению с приемом ипратропия [26] или плацебо [27], в исследовании UPLIFT оценка всей когорты пациентов ХОБЛ не выявила различий между группами по скорости изменения ОФВ1. В то же время обращает на себя внимание, что ежегодное снижение постбронходилатационного показателя ОФВ1 (42 мл/год) даже в группе плацебо оказалось меньше [25], чем в других известных исследованиях (47–69 мл/год) (см. таблицу) [28–33].
Как можно объяснить полученные результаты?
Почти «нормальные физиологические» ежегодные изменения функциональных показателей в исследовании UPLIFT можно объяснить с точки зрения дизайна исследования, приближенного к «реальной жизни». Как уже говорилось, в данном исследовании разрешался прием любых лекарственных препаратов (кроме АХП), в итоге более 70 % больных ХОБЛ принимали и ИГКС, и ДДБА [25]. Возможно, такая комплексная терапия, а также активная терапия обострений заболевания сами по себе могли замедлить прогрессирование ХОБЛ и дальнейшее добавление других препаратов (тиотропия) не привело к очередному замедлению снижения ОФВ1, т. к. этот показатель уже не отличался от «нормы», т. н. эффект потолка. Справедливость данного положения подтверждает субгрупповой анализ, показавший достоверные отличия между группами тиотропия и плацебо по скорости ежегодного снижения ОФВ1 у больных, не получавших ни ИГКС, ни ДДБА (40 против 47 мл/год, р = 0,046) [25].
Кроме того, в исследовании UPLIFT доля актуальных курильщиков составила всего 30 %, что значительно меньше по сравнению с другими исследованиями (38–90 %), и в ходе самого исследования еще 26 % больных изменили свой статус курения (большинство бросили курить). Еще одним объяснением отсутствия различий между группами по скорости изменения функциональных показателей стал более высокий риск выбывания из исследования больных, принимавших плацебо [25].
Исследование UPLIFT благодаря большому объему выборки больных позволило также оценить эффективность терапии тиотропием в отдельных группах пациентов ХОБЛ: у больных ранними стадиями ХОБЛ, «наивных» больных (т. е. никогда не получавших никакой терапии по поводу ХОБЛ), у больных моложе 50 лет. Оказалось, что именно в данных субтипах (фенотипах) ХОБЛ-терапия тиотропием демонстрирует достоверное с точки зрения методов статистики замедление скорости ежегодного снижения ОФВ1 [34–36].
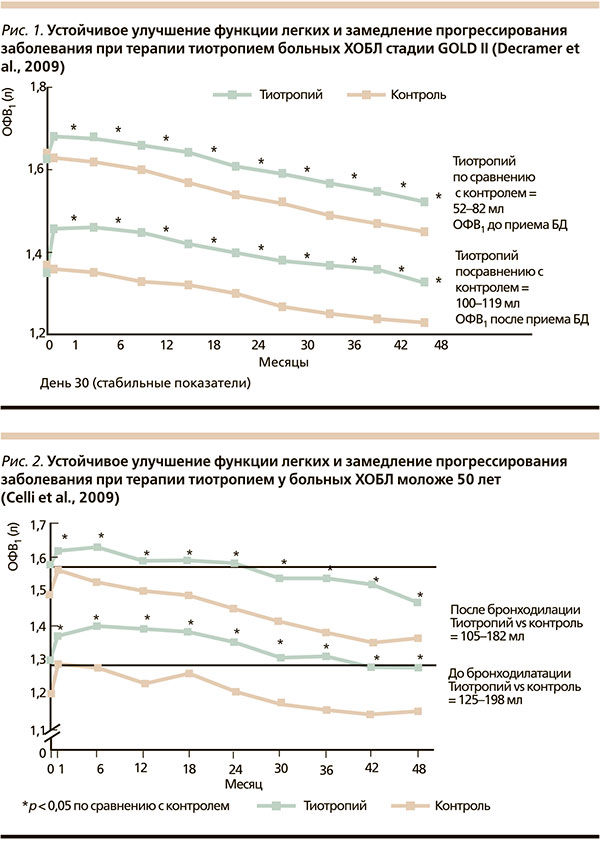
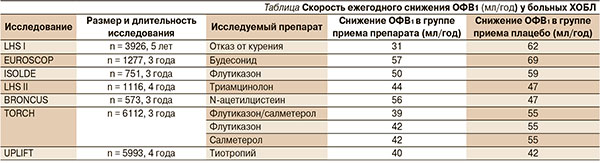
Среди больных ХОБЛ II стадии скорость снижения постбронходилатационного ОФВ1 была достоверно ниже в группе тиотропия по сравнению с контрольной группой (43 против 49 мл в год; p = 0,024; рис. 1) [34]. Для больных, никогда не получавших никакой терапии по поводу ХОБЛ, ежегодное снижение постбронходилатационного показателя ОФВ1 оказалось более медленным, чем для больных, получавших тиотропий (42 против 53 мл в год; p = 0,026), по сравнению с больными группы контроля (рис. 2) [35].
Еще более впечатляющие результаты были получены от больных ХОБЛ моложе 50 лет: скорость снижения постбронходилатационного ОФВ1 в группах тиотропия и контроля составили 38 и 58 мл/год соответственно (p < 0,05) (рис. 3) [36].
Таким образом, данный субгрупповой анализ исследования UPLIFT показал, что у больных ХОБЛ II стадии, «наивных» больных и у больных моложе 50 лет прием тиотропия уменьшает скорость снижения постбронходилатационного ОФВ1, т. е. замедляет прогрессирование ХОБЛ.
Терапия тиотропием уменьшает летальность больных ХОБЛ
ХОБЛ является одной из ведущих причин заболеваемости и смертности в современном обществе, летальность от ХОБЛ занимает 4-е место среди всех причин смерти в общей популяции [37]. Более того, летальность от ХОБЛ постоянно растет [38]. Согласно прогнозам экспертов ВОЗ, к 2020 г. ХОБЛ выйдет на третье место среди всех причин летальности и на первое – среди всех причин инвалидности взрослых [38, 39].
К терапии, способной снижать летальность больных ХОБЛ, отно-сятся:
- длительная кислородотерапия (для тяжелых больных с гипоксемией) [40, 41];
- отказ от курения (на ранних стадиях ХОБЛ) [42];
- хирургическая редукция объема легких (больных с преимущественной локализацией эмфиземы в верхних отделах и низкой толерантностью к физическим нагрузкам) [43];
- неинвазивная вентиляция легких (при тяжелом обострении ХОБЛ) [44].
Что касается ЛС, есть определенные основания предполагать, что современные препараты, используемые в лечении ХОБЛ (и способные улучшать функциональные параметры, снижать число обострений, замедлять прогрессирование заболевания), могут уменьшать и летальность больных.
Важным достижением исследования UPLIFT стало доказательство уменьшения летальности больных ХОБЛ на фоне приема тиотропия. При применении тиотропия во время лечения больных ХОБЛ было отмечено достоверное снижение относительного риска смерти на 16 % (p < 0,05). Этот эффект сохранялся до конца определенного протоколом периода лечения (день 1440) – в анализе intention-to-treat отмечено достоверное снижение риска смерти на 13 % (p < 0,05). Но данный эффект стал статистически незначимым: относительный риск смерти снижался на 11 % (p = 0,09) в течение периода наблюдения после окончания исследования длительностью 30 дней (день 1470), когда в соответствии с протоколом пациенты прекращали прием исследуемого препарата.
Примечательно, что возможность снижения летальности больных ХОБЛ во время приема тиотропия показана и в других недавно выполненных исследованиях.
Мета-анализ Salpeter и соавт., объединивший результаты 22 РКИ с участием больных ХОБЛ, показывал, что АХП (ипратропий и тиотропий) уменьшают частоту тяжелых обострений ХОБЛ на 33 %, а респираторную смертность – на 73 % по сравнению с плацебо [45]. Абсолютное снижение риска респираторной смерти при применении АХП составило 0,36 % в год.
В популяционном когортном исследовании, основанном на базе данных здравоохранения Дании и включившем 2870 больных ХОБЛ, принимавших тиотропий, и 7773 больных ХОБЛ группы контроля, были проанализированы все причины смерти больных за 6 лет [46]. Оказалось, что прием тиотропия ассоциирован с достоверным снижением риска смерти больных ХОБЛ от всех причин (относительный риск [ОР] = 0,77; 95 % доверительный интервал [ДИ] – 0,65–0,91) и при этом не было отмечено повышения риска смерти больных от сердечной недостаточности (ОР = 0,84, 95 % ДИ – 0,41–1,75) или острого инфаркта миокарда – ОИМ (ОР = 1,25, 95 % ДИ – 0,49–3,17).
Терапия тиотропием приводит к снижению риска сердечно-сосудистых событий
Крупные эпидемиологические исследования продемонстрировали, что ведущей причиной летальности больных ХОБЛ легкого/среднетяжелого течения остается не только дыхательная недостаточность, как традиционно было принято считать, но и сердечно-сосудистые заболевания – ишемическая болезнь сердца и сердечная недостаточность [47, 48]. Согласно данным популяционных исследований, у больных ХОБЛ риск сердечно-сосудистой смерти повышен в 2–3 раза и составляет приблизительно 50 % от общего количества смертельных случаев [49, 50].
АХП (ипратропий и тиотропий) обладают минимальным сердечно-сосудистым эффектом, они не абсорбируются со слизистых оболочек дыхательных путей и поэтому не вызывают системных побочных эффектов, присущих атропину (тахикардия, аритмии). В отличие от β2-агонистов АХП не индуцируют у больных ХОБЛ тахикардию или повышение сердечного выброса, не ухудшают вентиляционно-перфузионный баланс и не усугубляют гипоксемию [51].
Относительно недавно было опубликовано исследование, в котором были поставлены под сомнение общепринятые представления о сердечно-сосудистой безопасности АХП.
В мета-анализе Singh и соавт., в общей сложности включившем 17 РКИ (14 783 больных ХОБЛ), авторы пришли к выводу, что прием АХП (ипратропия или тиотропия) приводит к повышению риска сердечно-сосудистых событий (ОР = 1,58, 95% ДИ – 1,21–2,06), ОИМ (ОР = 1,53, 95 % ДИ – 1,05–2,23) и сердечно-сосудистой летальности больных ХОБЛ (ОР = 1,80, 95 % ДИ – 1,17–2,77) [52]. В связи с тем что данный мета-анализ имел серьезные недостатки в дизайне исследований и обоснованность его выводов была поставлена под сомнение, требовались данные, полученные из более хорошо спланированных исследований, позволяющие подтвердить или опровергнуть сердечно-сосудистый риск при приеме ДДАХП. Поэтому появление результатов исследования UPLIFT пришлось как нельзя кстати, т. к. данные этого исследования продемонстрировали, что тиотропий не только не повышает риск сердечно-сосудистых событий и смертности, а наоборот, снижает риск летальности от сердечно-сосудистых причин (на 27 %) и число серьезных сердечно-сосудистых нежелательных реакций (на 16 %). ОИМ развился у 67 больных, принимавших тиотропий, и у 85 пациентов, принимавших плацебо (ОР = 0,73, 95 % ДИ – 0,53–1,00), инсульт был отмечен у 82 больных группы тиотропия и у 80 пациентов группы плацебо (ОР = 0,95, 95 % ДИ – 0,70–1,29). Необходимо отметить, что прием тиотропия позволил достоверно снизить число эпизодов дыхательной недостаточности (ОР = 0,69, 95 % ДИ – 0,52–0,92).
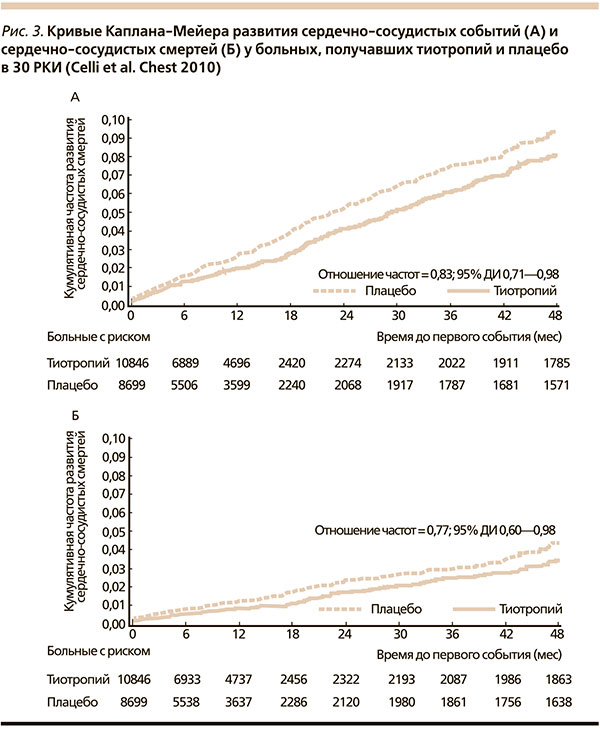
Cамым полным на сегодня является недавно выполненный мета-анализ Celli и соавт., основанный на всех РКИ (n = 30), посвященных применению тиотропия больными ХОБЛ (n = 19 545) [53]. Частота развития всех летальных случаев на фоне терапии тиотропием составила 3,44, плацебо – 4,10 на 100 пациенто-лет (ОР = 0,88, 95 % ДИ – 0,77–0,999). У больных, принимавших тиотропий, достоверно реже развивались сердечно-сосудистые события: 2,15 против 2,67 (плацебо) на 100 пациенто-лет (ОР = 0,83, 95 % ДИ – 0,71–0,98) и фатальные сердечно-сосудистые события: 0,91 против 1,24 (плацебо) на 100 пациенто-лет (ОР = 0,77, 95 % ДИ – 0,60–0,98). Для всех случаев ОИМ, сердечной недостаточности и инсульта ОР (95 % ДИ) составили 0,78 (0,59–1,02), 0,82 (0,69–0,98), и 1,03 (0,79–1,35) соответственно.
Таким образом, терапия тиотропием приводит к снижению риска развития сердечно-сосудистых событий, летальности от всех причин и летальности от сердечно-сосудистых причин у больных ХОБЛ.
Терапия тиотропием высокоэффективна при всех изученных фенотипах ХОБЛ
Сегодня многие эксперты и практические врачи разделяют мнение, согласно которому ХОБЛ – синдром, включающий группу обструктивных заболеваний, которые имеют сходные признаки, например ингаляционный источник повреждения, и определенные различия, например механизмы развития заболевания и ответ на терапию [54].
Дискуссия о необходимости выделения различных суб- или фенотипов ХОБЛ ведется уже достаточно давно [55], но лишь в течение последних двух лет наметились существенные сдвиги в определении проблемы гетерогенности заболевания [56].
Следует признать, что для ХОБЛ понятие «фенотип« – относительно новое и общепринятого определения «фенотипа ХОБЛ» еще нет. Относительно недавно группой экспертов было предложено определение фенотипа ХОБЛ: «характерная черта или комбинация таких черт, которые описывают различия между пациентами ХОБЛ, связанные с клинически значимыми исходами (симптомы, обострения, ответ на терапию, скорость прогрессирования заболевания или смерть)» [57]. В идеале индивидуумы, включенные в один фенотип и демонстрирующие сходные клинические исходы, должны демонстрировать и сходный профиль терапевтического ответа вследствие сходных биологических или патофизиологических механизмов. Идентификация и последующая группировка ключевых элементов синдрома ХОБЛ в клинические значимые и полезные подгруппы (фенотипы) позволят проводить более эффективную терапию больных ХОБЛ [57].
В недавно проведенном исследовании Lee и соавт. было выявлено, что при ХОБЛ терапия ИГКС/ДДБА наиболее эффективна для пациентов с преимущественно обструктивным (бронхитическим) вариантом ХОБЛ – у них наблюдался наибольший прирост ОФВ1 и более выраженное уменьшение диспное, но малоэффективной – при преимущественно эмфизематозном варианте ХОБЛ [58]. В то же время в исследовании Gelb и соавт. показано, что эффективность терапии тиотропием больных ХОБЛ не зависит от выраженности у них эмфиземы [59].
Субгрупповые анализы исследования UPLIFT позволили изучить эффективность терапии тиотропием в отдельных субтипах (фенотипах) больных ХОБЛ [35, 36, 60, 61]. Как уже говорилось, прием замедлил прогрессирование ХОБЛ у больных, «наивных» больных и у больных моложе 50 лет [35, 36]. Кроме того, независимо от фенотипа ХОБЛ («наивные» больные, больные моложе 50 лет, курильщики, бывшие курильщики, мужчины и женщины) терапия тиотропием приводила к заметному стойкому улучшению показателей ОФВ1 и форсированной жизненной емкости легких, снижению числа обострений и улучшению качества жизни [35, 36, 60, 61].
Заключение
Тиотропий относится к базисным препаратам длительной поддерживающей терапии ХОБЛ. Тиотропий улучшает функциональные легочные показатели, симптомы, физическую работоспособность, качество жизни больных ХОБЛ, уменьшает число обострений заболевания. В настоящее время только терапия тиотропием продемонстрировала преимущества, пока еще не показанные в результате изучения всех других известных ДДБД: замедление прогрессирования ХОБЛ, уменьшение летальности больных ХОБЛ, снижение риска сердечно-сосудистых событий и высокая эффективность препарата при всех изученных фенотипах ХОБЛ.