Согласно эпидемиологическим исследованиям, частота хронического употребления алкоголя в различных регионах составляет от 3 до 10 % среди населения старше 18 лет [12]. Согласно современным представлениям, хроническая алкогольная интоксикация лежит в основе развития алкогольной болезни, рассматриваемой как комплекс психических и соматоневрологических расстройств, связанных с регулярным употреблением алкоголя в опасных для здоровья дозах.
В последнее время значительный вклад в увеличение общей алкоголизации общества вносит женский алкоголизм. Проведенные ранее исследования показали, что женщины более восприимчивы к токсическому воздействию алкоголя, что обусловлено рядом гендерных особенностей [10]. Одним из важных физиологических различий между мужчинами и женщинами в отношении метаболизма алкоголя является скорость всасывания. Употребление одинаковой дозы алкоголя приводит к более высокой его концентрации в крови у женщин с учетом массы тела. Известно, что женщины имеют более низкое содержание воды в организме в отличие от мужчин, в результате чего у женщин алкоголь растворяется в меньшем количестве воды, что способствует увеличению его концентрации в крови [9].
Кроме того, получены данные о повышении уровня ацетальдегида (метаболита этанола) в фазу менструального цикла, сопровождающегося повышением уровня эстрогена, что также приводит к увеличению содержания алкоголя в крови и как следствие – к развитию алкогольной интоксикации [11]. У женщин злоупотребление алкоголем чаще приводит к развитию таких осложнений, как алкогольная болезнь печени, остеопороз, заболевания сердечно-сосудистой системы, поражение центральной и периферической нервной системы [4]. Наиболее частым проявлением алкогольной болезни является полиневропатия (АПН), частота которой, по данным разных авторов, варьируется от 9 до 67 % [1, 7].
Несмотря на имеющуюся информацию о гендерных различиях влияния алкоголя, проблема женского алкоголизма изучена недостаточно. Остается не исследованным вопрос о механизмах поражения периферических нервов у женщин с хронической алкогольной интоксикацией.
Целью исследования стало изучение клинических и нейрофизиологических проявлений алкогольной полиневропатии у женщин с хронической алкогольной интоксикацией, разработка патогенетически обоснованных методов коррекции.
Материал и методы
Обследованы 27 пациенток в возрасте от 31 до 58 лет (средний возраст – 47,1 ± 7,9 года), находившихся на лечении в клинике нервных болезней Первого МГМУ им. И.М. Сеченова. Длительность регулярного употребления алкоголя, со слов родственников, варьировалась от 3 до 20 лет, средняя длительность составила 9,6 ± 6,0 лет, среднее количество этанола в сутки – 182,5 ± 15,5мл (от 100 до 300 мл).
Критерии включения в исследование: женщины в возрасте от 20 до 60 лет, длительно употребляющие алкоголь (в количестве не менее 100 мл этанола в сутки). Критерии исключения: лекарственная и/или наркотическая зависимость, наследственные невро- и миопатии, инфекционные заболевания (в т. ч. сифилис, вирусные гепатиты и ВИЧ-инфекция). В исследуемую группу не включены также пациентки с заболеваниями, которые могут приводить к развитию полиневропатий (сахарный диабет, заболевания щитовидной железы, онкологические заболевания, почечная или печеночная недостаточность, системные заболевания соединительной ткани, заболевания аутоиммунной природы), а также беременные.
Контрольную группу составили 11 здоровых женщин-добровольцев, сопоставимых по возрасту.
Всем пациенткам проведено клиническое неврологическое обследование. Кроме того, были проведены лабораторные исследования, включившие биохимический анализ крови с оценкой уровня билирубина, общего белка, аланинаминотрасферазы, аспартатаминотрасферазы, щелочной фосфазаты, γ-глутамилтранспептидазы, креатинфосфокиназы, глюкозы.
Нейрофизиологическое обследование проведено на 4-канальном миографе фирмы МБН (Россия). Методом стимуляционной электромиографии (ЭМГ) исследовались моторные и сенсорные волокна нервов конечностей. Оценивались скорость распространения возбуждения в дистальных и проксимальных отделах двигательных аксонов срединного, малоберцового, большеберцового и бедренного нервов, скорость распространения возбуждения по сенсорным волокнам икроножного нерва, амплитуды моторных и сенсорных ответов. Методом игольчатой ЭМГ исследовались латеральная головка четырехглавой мышцы бедра и передняя большеберцовая мышца. Проведена оценка параметров потенциалов действия двигательных единиц (ПДДЕ) (средняя длительность, средняя и максимальная амплитуда), наличие спонтанной денервационной активности и количество полифазных ПДДЕ. Результаты игольчатой ЭМГ оценивались путем сравнения с возрастной нормой для исследованных мышц.
С целью коррекции клинических проявлений алкогольной полиневро- и миопатии всем пациенткам давались рекомендации о прекращении употребления алкоголя и нормализации питания. Проведена антиоксидантная терапия препаратами α-липоевой кислоты (α-ЛК) (Эспа-Липон, Эспарма Гмбх, Германия) в дозировке 600 мг/сут в течение 8 недель.
Статистический анализ полученных данных проведен с использованием методов медицинской статистики на персональном компьютере с помощью программы SPSS 17.0. Использованы параметрические (t-критерий Стьюдента) и непараметрические (U-критерий Манна–Уитни) методы статистической обработки. Все статистические сравнения проведены на уровне значимости 95 % (р < 0,05).
Результаты
Основные жалобы пациентов исследуемой группы были на нарушение чувствительности в дистальных отделах ног: 24 (88,9 %) пациентки отметили ощущение онемения, которое сопровождалось чувством «ползания мурашек», покалывания в голенях и стопах различной интенсивности; 10 (37,0 %) женщин предъявляли жалобы на чувство онемения в кистях рук; 9 (33,3 %) обследуемых беспокоили жгучие, стреляющие боли в стопах высокой интенсивности (7–8 баллов по визуально-аналоговой шкале), усиливавшиеся в ночное время; 5 (18,5 %) женщин сообщали также о болях в стопах ноющего характера умеренной интенсивности (до 4–5 баллов по визуально-аналоговой шкале), также усиливавшихся ночью; 18 (66,7 %) пациенток отметили слабость в ногах – преимущественно в мышцах бедер, 12 из них говорили о трудностях при вставании из положения сидя, при подъеме по лестнице.
При клиническом неврологическом обследовании у 25 (92,6 %) пациенток выявлен синдром чувствительных нарушений в виде расстройства чувствительности полиневропатического типа. Преобладали нарушения поверхностной чувствительности в виде болевой и температурной гипестезии. Во всех случаях отмечены вегетативные нарушения в виде гипергидроза ладоней и стоп, «мраморной» окраски кожных покровов. В 18 (66,7 %) случаях имели место нарушения глубокой (вибрационной и мышечно-суставной) чувствительности. У 12 (44,4 %) пациенток чувствительные нарушения сочетались со слабостью в дистальных отделах ног (3–4 балла), преимущественно в разгибателях стоп. У 16 (67,0 %) больных присутствовала слабость мышц бедер в сочетании с их гипотонией и гипотрофией. Коленные рефлексы отсутствовали у 15 (55,5 %), а ахилловы у 24 (88,9 %) пациенток.
Соматическое обследование в 9 (33,3 %) случаях выявило признаки алкогольного поражения печени: у 6 (22,2 %) пациенток диагностирован жировой гепатоз, а у 3 (11,1 %) – алкогольный цирроз печени.
 Оценка показателей биохимического анализа крови выявила незначительное повышение уровня печеночных трансаминаз и увеличение уровня γ-глутамилтранспептидазы в плазме крови в 3 раза и более по сравнению с нормой. Полученные данные свидетельствуют о длительном токсическом воздействии этанола и его метаболитов на функцию печени. Уровень креатинфосфокиназы находился в пределах нормы.
Оценка показателей биохимического анализа крови выявила незначительное повышение уровня печеночных трансаминаз и увеличение уровня γ-глутамилтранспептидазы в плазме крови в 3 раза и более по сравнению с нормой. Полученные данные свидетельствуют о длительном токсическом воздействии этанола и его метаболитов на функцию печени. Уровень креатинфосфокиназы находился в пределах нормы.
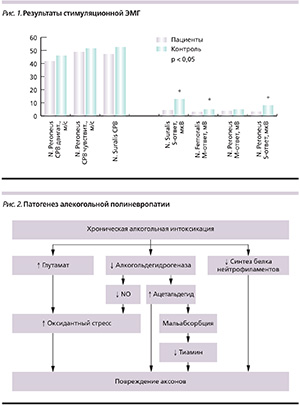
В целом по результатам стимуляционной ЭМГ в группе обследованных отмечено уменьшение амплитуды сенсорных, в меньшей степени – моторных ответов, тенденция к снижению скорости распространения возбуждения по чувствительным и двигательным волокнам нервов ног (рис. 1).
Индивидуальный анализ данных стимуляционной ЭМГ показал, что у 5 (18,5 %) обследованных отмечено снижение амплитуды сенсорного ответа, а у 10 (37,0 %) – сенсорный ответ при стимуляции икроножного нерва отсутствовал. В 9 (37,5 %) случаях эти изменения сочетались со снижением амплитуды моторного ответа малоберцового нерва. У 10 (37,0 %) пациенток с выраженной гипотрофией мышц бедер выявлено снижение амплитуды моторного ответа при стимуляции бедренного нерва при близких к норме показателях дистальной латенции.
Анализ результатов игольчатой ЭМГ мышц бедра и голени во всех случаях показал уменьшение средней длительности в сочетании с увеличением средней и максимальной амплитуды ПДДЕ. Спонтанная денервационная активность была зарегистрирована у 2 (7,4 %) пациенток в виде единичных положительных острых волн и потенциалов фибрилляций.
На фоне проведенной терапии препаратами α-ЛК (Эспа-Липон, Эспарма Гмбх, Германия) субъективно уменьшилось ощущение онемения, «ползания мурашек», покалывания в стопах. При клиническом неврологическом осмотре выявлено уменьшение зоны чувствительных расстройств.
Обсуждение
В проведенном исследовании у 25 (92,6 %) пациенток выявлены клинические проявления алкогольной невропатии в виде расстройств чувствительности различных модальностей полиневропатического типа. Обращает внимание, что признаки полиневропатии имели место чаще, чем по литературным данным, что, вероятно, связано с особенностями контингента обследованных больных, находившихся на стационарном лечении [1].
Анализ жалоб пациенток, данных клинического неврологического обследования показал, что при алкогольной полиневропатии у женщин первично страдают тонкие чувствительные волокна нервов ног. Так, на ранних стадиях алкогольной полиневропатии преобладают жалобы на ощущение онемения, «ползания мурашек», покалывание в стопах, а при клиническом неврологическом обследовании отмечается болевая и температурная гипестезия по типу «носков». О повреждении тонких волокон нервов также свидетельствуют жалобы на жгучие, стреляющие боли в ногах, усиливающиеся в ночное время и нарушающие сон больных. Затем присоединяется слабость в дистальных отделах ног (преимущественно страдают перонеальные группы мышц) и нарушение глубокой чувствительности, указывающие на поражение толстых хорошо миелинизированных волокон нервов ног. Результаты ЭМГ-исследования пациенток с хронической алкогольной интоксикацией подтвердили первично аксональный характер поражения чувствительных, в меньшей степени – двигательных волокон нервов нижних конечностей.
Выявленную у 16 (67,0 %) больных слабость мышц бедер в сочетании с их гипотонией и гипотрофией следует рассматривать как клинические проявления хронической алкогольной миопатии (ХАМ). Нормальные показатели креатинфосфокиназы, отсутствие миопатического паттерна при игольчатой ЭМГ не исключают наличия ХАМ. «Золотым» стандартом диагностики алкогольной миопатии является биопсия скелетной мышцы с последующим морфологическим и морфометрическим исследованиями. Согласно литературным данным, для ХАМ характерно наличие атрофии мышечных волокон, обусловленное нарушением синтеза белков скелетных мышц [2, 3, 8].
Полученные результаты согласуются с ранее проведенными исследованиями, где также установлено, что при хронической алкогольной интоксикации наиболее часто развивается дистальная симметричная сенсорная полиневропатия [1,4]. В то же время проведенное исследование показало прогредиентный характер течения алкогольной полиневропатии у женщин. Полученные результаты указывают, что на ранних стадиях заболевания страдают вегетативные и тонкие сенсорные волокна, проводящие болевую и температурную чувствительность, а при прогрессировании в патологический процесс вовлекаются толстые хорошо миелинизированные проприоцептивные и двигательные волокна нервов ног. На более поздних стадиях поражаются также дистальные отделы нервов верхних конечностей.
В основе патогенеза АПН лежит прямое токсическое воздействие этанола и его метаболитов на органы и ткани, которое может сочетаться с дефицитом нейротропных витаминов группы В, в первую очередь тиамина. Установлено, что АПН с дефицитом тиамина и без такового различаются по клиническим проявлениям [2, 5, 6].
АПН с дефицитом тиамина представляет собой дистальную симметричную полиневропатию с высокой частотой поражения как нижних, так и верхних конечностей. Данная форма АПН развивается на фоне длительного запойного приема алкоголя, дефицита питания, витаминов и сопровождается значительным снижением массы тела в течение нескольких месяцев. Первыми клиническими проявлениями данной формы АПН являются парестезии и/или мышечная слабость в дистальных отделах ног, распространяющиеся в восходящем направлении. Прогрессирование чувствительных и двигательных нарушений может быть как острым, так и хроническим. Возможно доминирование как сенсорных, так и моторных расстройств. У пациентов выявляется выраженное снижение не только болевой и температурной, но и вибрационной, мышечно-суставной чувствительности, что указывает на поражение толстых хорошо миелинизированных быстропроводящих волокон периферических нервов. Болевой синдром при АПН с дефицитом тиамина встречается реже (в 10–20 % случаев), чем при АПН без дефицита тиамина. Характерно раннее снижение или выпадение сухожильных рефлексов. Первоначально мышечная слабость выявляется в разгибателях стоп, по мере прогрессирования заболевания распространяется в проксимальном направлении, приводя к обездвиженности больного. Отмечаются гипотрофии мышц конечностей, возможно развитие контрактур.
АПН без дефицита тиамина представляет собой медленнопрогрессирующую дистальную симметричную сенсорную или сенсорно-моторную полиневропатию с преимущественным поражением нижних конечностей. Эта форма относится к невропатии тонких волокон, для которой характерны следующие клинические проявления: нарушения болевой и температурной чувствительности по полиневропатическому типу, вегетативно-трофические расстройства. Достаточно часто (в 25–45 % случаев) отмечается невропатическая боль, носящая жгучий, стреляющий или ноющий характер. Именно сенсорные нарушения определяют тяжесть состояния больного. Двигательные расстройства в виде слабости в дистальных отделах ног с преимущественным поражением разгибательных групп мышц присоединяются на поздних стадиях заболевания. В целом двигательный дефект при этой форме АПН выражен умеренно и выявляется при функциональных нагрузках. В тяжелых случаях в патологический процесс вовлекаются и верхние конечности. Прогрессирование обычно медленное – от месяцев до нескольких лет.
В основном у обследованных пациенток преобладали клинические проявления, характерные для АПН без дефицита тиамина. Основу патогенеза в этих случаях составляет прямое токсическое воздействие этанола и его метаболитов на аксоны периферических нервов.
Схема патогенеза АПН представлена на рис. 2. Прямое токсическое воздействие этанола на нейроны обусловлено индуцированием глутаматной нейротоксичности, снижением синтеза белка нейрофиламентов и нарушением быстрого аксонального транспорта [7]. В настоящее время обсуждается также роль основного метаболита этанола – ацетальдегида – в повреждении аксонов, нарушении синтеза белков миокарда и скелетных мышц. В норме ацетальдегид быстро превращается в печени в ацетат под действием альдегиддегидрогеназы, и его содержание в крови поддерживается на низком уровне. В случаях хронической алкогольной интоксикации в связи со снижением активности альдегиддегидрогеназы в печени значительно повышается концентрация ацетальдегида в крови. Ряд исследователей предполагают, что этанол и ацетальдегид могут оказывать прямое повреждающее воздействие на периферические нервы, скелетную мускулатуру и миокард, а также усиливать процессы перекисного окисления, приводя к избыточному образованию свободных радикалов и развитию оксидантного стресса [4]. Проведенное в Великобритании клиническое исследование показало снижение содержания альфа-токоферола в крови при хроническом алкоголизме, что свидетельствовало о несостоятельности эндогенной антиоксидантной системы [13].
Современные представления о механизмах развития АПН определяют подходы к лечению. При хронической алкогольной интоксикации основу этиотропной терапии составляет отказ от приема алкоголя в сочетании с полноценным питанием. При наличии полидефицитарного состояния показана заместительная терапия витаминами группы В, препаратами фолиевой кислоты [1, 5]. Поскольку важным звеном патогенеза АПН является оксидантный стресс, представляется целесообразным использование в лечении антиоксидантов, в первую очередь α-ЛК, в частности Эспа-Липона.
В экспериментальных исследованиях Эспа-Липона (Эспарма ГмбХ, Германия) показано, что препараты α-ЛК не только уменьшают проявления оксидантного стресса, но и влияют на увеличение содержания нейротрофических факторов, в т. ч. фактора роста нерва. Кроме того, получены доказательства прямого детоксикационного и гепатопротекторного воздействия α-ЛК при этанол-обусловленной нейротоксичности [2,13]. Препараты α-ЛК действуют на сенсорные и моторные симптомы полиневропатии, а также оказывают умеренный анальгетический эффект [1]. В настоящем исследовании на фоне приема препарата α-ЛК (Эспа-Липон) пациенты отмечали уменьшение выраженности, а в ряде случаев – регресс болевых ощущений, чувства онемения, парестезий в стопах. Исследование неврологического статуса в динамике показало уменьшение зоны чувствительных расстройств.
Таким образом, препараты α-ЛК безопасны и эффективны в качестве лечения АПН. Следует подчеркнуть, что назначать их следует на ранних стадиях заболевания – до развития необратимых структурных повреждений периферических нервов.


