С овременная кардиология – наука, занимающаяся фундаментальным изучением механизмов функционирования сердечнососудистой системы (ССС) в норме и патологии. В своем практическом развитии клиническая кардиология использует достижения в познании молекулярной кинетики биологических процессов на уровне клеточных и субклеточных структур. Это позволяет понимать процессы сопряжения возбуждения–сокращения–расслабления сократительных элементов миоцитов, а также энергетику, обеспечивающую процессы регуляции гемодинамики. В настоящее время без четкого представления о механизмах регуляции тонического состояния сосудов на клеточном и молекулярном уровнях невозможно наметить эффективные методы предупреждения сердечно-сосудистых заболеваний (ССЗ) и решать практические вопросы их лечения.
Метаболический синдром (МС) является комплексом метаболических нарушений и ССЗ, патогенетически взаимосвязанных инсулинорезистентностью (ИР), и включает следующие симптомы:
- нарушение толерантности к глюкозе или СД 2 типа;
- атерогенную дислипидемию (повышение уровней триглицеридов – ТГ, липопротеидов низкой плотности – ЛПНП, снижение уровня липопротеидов высокой плотности – ЛПВП);
- артериальную гипертензию (АГ);
- ИБС;
- висцерально-абдоминальный тип ожирения [1, 2 ,4, 5].
Зарубежные и отечественные исследователи, эксперты ВОЗ характеризуют МС, основной клинический признак которого – абдоминальное ожирение с ИР и атерогенной дислипидемией, как “пандемию ХХI века”. В 2012 г. Международная федерация диабета (МФД) представила эпидемиологические данные о распространенности СД как составной части МС: в 47 странах Европейского региона (в т. ч. в России), в которых проводились исследования, зарегистрированы 52,8 млн пациентов в возрасте от 20 до 79 лет, страдающих СД, что составляет 8,1 % от населения. Согласно прогнозам, этот показатель к 2030 г. увеличится до 9,5 %, что составит 64 млн человек [2, 4, 5, 20].
Эксперты МФД придают большое значение лечению АГ и достижению целевого уровня артериального давления (АД) у пациентов с МС. Основные положения этой проблемы представлены в Международных рекомендациях по лечению АГ Европейского общества кардиологов и Европейского общества по изучению артериальной гипертонии. В настоящее время блокаторы кальциевых каналов (БКК) рассматриваются как одна из основных групп лекарственных средств (ЛС) лечения АГ, эффективность которых была подтверждена результатами завершившихся исследований – ASCOT, ACCOMPLISH, ALLHAT [3, 6, 9, 10, 14–17].
Кальций занимает доминирующее положение в регуляции функционирования ССС. Ионы кальция (Са2+) по биологическому закону “единообразия действия” выполняют ключевую роль при реализации функции различных отделов ССС: контролируют частоту ритма возбуждения пейсмекерных клеток и скорость проведения возбуждения в специализированных клетках сердца, сократительную функцию миоцитов – структурных клеточных единиц ССС. Кинетика Са2+ внутри клетки, механизмы его обмена через каналы с внеклеточной средой и функционирование “кальциевых насосов” контролируются тремя клеточными мембранными системами: сарколеммой, саркоплазматическим ретикулумом (СПР) и митохондриями (рис. 1). Особое внимание заслуживают механизмы входа Са2+ через сарколеммальные потенциал-зависимые и рецепторнооперативные каналы. По упрощенной модели Hodgkin–Huxley, каждый канал в мембране имеет входные и выходные “ворота”, контролирующие открытие и закрытие для прохождения Са2+-тока; их гипотетическая схема представлена на рис. 2. Кальцевый ток имеет большое значение для формирования и поддержания продолжительности потенциала действия, участвует в генерации активности водителя ритма, в стимуляции сокращений миокардиальных и гладкомышечных клеток (ГМК). Суммарно кальциевый ток определяет хронотропный и инотропный эффекты насосной деятельности сердца.

Ионные каналы – белковые образования представлены как “пора” на поверхности клеточной мембраны. Кальциевые каналы высокоселективны для ионов Са2+, содержат на входе отрицательно заряженные участки, которые действуют как “селективный фильтр” для кальциевых катионов. Внутри каналов имеются вольтажчувствительные образования (сенсоры), определяющие открытие и закрытие канала на всем протяжении в зависимости от знака вольтажа (положительный или отрицательный). Отрицательные заряды на наружной и внутренней поверхностях клеточной мембраны обусловливают связывание катионов, формируют трансмембранный потенциал и, модулируя вольтажносенсорный компонент каналов, контролируют величину Са2+-тока.
Поступление избыточного количества Са2+ или нарушение его выведения из клетки сопровождается нарушением специфической функции клетки (проведение, сокращение), что интегрально приводит к дефекту насосной деятельности сердца или подъему АД (рис. 3).

В настоящее время выделяют три типа кальциевых каналов: L-тип – медленные каналы, Т-тип – быстрые каналы, N-тип – обнаруживаются в окончаниях сенсорных нейронов и блокируются кадмием [3, 6–8].
L-кальциевые каналы локализованы преимущественно в кардиомиоцитах и миоцитах сосудистой стенки. В ССС они участвуют в поддержании электрической и механической активности кардиомиоцитов и ГМК сосудов. Это единственный из трех указанных типов кальциевых каналов, который блокируется органическими соединениями: дигидропиридинами, бензотиазепинами, фенилалкиламинами.
Т-кальциевые каналы в основном расположены в проводящей системе сердца и нейронах, практически не блокируются неорганическими блокаторами кальциевых каналов. В последнее время большие надежды возлагаются на новый специфический блокатор Т-кальциевых каналов – мибефрадил.
Кальцевый ток определяет параметры поддержания продолжительности потенциала действия клеток и сокращения, генерации активности водителя ритма, стимуляции инотропного эффекта миоцитов (стимуляция сокращения миокарда и ГМК), а также положительного хронотропного влияния на миокард и генез экстрасистолий. Кальциевый ток в нормальных физиологических условиях изменяется под влиянием нейротрансмиттеров: адреналин его увеличивает (поддерживает каналы в открытом состоянии), ацетилхолин – уменьшает (закрывает каналы).
Кальциевый ток блокируется неорганическими ионами (что не имеет клинического значения) и органическими соединениями, получившими название “антагонисты кальциевых каналов”, которые используют при лечении больных ишемической болезнью сердца, АГ, МС и при профилактике инсультов. Кальциевые каналы обнаружены в миокарде предсердий, желудочков, в проводящей системе сердца, а также в ГМК сосудов, скелетной мускулатуры и клетках внутренних органов.
БКК занимают одно из ведущих мест в клинической практике лечения АГ. БКК на протяжении более 35-летнего периода их применения в терапии ССЗ показали высокую антигипертензивную и профилактическую эффективность в развитии мозговых инсультов. В США один из представителей этого класса – амлодипин – входит в десятку наиболее часто назначаемых ЛС. БКК по своему химическому строению представляют весьма разнообразную группу препаратов ЛС, общими свойствами которых является конкурентный антагонизм в отношении кальциевых каналов. БКК, представляя собой гетерогенную группу органических соединений, по химической структуре подразделяются на дигидропиридиновые БКК (ДПБКК) и недигидропиридиновые БКК (НДПБКК).
ДПБКК специфично связываются с L-типом кальциевых каналов (медленными), в основном расположенных в ГМК сосудов – на уровне артериол. НДПБКК специфично связываются с L-типом кальциевых каналов, расположенных в кардиомицитах, клетках синоатриального и атриовентрикулярного узлов. В настоящее время в клинической практике используются БКК трех поколений.
В 1996 г. T. Toya-Oka и W. Nayler предложили классифицировать БКК на основе фармакокинетических и фармакодинамических биологических эффектов:
- наличие отрицательных хронои интропных эффектов, влияние на длительность атриовентрикулярной проводимости;
- выраженность тканевой селективности (сосуды/сердце);
- влияние на углеводно-липидный метаболизм;
- наличие побочных клинических эффектов (см. таблицу) [19].
По своему химическому строению БКК являются весьма разнообразной группой ЛС, общим свойством которых считается конкурентный антагонизм в отношении кальциевых каналов. Первое поколение БКК – нифедипин, дилтиазем, верапамил, фелодипин – имеют короткий период действия, обладают отрицательным инотропным влиянием на миокард, замедляют атриовентрикулярную проводимость, не обладают или имеют недостаточную тканевую специфичность к сосудистому руслу, что снижает их терапевтическую ценность в клинической практике при лечении АГ.
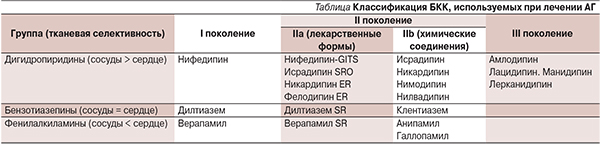
Гетерогенность химических структур БКК первого поколения определяют различия тканевой и сосудистой специфичности, места их антагонистического связывания на кальциевых каналах. Нифедипин относится к дигидропиридиновым БКК и является мощным периферическим артериолярным вазодилататором с рефлекторной стимуляцией симпатической системы (тахикардия); за ним по вазодилатирующему эффекту следуют верапамил – фенилалкиламиновый БКК, и дилтиазем – бензотиазепиновый БКК. Все три препарата оказывают отрицательный инотропный эффект на миокард, по выраженности которого верапамил стоит на первом месте [4, 10, 20].
БКК второго поколения отличаются от препаратов – прототипов первого поколения улучшенными фармакокинетическими свойствами и более высокой вазоселективностью, подразделяются на два подкласса – IIа и IIb. БКК IIа-подкласса оказывают продолжительное (ретардное) действие за счет длительности периода полувыведения и удлинения времени достижения максимальной концентрации в плазме. Ретардные формы ЛС IIаподкласса реже вызывают побочные эффекты, связанные с вазодилатацией, и поэтому лучше переносятся пациентами, БКК IIb-подкласса характеризуются продолжительным действием и более высокой вазоселективностью [4, 7, 10, 11, 19].
Несмотря на улучшенные фармакокинетические и фармакодинамические профили, определяющие длительность действия и вазоселективность, БКК IIа-подкласса в ряде случаев обладают непредсказуемостью клинических эффектов за счет низкой биодоступности (10–40 %), нестабильности концентрации ЛС в плазме крови в период “междозового” интервала и внезапным прекращением биологического действия, что манифестируется отсутствием терапевтического эффекта. Наличие побочных эффектов у БКК первого и второго поколений стало побудительным моментом в генерации новых БКК, лишенных этих отрицательных моментов.
В настоящее время созданы новые БКК третьего поколения с высокой специфичностью в отношении Са2+каналов и тканевой селективностью. Новые препараты превосходят свои прототипы (БКК первого и второго поколений) силой, продолжительностью действия и высокой органотканевой селективностью.
Типичными представителями БКК третьего поколения являются амлодипин, лерканидипин, лацидипин, манидипин, обладающие важными для клинической практики фармакологическими особенностями:
- предсказуемостью клинической эффективности благодаря высокой биодоступности (60– 80 %) и незначительными колебаниями суточной концентрации ЛС в плазме крови;
- высокой тканевой селективностью, что исключает влияние ЛС на сократимость миокарда, функцию синусового узла и атриовентрикулярную проводимость;
- длительностью биологического действия (24–36 часов), что исключает создание ретардных форм ЛС.
В свою очередь БКК третьего поколения различаются по физикохимическим параметрам, что определяет специфичность их фармакодинамических и фармакокинетических эффектов. Так, амлодипин, имея длительный период полужизни (35– 52 часа), сохраняется с высокой концентрацией в плазме крови – “plasma compartment controlled”. Одновременно амлодипин, медленно диффундируя в биослой клеточной мембраны ГМК-артерий, связывается с L-типом кальциевых каналов и ингибирует их функциональную активность, что суммарно определяет длительность гипотензивного эффекта по сравнению с другими БКК [8, 11, 12, 20].
Лерканидипин существенно отличается от амлодипина своими физикохимическими и фармакокинетическими свойствами. Наличие протоновой аминовой группы в химической структуре лерканидипина определяет его выраженную липофильность, что облегчает взаимодействие со структурами сосудистой стенки. Лерканидипин, проникая в липидный биослой клеточных мембран, накапливается в нем в высоких концентрациях (создает “депо”) и ингибирует кальциевые каналы L-типа. Несмотря на короткий период полужизни (от 2 до 5 часов), наличие липофильной “якорной группы” позволяет препарату эффективно связываться с рецепторами сосудистой стенки, формировать концентрационное “депо” и обеспечивать более длительное гипотензивное действие за счет “tissue compartment controlled”. Выраженная липофильность лерканидипина, определяющая его специфическую способность проникать в ткани, оказывает вазодилатацонное действие одновременно на афферентные и эфферентные артериолы почечного клубочка, что способствует снижению внутриклубочкового давления. Нефропротективный эффект лерканидипина выгодно отличает его от других дигидропиридиновых БКК, которые расширяют преимущественно приводящие артериолы почечных клубочков, что ведет к повышению внутриклубочкового давления и развитию нефроангиосклероза [2, 7, 18, 20].
Выраженная тканевая селективность лерканидипина также обеспечивается наличием в его составе двух типов изомеров Rи S-энантиомеров, которые имеют разные уровни аффинности к кальциевым каналам: S-изомер лерканидипина в 100–200 раз активнее, чем R-изомер, блокирует L-тип кальциевого канала. Наличие изомеров определяет более высокую тканевую селективность лерканидипина в сосудистом русле (избирательное действие на ГМК сосудов) и обеспечивают более выраженный гипотензивный эффект по сравнению с амлодипином и лацидипином, у которых аналогичных изомеров нет [7].
Коэффициент преимущественного влияния на ГМК сосудов/кардиомицит – индекс вазоселективности (ИВС) распределен следующим образом: у лерканидипина – 730/1, у лацидипина – 193/1, у амлодипина – 95/1, у нифедипина – 14/1, у дилтиазема – 7/1, у верапамила – 1,4/1.
Лерканидипин является наиболее эффективным и безопасным ЛС при лечении АГ или ИБС у пациентов с систолической дисфункцией левого желудочка (ЛЖ). Благодаря высокой вазоселективности он оказывает минимальное кардиодепрессивное и тахитропное действия.
Наибольшие трудности в подборе антигипертензивных препаратов встречаются при лечении пациентов с АГ, ассоциированной с нарушениями гликемического и липидного профилей крови, являющихся компонентами МС. Актуальность лечения АГ с достижением целевого уровня АД у пациентов с МС отражены в международных и национальных рекомендациях РФ по лечению АГ и МС [3, 4, 7, 12, 20].
Сочетания АГ, ИР и дислипидемии (компонентов МС) у больного повышают требования к медикаментозной терапии, которая, положительно влияя на один из компонентов МС, не должна усиливать проявление другого. Препараты выбора при лечении АГ и МС должны обладать высоким антигипертензивным потенциалом, способностью улучшать метаболизм глюкозы, не повышать ИР тканей, нормализовывать липидный спектр крови, ограничивать влияние на ССС нейрогуморальных факторов [3, 4, 7, 10, 19].
С учетом гемодинамических особенностей АГ при МС, на фоне нарушений углеводного и липидного обменов, основой которых являются ИР с компенсаторной гиперинсулинемией, выбор антигипертензивных препаратов регламентирован следующими положениями:
- пролонгированное действие в течение суток (стабилизация суточного профиля АД со снижением дневного и ночного АД);
- участие в метаболизме углеводов и липидов с положительным или нейтральным эффектами;
- наличие органопротективных качеств;
- возможность достижения регресса при поражении органов-мишеней (уменьшение гипертрофии ЛЖ, нефропротекция, улучшение когнитивной функции).
Всем этим требованиям при лечении АГ как компонента МС в полной мере соответствует дигидропиридиновый БКК – лерканидипин (Занидип®Рекордати, Рекордати Ирландия Лтд.).
Основной областью применения лерканидипина, как и других БКК, является длительное лечение АГ, особенно в сочетании со стабильной стенокардией. Большое клиническое значение при лечении АГ имеют антиишемический, вазо-, нефро-, кардиопротективный, антиатерогенный фармакологические эффекты лерканидипина, подтвержденные в многочисленных клинических исследованиях [10, 12, 20].
Для лерканидипина, как и для других БКК третьего поколения, характерно постепенное проявление антигипертензивного действия. В дозе 10–20 мг/сут он значительно и равномерно снижает АД за счет сосудорасширяющего действия – уменьшения общего периферического сосудистого сопротивления (ОПСС), при этом частота сердечных сокращений и ударный объем ЛЖ практически не изменяются. Отсутствие клинически значимого кардиодепрессивного эффекта выгодно отличает лерканидипин от верапамила и дилтиазема, применение которых противопоказано при фракции выброса ЛЖ менее 40 %, а отсутствие рефлекторной тахикардии – от нифедипина, исрадипина, никардипина, нитрендипина и фелодипина.
По данным нескольких неконтролируемых исследований (более 20 тыс. больных АГ), после 3–6 месяцев лечения лерканидипином 10–20 мг/сут систолическое АД снижалось на 19–26, диастолическое АД – на 13–15 мм рт. ст. [10, 14–17].
Монотерапия лерканидипином в суточной дозе 10–20 мг эффективна в большинстве случаев среди больных АГ 1–2-й степеней. При лечении АГ 3-й степени или резистентной АГ для достижения целевого уровня АД необходимо титрование препарата до 30–40 мг/сут. В отношении пожилых пациентов с изолированной систолической гипертензией лерканидипин был более эффективен, чем лацидипин, в снижении АД и значительно реже вызывал побочные эффекты (отек лодыжек) [10, 13].
Антигипертензивная эффективность лерканидипина значительно усиливается при совместном приеме с β-адреноблокаторами (атенолол), ингибиторами ангиотензинпревращающего фермента – ИАПФ (эналаприл), диуретиками (гидрохлоротиазид). Комбинация лерканидипина с ИАПФ существенно снижает риск развития периферических отеков. Профилактический эффект отечного синдрома обусловлен венулодилатационным эффектом ИАПФ, что предупреждает повышение капиллярного давления, вызванного расширением артериол под влиянием лерканидипина. Аддитивность гипотензивных эффектов лерканидипина и ИАПФ, предотвращение побочных эффектов явились побудительным моментом для создания фиксированной комбинации ЛС – лерканидипин 10 мг + эналаприл 10 мг [10].
В исследовании ELYPSE (Eficacia deLercanidipino y su Perfil de Seguridad) с участием более 9000 больных АГ, сочетающейся с компонентами МС (абдоминальный тип ожирения, нарушение толерантности к глюкозе или СД 2 типа, гиперхолестеринемия), было документировано эффективное снижение АД под действием лерканидипина. Аналогичные результаты были получены в 6-недельном наблюдательном исследовании, включившем 32 345 больных АГ с сопутствующими СД, атерогенной дислипидемией, стенокардией напряжения, сердечной недостаточностью, которые позволили сделать следующий вывод: “ни ожирение, ни курение, ни возраст не ослабляют антигипертензивной эффективности лерканидипина” [2, 4, 7, 10].
При длительном применении лерканидипин оказывает благоприятное влияние на структурно-функциональные изменения в сосудистой стенке при АГ. На фоне лечения лерканидипином происходит уменьшение гипертрофированного мышечного слоя сосудистой стенки с увеличением диаметра резистивных сосудов (артериол) и восстановлением эндотелиальной функции. Восстановление эндотелийзависимой вазодилатации у пациентов с АГ частично обусловлено антиоксидантными эффектами лерканидипина, связанными с нейтрализацией свободных радикалов (снижением активности системного воспаления), что способствует увеличению доступности оксида азота (эндотелийзависимого фактора релаксации). Таким образом, суммарное гипотензивное действие лерканидипина состоит из прямого ингибирующего влияния на кальциевые каналы (L-тип) сосудистой стенки и восстановления функции эндотелия (увеличения синтеза NO и его доступности) в результате антиоксидантных свойств препарата [1, 10, 12].
Вышеперечисленные фармакологические эффекты определяют антиишемическое и профилактическое воздействие лерканидипина на реперфузионные повреждения миокарда. Кардиопротективное действие лерканидипина обусловлено не только снижением ОПСС (постнагрузка для ЛЖ) за счет блокады кальциевых каналов, но и его способностью тормозить оксидативный стресс (системное воспаление) и ослаблять коронаровазоконстрикторное действие эндотелина-1 [7, 10, 12, 20].
Плейотропные эффекты лерканидипина не ограничиваются гемодинамическими эффектами за счет блокады дигидропиридиновых кальциевых каналов. Все больше накапливается данных о наличии у БКК третьего поколения антисклеротических свойств, предположительно не связанных с влиянием на уровень АД. В экспериментальных (культуры эндотелиальных клеток) и клинических исследованиях было показано, что лерканидипин улучшает функцию эндотелия с увеличением образования оксида азота – эндотелийзависимого фактора релаксации, обладает антиоксидантными свойствами, что способствует уменьшению отложения холестерина в стенке сосудов. Антиатерогенное действие препарата объясняется его способностью легко проникать в клеточные мембраны, содержащие массу холестерина, и предотвращать окисление липидов низкой плотности [1, 10, 12].
У больных СД лерканидипин не оказывает неблагоприятного влияния на уровни гликемии, а по данным некоторых длительных (до 3 месяцев) наблюдений, вызывает статистически достоверное снижение постпрандиальной и тощаковой гликемии с нормализацией концентрации гликозилированного гемоглобина, что обусловлено восстановлением чувствительности инсулиновых рецепторов [4, 5, 12, 20].
В последние годы для объективизации оценки длительности и равномерности антигипертензивного действия ЛС используют отношение остаточного (конечного) к наибольшему (пиковому) гипотензивному эффекту (ОЭ/ НЭ), которое для идеального антигипертензивного препарата, по мнению P. Meredith, должно превышать 60 %. По данным плацебо-контролируемых исследований, при применении лерканидипина в дозах 10–20 мг/сут среднее значение ОЭ/НЭ колеблется от 60 до 82 %, в среднем превышая 80 % [10].
Таким образом, обзор результатов многочисленных клинических исследований, посвященных лечению АГ при МС, свидетельствует о высокой антигипертензивной и органопротективной эффективности БКК с метаболической нейтральностью. Дигидропиридиновый блокатор кальциевых каналов третьего поколения – Занидип®-Рекордати (лерканидипин), обладая выраженным антигипертензивным эффектом, одновременно способствует нормализации гликемического и липидного спектров крови больных с признаками метаболического синдрома.
Суммарно – лечение лерканидипином способствует эффективному снижению САД, ДАД, уровня микроальбуминурии (за счет улучшения функции клубочков почечных нефронов), нормализует геометрию ЛЖ и снижает выраженность его гипертрофии, что говорит об органопротективных свойствах лерканидипина. Препарат, благоприятно влияя на уровни гликемии и липидемии натощак, нормализует уровень глюкозы и снижает атерогенность плазмы крови, не оказывает влияния на симпатическую активность, улучшает качество жизни пациента, снижает коронарный риск.



