Введение
В настоящее время считается доказанным, что основным этиологическим фактором злокачественной трансформации эпителия шейки матки (ШМ), которая проходит определенные этапы своего развития – от дисплазии и преинвазивного рака к инвазивному раку, является папилломавирусная инфекция [1–3]. Идентифицировано более 150 типов вируса папилломы человека (ВПЧ), однако только 60 из них тропны к эпителию ШМ [4]. При этом 15 генотипов ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82) сопряжены с высоким риском развития рака ШМ, 3 (26, 53, 66) – с промежуточным и 12 типов
классифицируют как ВПЧ низкого риска (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81, 108) [4]. ВПЧ высокого онкогенного риска (16, 18, 31, 45) обнаруживается в образцах первичных опухолей ШМ с частотой от
60 до 99 % [2, 5–8].
Применение существующих в настоящее время противовирусных вакцин Гардасил и Церварикс позволяет обеспечивать т. н. первичную профилактику рака ШМ, направленную на создание специфического противовирусного иммунитета у привитых детей и молодых женщин, не имевших ранее контакта с ВПЧ. Однако снижение заболеваемости от применения этих вакцин ожидается
лишь в будущем, а в настоящее время оно обеспечивается только вторичной профилактикой, заключающейся в выявлении и лечении ранних неопластических изменений – дисплазии и преинвазивной карциномы (ПИК) ШМ.
Статистические данные свидетельствуют, что с конца 1980-х гг. в экономически развитых странах на фоне общего снижения заболеваемости раком ШМ наблюдается ее увеличение среди женщин 20–34
лет [9–11]. Даже в США, несмотря на достижения цитологического скрининга, смертность от рака ШМ выше среди женщин репродуктивного возраста и входит в число основных причин смерти женщин
этой возрастной группы [11]. Рост заболеваемости раком ШМ связывают с увеличением частоты дисплазии и ПИК ШМ в молодом возрасте в связи с акселерацией, более ранним половым созреванием и
началом половой жизни.
Стандартом лечения дисплазии и ПИК ШМ является хирургическое удаление трансформированного участка ШМ (конизация или эксцизия). Однако такая процедура не всегда приводит к элиминации вируса, поэтому оправданно стремление к разработке комплексного лечения, которое сочетало бы системное и местное воздействия.
С другой стороны, основные факторы, влияющие на процесс злокачественной трансформации эпите-
лия ШМ, связаны с нарушениями со стороны иммунной системы [12–15]. Большинство ВПЧ-инфекций действительно преходящи, регрессируют спонтанно в течение нескольких месяцев, и только не более чем у 1 % инфицированных процесс может прогрессировать до инвазивного рака ШМ [16–19]. Данные исследований свидетельствуют, что в элиминации вируса из организма большую роль играет клеточ-
ный иммунитет [20–23]. При прогрессировании ВПЧ-инфекции наблюдается снижение содержания в крови лимфоцитов, уменьшение иммунорегуляторного индекса, подавление способности лейкоцитов продуцировать лейкоцитарный и иммунный интерфероны, происходят изменения в гуморальных факторах местной защиты [22, 23]. Обсуждается роль субпопуляций Т-лимфоцитов (CD4+ и CD8+) в прогрессировании и регрессе цервикальной интраэпителиальной неоплазии (CIN). Показано, что в
регресс дисплазии вовлечены T-хелперы (CD4+-клетки) [24, 25].
Обнаруженные изменения иммунитета у женщин с дисплазиями и ПИК ШМ подтверждают необходимость применения всего спектра иммуномодуляторов на ранних этапах неопластической
трансформации эпителия ШМ. С этой точки зрения представляется целесообразным изучение эффективности применения противовирусного иммуномодулирующего препарата Неовир (оксодигидроакридинилацетат натрия) в комплексном лечении больных дисплазией и ПИК ШМ.
Неовир оказывает противовирусное действие, в т. ч. в отношении ДНК-геномных вирусов, к которым относится ВПЧ. Препарат активирует стволовые клетки костного мозга, Т-лимфоциты и макрофаги. Воздействуя на лимфоциты, он активирует киллерные клетки, стимулирует выработку лимфоцитами интерферонов α и γ, увеличивает цитотоксическую активность моноцитов, нормализует баланс между субпопуляциями Т-хелперных и Т-супрессорных клеток.
Цель настоящего исследования состояла в оценке эффективности применения препарата Неовир в комплексном лечении больных дисплазией и ПИК ШМ.
Материал и методы
В исследование были включены 20 больных CIN и ПИК (carcinoma in situ) ШМ, наблюдавшихся в ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздрава России в 2012 г., которые были разделены на 2 группы. В первую группу вошли 10 пациенток, подвергшихся комплексному лечению – высокочастотной конизации ШМ с применением иммуномодулирующего противовирусного препарата Неовир, во вторую (контрольную) группу – 10 пациенток, которым выполнялось только аналогичное хирургическое
вмешательство.
Препарат Неовир вводился по 250 мг внутримышечно каждые 48 часов в течение 10 дней. После медикаментозной терапии всем больным исследуемой группы, а больным контрольной группы сразу после окончания клинического обследования выполнялась высокочастотная конизация ШМ с последую-
щим гистологическим исследованием удаленного конуса. После конизации все больные исследуемой группы продолжали медикаментозное лечение еще 5 дней.
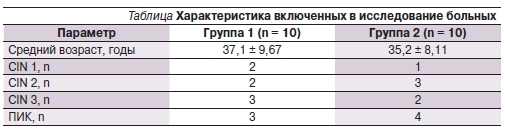
Обе группы больных были сопоставимыми по возрасту и диагнозу. Характеристика пациенток представлена в таблице. Всем больным до и после лечения было выполнено тестирование на ВПЧ. Для выявления и дифференциации ДНК ВПЧ высокого канцерогенного риска – 16-го, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59-го типов – использовали полимеразную цепную реакцию (ПЦР) с типоспецифическими праймерами.
Больным, получавшим иммуномодулирующий противовирусный препарат Неовир, выполнено исследование иммунного статуса до и после лечения. Субпопуляционный состав иммунокомпетентных клеток периферической крови определен методом проточной цитометрии на приборе FACS Calibar в лаборатории отделения химиотерапии и инновационных технологий НИИ онкологии им. Н.Н. Петрова Минздрава России. После лечения больные подвергались мониторингу с применением цитологического исследования и теста на ВПЧ.
Результаты и обсуждение
Применение ВПЧ-теста показало, что преобладающим генотипом ВПЧ среди исследованных больных CIN и преинвазивной карциномой ШМ оказался генотип 16, обнаруженный у 15 из 20 пациенток (в 75 % случаев). При этом у 3 пациенток генотип 16 сочетался с генотипом 18, у 1 – с генотипом 31, у
1 – с генотипом 58 и еще у 1 – с неонкогенным генотипом 11. Среди остальных 4 пациенток были обнаружены: у 2 – только генотип 31, у 1 – только генотип 33 и еще у одной – только генотип 56. На втором месте по частоте встречаемости (по 4 случая) оказались генотипы 18 и 31. При этом ни у одной больной генотип 18 не встречался самостоятельно – только в сочетании: у 1 больной – с генотипами 31 и 59, а у остальных 3 – с генотипом 16. Обнаруженное распределение генотипов ВПЧ между больными CIN и ПИК ШМ совпадает с современными представлениями о распределении генотипов ВПЧ в Северо-Западном регионе России [6].
Исследование иммунного статуса до применения Неовира обнаружило уменьшение иммунорегуляторного индекса за счет снижения абсолютного и относительного содержания CD3+CD4+-Т-хелперов у 2 из 10 больных первой группы (при CIN 3 и ПИК). Иммунограмма периферической крови остальных восьми женщин была в пределах референсных значений. Применение Неовира приводило к выраженным изменениям в иммунном статусе, проявившимся усилением Т-клеточного иммунитета у всех больных. При этом у 8 больных наблюдалось увеличение количества лимфоцитов, абсолютного числа CD3+CD4+-T-хелперов и цитотоксических CD3+CD8+-Т-лимфоцитов, у двух – увеличение абсолютного содержания CD3+CD19-T-лимфоцитов за счет увеличения абсолютного числа цитотоксических CD3+CD8+-T-лимфоцитов, что свидетельствует об увеличении эффекторной функции Т-клеточного иммунного ответа.
Гистологическое исследование удаленного конуса ШМ у всех больных, получавших терапию Неовиром,
обнаружило выраженную местную реакцию в виде скопления лимфоцитов. При этом у двух больных c CIN 1 и CIN 2, получавших Неовир, при гистологическом исследовании был обнаружен полный регресс ранее выявленной дисплазии; проведенный в дальнейшем ВПЧ-тест не обнаружил ДНК ВПЧ.
Мониторинг больных с применением цитологического исследования и ВПЧ-теста после лечения обнаружил рецидив карциномы in situ у одной больной из второй группы, не получавшей Неовир.
ВПЧ-тест этой пациентки после конизации был положительным. ВПЧ-тест после конизации 9 больных первой группы был отрицательным. У одной пациентки, получавшей Неовир, при мониторинге после лечения также был обнаружен положительный ВПЧ-тест, однако рецидива заболевания за период
наблюдения у нее выявлено не было.
Таким образом, применение Неовира приводило к регрессу диспластических изменений эпителия ШМ и предупреждению рецидивов ПИК.
Исследование иммунного статуса больных до и после применения Неовира позволило заключить, что обнаруженный эффект препарата связан с выраженным иммуностимулирующим действием, проявившимся усилением эффекторной функции Т-клеточного иммунного ответа. Это в свою очередь способствует миграции иммунокомпетентных клеток к очагу воспаления, вызываемого инфекционным процессом, и усилению способности цитотоксических клеток распознавать и лизировать аномальные
клетки. Воздействуя на лимфоциты, Неовир также стимулирует выработку лимфоцитами интерферонов α и γ, что обеспечивает возможность блокады вирусной инфекции в очаге поражения.
Обнаруженное влияние препарата Неовир на иммунный статус и морфологию неоплазий позволяет предполагать возможность стабилизации при его использовании неопластической трансформации, происходящей под влиянием персистирующей ВПЧ-инфекции.
Выводы
1. Применение больными дисплазией и ПИК ШМ иммуномодулирующего противовирусного препарата Неовир вызывает усиление эффекторной функции Т-клеточного иммунного ответа.
2. Применение больными дисплазией и ПИК ШМ препарата Неовир вызывает выраженную местную реакцию в виде миграции лимфоцитов в очаг дисплазии.
3. Применение частью больных дисплазией препарата Неовир приводит к регрессу неопластических изменений эпителия.
4. Обнаруженная эффективность препарата Неовир определяет целесообразность дальнейших его исследований на больных с ранними неопластическими изменениями ШМ.



