Введение
Возможности специфического лечения многих инфекций (в первую очередь вирусных) в настоящее время осложнены недостаточностью как средств специфической профилактики, так и фармакологического противовирусного арсенала [1]. В этих условиях большое значение приобретает состояние естественной противоинфекционной защиты организма, которая представляет собой сложный комплекс специфических и неспецифических процессов [2]. При состоятельности этих механизмов обеспечиваются элиминация патогена, разрешение воспалительного процесса и санация организма. Однако не менее трети всех заболеваний сопровождается клиническими признаками иммунной недостаточности, что в свою очередь сопряжено с более тяжелым течением заболевания, склонностью к затяжному течению и хронизации инфекционного процесса, ухудшением прогноза [3]. В этих условиях изучение эффективности иммунотропных лекарственных средств представляет значительный интерес [4–6]. К настоящему времени мета-анализ 35 исследований с привлечением данных более 4000 пациентов 10–19 лет показал, что использование иммуностимуляторов (растительных, бактериальных лизатов, синтетических) с целью профилактики острых инфекций дыхательных путей приводит к значительному (40%) снижению заболеваемости на протяжении последующих 6 месяцев [7].
Несмотря на значительные расхождения трактовки понятия «иммуномодуляторы» (ИМ), в настоящее время его следует трактовать как различные биологически активные вещества или их синтетические аналоги, усиливающие или подавляющие функции иммунной системы. Важно наличие официального разрешения на использование препарата в качестве лекарственного средства, при этом основной терапевтический эффект должен быть обусловлен его иммунотропными свойствами [8].
Современные средства, стимулирующие активность иммунной системы, представлены преимущественно препаратами естественного происхождения (микробные, тимические, костно-мозговые, цитокины) и химически чистыми продуктами направленного синтеза (полиоксидоний, пидотимод, галавит, гепон и др.). Главной мишенью ИМ бактериального происхождения являются клетки врожденного иммунитета, тимических ИМ – Т-лимфоциты и т.д. [7–9].
Анализ фармакодинамических эффектов ИМ различных групп позволяет сделать вывод о том, что вне зависимости от происхождения препарата все они индуцируют множественные и разнообразные иммунологические эффекты, опосредованные неспецифическим действием каскадно продуцируемых цитокинов [9]. Это не позволяет создавать ИМ с селективным механизмом действия, однако и не означает полной эквивалентности действия различных представителей данной группы. Во-первых, запускаемый каскад медиаторов может иметь различия по спектру и объему, что может влиять на реализацию их эффекта; во-вторых, различные вещества могут иметь дополнительные свойства, которые следует учитывать при лечении конкретного больного; в-третьих, комбинация препаратов с синергидным действием может быть целесообразной с точки зрения повышения эффективности и безопасности.
Комбинированный препарат содержит активные вещества, такие как интерферон a-2b (IFN-α-2b), человеческий рекомбинантный – 500 тыс. МЕ, и комплексный иммуноглобулиновый препарат (КИП) – 200 мг; суппозитории вагинальные и ректальные; международное непатентованное наименование – «Иммуноглобулин человека нормальный» [IgG+IgA+IgM]+IFN-ɑ-2b [10].
Роль интерферонов в противовирусной защите
Интерфероны представляют семейство цитокинов, играющих центральную роль в противовирусной защите. Все продуцируемые интерфероны действуют как лиганды для соответствующих клеточных рецепторов, индуцируя транскрипцию сотен интерферон-стимулированных генов, продукты которых обладают противовирусной, антипролиферативной/противоопухолевой и иммуномодулирующей активностью.
В настоящее время семейство интерферонов представлено тремя типами. Первый включает множественные субтипы IFN-a, единственный вариант – IFN-β и малоизученные IFN-δ,-ε,-к,-ζ,-τ, U+03BE и -ω. Второй тип включает единственный вариант – IFN-γ, секретируемый Т-лимфоцитами и естественными киллерами. IFN-λ 1–4 представляет III тип [11].
Экспрессия интерферонов I и III типов осуществляется практически всеми клетками организма в результате распознавания молекулярных вирусных паттернов, таких как нуклеиновые кислоты, цитоплазматическими и эндосомальными рецепторами. В то же время синтез интерферона II типа индуцируется такими цитокинами, как интерлейкин-12 (ИЛ-12), а их экспрессия ограничивается NK-клетками и Т-лимфоцитами [12].
IFN-α относится к интерферонам I типа (IFN-α, -β,- ε,- κ и -ω) и продуцируется преимущественно моноцитами в ответ на вирусную инфекцию. Все интерфероны I типа (α, β, ε, κ, и ω) на клетке-мишени связываются с рецептором для α/β-интерферонов, состоящим из двух цепей (IFN-AR1 и IFN-AR2) [12].
IFN-α индуцирует синтез специфического белка, который останавливает продукцию и репликацию вирусной РНК или ДНК. Действие IFN-α отменяется ИЛ-10, с которым связывается развитие иммунологической толерантности и ослабление иммунного ответа вплоть до отсутствия [12].
Биологическими эффектами IFN-α2 являются усиление экспрессии молекул HLA I и HLA II на поверхности всех типов клеток и, соответственно, улучшение презентации как внутри-, так и внеклеточного антигена (последнее важно, поскольку способствует улучшению и противобактериального иммунитета) и регуляции кооперации клеток, повышение активности естественных киллеров и синтеза ими IFN-γ, а также придание интактным клеткам устойчивости против их цитолитического действия, пролиферации цитотоксических CD8 Т-клеток [10]. Данные свойства IFN-α позволили использовать его в качестве лекарственных препаратов как для системного, так и для локального применения. Препараты IFN-α-2b в суппозиториях, зарегистрированные в России, представлены в табл. 1.
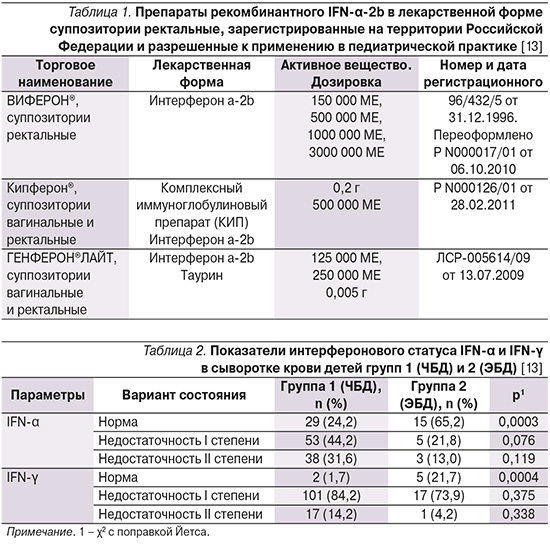
Отдельный вопрос представляет состояние системы интерферонов и его продукции у пациентов с различными патологическими состояниями, в т.ч. инфекциями. В исследовании М.С. Савенковой изучены показатели интерферонового статуса часто и длительно болеющих детей (ЧБД) по сравнению с эпизодически болеющими детьми (ЭБД) [13].
Полученные данные свидетельствуют о нарушениях в системе продукции интерферонов у ЧБД и определяют потребность в корригирующих мероприятиях (табл. 2). Во многих исследованиях, в ходе которых изучалось использование препаратов IFN-α больными данной категории, продемонстрированы их высокая эффективность и безопасность, в т.ч. новорожденных и недоношенных [13–15].
Комбинация IFN-α-2b с комплексом иммуноглобулинов создает условия для расширения как противоинфекционных, так и иммунотропных свойств препарата. КИП содержит иммуноглобулины человека основных классов (IgA, IgM и IgG), выделенные из плазмы или сыворотки крови человека, не содержащие антител к ВИЧ, возбудителям гепатитов В и С, а также HBsAg. Концентрация иммуноглобулинов в препарате соответствует таковому в грудном молоке (IgG – 50%, IgM и IgA – по 15–25%). В КИП представлены антитела к широкому спектру инфекционных возбудителей (герпес-, цитомегало-, ротавирусы, хламидии, стафилококки, энтеробактерии, микоплазмы и другие патогенные микроорганизмы). Механизм действия КИП заключается в специфической нейтрализации инфекционной активности этих возбудителей (сочетание антивирусных, антихламидийных, антибактериальных и антитоксических антител, принадлежащих к различным классам иммуноглобулинов, обеспечивает агглютинацию, нейтрализацию и преципитацию этиотропных патогенных агентов) и непрямом иммуномодулирующем действии, характерном для иммуноглобулинов [10, 16].
Применение комбинированного препарата IFN-α-2b с комплексом иммуноглобулинов в клинической практике
Свойства комбинированного препарата IFN-α-2b с комплексом иммуноглобулинов послужили основанием для изучения возможности его применения при инфекционных заболеваниях различной этиологии. При этом продемонстрирована клинико-иммунологическая эффективность препарата как при лечении острых заболеваний, так и в ходе иммунореабилитационных мероприятий.
По данным нижегородских авторов, 251 ребенок 1–5 лет жизни поступил в стационар с диагнозом «острая кишечная инфекция (ОКИ) неустановленной этиологии» среднетяжелого (77,7%) и тяжелого (22,7%) течений. Стандартную терапию получали 143 ребенка, 108 – в дополнение к ней комбинированный препарат IFN-α-2b с комплексом иммуноглобулинов по 1 суппозиторию 2 раза в сутки на протяжении 5–10 дней со 2-го дня поступления, средний курс лечения составил 7 дней. Длительность нахождения ребенка в стационаре определялась преимущественно сроком нормализации стула. При этом оказалось, что в основной группе он сократился на 3 дня и составил 5,17±0,35 против 8,1±0,4 (p<0,001) в группе сравнения. Продолжительность интоксикации и лихорадки у детей, получавших комбинированный препарат IFN-α-2b с комплексом иммуноглобулинов (суппозитории), составила 1,73±0,26 дня, что было на 2 дня меньше, чем при стандартном лечении (3,79±0,31 дня) (р<0,001), при этом отмечалось более раннее улучшение показателей общего анализа крови у детей 1-й группы. Лечение сопровождалось хорошей переносимостью препарата. Ни в одном из случаев не было отмечено ухудшения или дебюта аллергических заболеваний (при наличии анамнеза), побочных клинических или лабораторных эффектов, связанных с препаратом [17].
А.А. Новокшонов и соавт. сделали вывод о возможности вместо антибиотиков или химиопрепаратов для стартовой терапии ОКИ бактериальной этиологии, а также при тяжелых формах ОКИ вирусной этиологии назначать помимо пробиотиков и энтеросорбентов специфические иммуноглобулины (КИП), препараты иммуномодулирующего и противовирусного действий [18].
Препарат продемонстрировал эффективность и при других видах инфекционной патологии, в т.ч. тяжелой. Так, по данным ставропольских авторов [19], комбинированный препарат IFN-α-2b с комплексом иммуноглобулинов включен в терапевтический комплекс при лечении детей 5–6 лет с инфекционным мононуклеозом средней степени тяжести. Из 93 детей 35 находились на стандартной терапии, 58 дополнительно получали комбинированный препарат IFN-α-2b с комплексом иммуноглобулинов в разрешенной дозировке. Результаты показали, что включение данного иммунотропного препарата по клиническим и иммунологическим критериям (повышение цитотоксической активности NК-клеток, снижение пролиферации вирус-индуцированных лимфоцитов) способствует более благоприятному течению заболевания. При сравнительном исследовании с аналогичной группой из 69 школьников (36 – основная группа, 33 – группа сравнения) оказалось, что наибольшую эффективность препарат демонстрирует именно при лечении дошкольников.
Профилактическая эффективность комбинированного препарата IFN-α-2b с комплексом иммуноглобулинов у ЧБД с патологией носоглотки различной этиологии показана в работе М.К. Керимовой [16]. Проспективное наблюдение детей 1–14 лет, получавших данный препарат в форме свечей в течение года, показало снижение частоты и продолжительности эпизодов заболевания в отсутствие таковых изменений в группе сравнения. Полученные результаты сопровождались повышением числа CD3+-лимфоцитов до нормальных показателей: 42,6±0,8 и 51,3±1,2% до и после лечения соответственно (p<0,05), у практически здоровых детей – 54,0±0,21%, CD4+-лимфоцитов: 20,3±0,7 и 29,6±1,4% до и после лечения соответственно (p<0,05), при 31,0±0,1% у практически здоровых детей. При этом снижалась потребность в цитотоксических CD8+-клетках (соответственно 22,3±1,1 и 21,7±0,6%; p<0,05; у практически здоровых детей – 23,0±1,0%) [16].
Заключение
Таким образом, комбинированный препарат IFN-α-2b с комплексом иммуноглобулинов является иммунотропным препаратом, способствующим повышению эффективности стандартной терапии при лечении острых инфекционных заболеваний различной локализации и этиологии, сокращая сроки лечения и облегчая течение заболевания. Кроме того, при применении препарата в стадии клинической ремиссии у ЧБД он также способствует снижению частоты и продолжительности симптомов. Высокая эффективность и безопасность, продемонстрированные в достаточном числе исследований, делают его применимым и в педиатрической практике.



