Введение
По данным Всемирной организации здравоохранения, заболевания щитовидной железы (ЩЖ) среди эндокринных нарушений занимают 2-е место, уступая лишь патологии сахарного диабета. При этом, согласно данной статистике, прирост числа заболеваний ЩЖ в мире составляет 5% в год [1]. По всему миру эндемическим зобом и другими тироидными заболеваниями страдают более 665 млн человек, а 1,5 млрд сталкиваются с риском развития йододефицитных заболеваний. Ежегодно возрастающая распространенность заболеваний ЩЖ определяет необходимость в формировании четких алгоритмов диагностики, в т.ч. дифференциальной диагностики, и четкой тактики ведения данной патологии. Разработка современных лекарственных средств, применяемых в эндокринологии, а также углубление знаний о фармакокинетике и фармакодинамике уже существующих лекарственных препаратов (ЛП) позволяют практикующим врачам в своей ежедневной деятельности вновь обращаться к основам тиреоидологии и осуществлять подбор тактики фармакотерапии, которая подтвердила свою эффективность и безопасность в многочисленных рандомизированных контролируемых исследованиях [2].
В 2023 г. отечественная эндокринология отметила 120-летие со дня рождения О.В. Николаева – одного из основоположников научно обоснованной системы организационных мероприятий по борьбе с эндемическим зобом в нашей стране. Борьба с эндемическим зобом в СССР благодаря активной позиции профессора О.В. Николаева поставлена на уровень задач государственного значения.
В 1961 г. в монографии, посвященной заболеваниям ЩЖ, О.В. Николаев установил главную и существенную особенность эндемического зоба как заболевания – его связь со специфическими условиями внешней среды [3].
Заболевания ЩЖ зачастую сопровождают пациентов на протяжении всей жизни. Ввиду этого безопасность терапии является одним из ключевых критериев успешности лечения. Говоря о дисфункции ЩЖ, следует отметить, что в настоящее время для лечения заболеваний ЩЖ используется длительная или пожизненная заместительная гормональная терапия, которая сопровождается побочными эффектами в 50–60% случаев, и такие методы, как медикаментозный, лучевой, или хирургическое подавление активности ЩЖ [4]. Вместе с тем следует отметить особенную группу пациентов – беременные женщины. В своей практике как эндокринологи, так и акушеры-гинекологи часто встречаются с различными заболеваниями ЩЖ у данных пациенток, что представляет собой значительный клинический и научный интерес как для изучения патологии этих нарушений, так и в плане их лечения, соблюдая баланс эффективности и безопасности терапии. При этом необходимо учитывать тот факт, что сама беременность часто ведет к возникновению зоба. Увеличение размеров и объема ЩЖ во время нее наблюдается вследствие как более интенсивного кровоснабжения ткани ЩЖ, так и увеличения массы ткани ЩЖ [5]. К настоящему времени накоплен значительный опыт, свидетельствующий о том, что и многие лекарственные средства могут оказывать неблагоприятное воздействие на развивающийся плод и новорожденных. Так, трагедия с талидомидом оказала огромное влияние на отношение к проблеме безопасности лекарств и особенно на применение препаратов во время беременности [6].
Ввиду вышеизложенного актуален комплексный подход к терапии заболеваний ЩЖ, включающий комбинированную терапию синтетическими и растительными ЛП, которые наряду с высокой эффективностью обладают также относительно большей безопасностью по сравнению с препаратами синтетического происхождения. Они имеют меньшее число побочных реакций, более мягкое действие на организм. Также на сегодняшний день фармацевтический рынок Российской Федерации (РФ) демонстрирует тенденцию перехода от химически синтезированных препаратов к ЛП, полученным из растительного сырья [6]. Это наблюдается ввиду того, что при использовании фитотерапевтических лекарственных средств значительно реже возникают неблагоприятные побочные эффекты, а мягкое терапевтическое действие ЛП из лекарственного растительного сырья при длительном применении и постепенное развитие эффекта наиболее актуально для лечения хронических заболеваний. Более того, проведенные рандомизированные клинические исследования, в которых применялись лекарственные растения с тиреостатиками и радиоактивным йодом в отношении пациентов с гипертиреозом, доказали, что применение препаратов из лекарственного растительного сырья в комплексной терапии лечения тиреостатиками и лучевой терапией значительно снижает частоту рецидивов заболевания и позволяет устранять основные симптомы тиреотоксикоза у пациентов [7–9]. Йод является редким элементов на нашей планете, но в большом количестве накапливается морскими водорослями для защиты от вредителей и синтеза гормонов, регулирующих обмен белка. Например, в ламинариях концентрация йода достигает 1%, что обусловливает его высокое содержание в морской воде и ее фауне. У поверхности моря йодиды окисляются до элементарного йода, который с испарениями поднимается в атмосферу и ветром переносится на материки, где выпадает с осадками. Благодаря высокой летучести йода в приморских районах с дыханием в организм может поступать до половины потребности в данном микроэлементе (150 мкг/сут.), а по мере удаления от моря возрастает значимость поступления йода с пищей. Данные обстоятельства обусловливают высокий дефицит йода у населения в центре крупных материков и в высокогорной местности, где морепродукты – большая редкость в рационе. Исследование потребления йода в России показало, что население всех регионов не получает йод в достаточном количестве. Уровень его потребления в различных регионах составляет от 30 до 78 в Архангельске до 50–120 мкг/сут. в Южно-Сахалинске при норме в сутки 150 мкг [10].
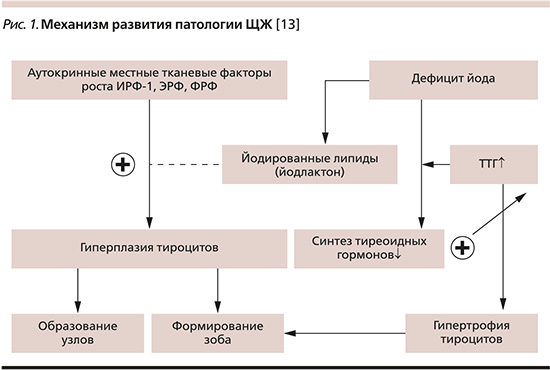
Механизм развития патологии
Проявления заболеваний ЩЖ, связанные с дисфункциями эндокринной системы, в первую очередь зависят от уровня гормонов. Спектр ее патологии самый разнообразный. Это заболевание аутоиммунного генеза, узловые формы, злокачественные опухоли, йододефицитные состояния [11]. В основе механизма развития данной патологии лежит дефицит йода в окружающей среде или дефекты его метаболизма, что приводит к снижению содержания в организме трийодтиронина и тироксина, недостаток которых по принципу обратной связи приводит к увеличению продукции тиреотропного гормона гипофиза (ТТГ). Он активирует деятельность тирецитов: их пролиферацию и синтез тиреоидных гормонов. В результате постоянного недостатка йода происходит стойкая стимуляция гипофиза, что ведет к выбросу ТТГ и его длительному действию на клетки ЩЖ [12]. Дефицит йода также вызывает диспропорцию в аутокринных местных тканевых факторах роста: инсулиноподобном факторе роста 1 (ИРФ-1), эпидермальном факторе роста (ЭФР), факторе роста фибробластов (ФРФ), которые начинают выбрасываться в большем количестве и вызывают гиперплазию тироцитов, которая лежит в основе образования узлов [13]. Таким образом, дефицит йода формирует увеличение объема ЩЖ и дает импульс к образо-ванию узлов. Формируется либо узловой пролиферирующий, либо диффузный эндемический эутиреоидный зоб (рис. 1) [13].
Проходя с кровотоком через ЩЖ, йод захватывается ее клетками и накапливается для последующего синтеза тиреоидных гормонов (тироксин и трийодтиронин) (рис. 2) [14].
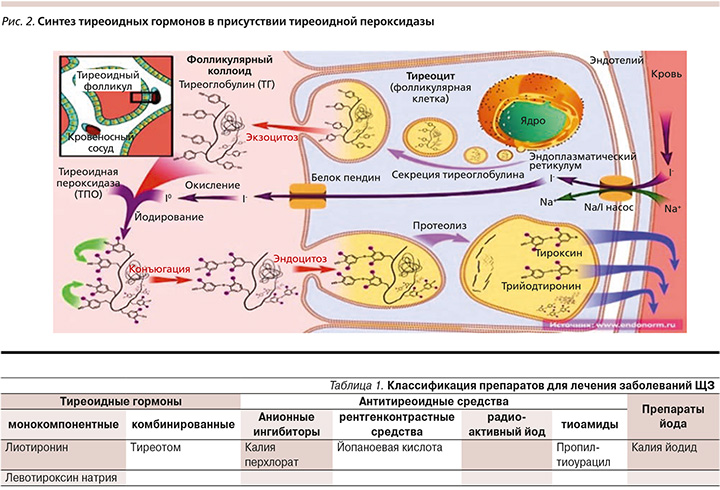
Фармакотерапия заболевании ЩЖ
В идеале результатом лечения какого-либо заболевания является устранение причины самого заболевания. Однако в случае лечения заболеваний ЩЖ это невозможно и проводимая терапия сводится к купированию симптомов заболевания с помощью различных методов, целью которых является нормализация функций ЩЖ. Медикаментозное лечение гипотиреоза проводят путем заместительной терапии – чаще всего препаратами левотироксина натрия [15, 16].
Для лечения заболеваний ЩЖ используют ЛП, которые можно условно разделить на 3 группы (табл. 1) [17].
Тиреоидные гормоны (ТГ) имеют широкий спектр действия на весь человеческий организм. Механизм действия ТГ связан с их способностью стимулировать специфические рецепторы, находящиеся внутри клеток. После входа в цитоплазму тироксин превращается в трийодтиронин. Стимуляция специфических рецепторов приводит к активации транскрипции матричной РНК и, следовательно, к усилению синтеза белка. Трийодтиронин в 3–5 раз активнее тироксина. В механизме действия ТГ выделяют 2 механизма действия: геномный (классический) и негеномный. Классический молекулярный механизм действия ТГ включает захват L-тироксина (Т4) или 3,5,3’-трийодо-L-тиронина (Т3) клетками-мишенями, транспортировку Т3 в клеточное ядро и связывание с ядерными рецепторами ТГ. В рамках геномного механизма действия Т4 рассматриваются как прогормон, который переходит в Т3 под действием тканевой дейодиназы [17, 18].
Негеномное действие ТГ заключается в изменении цитоплазматических сигналов, исходящих от плазматической мембраны, стимуляции внутриклеточного транспорта белков из цитоплазмы в ядро, в действии на митохондрии и изменении активности ионных помп плазматических мембран [17, 19, 20].
К антитиреоидным средствам относятся бетазин, дийодтирозин, йод радиоактивный, мерказолил, метилтиоурацил, перхлорат калия. Антитиреоидными свойствами обладают некоторые природные вещества, в частности содержащиеся в капусте, репе. Действие антитиреоидных средств обусловлено либо угнетением ферментных систем, участвующих в окислении йодидов в йод и в процессах включения йода в молекулу ТГ (метилтиоурацил и мерказолил), либо торможением способности ЩЖ накапливать йод, необходимый для образования гормонов (перхлорат калия) [17].
Лечение тиреотоксикоза проводится несколькими методами, основные преимущества и недостатки которых представлены ниже (табл. 2) [15].

В настоящее время популярность применения в медицинской практике ЛП растительного происхождения (ЛПРП) растет, что обусловлено их низкой токсичностью, высокой эффективностью и экономической доступностью. Сегодня существенную долю как европейского, так и мирового фармацевтического рынка занимают ЛПРП: по разным оценкам, их доля составляет 30–50% [21].
На сегодняшний день в ходе лечения дисфункции ЩЖ используется [16] большое разнообразие лекарственных растений. В табл. 3 представлены лекарственные растения и их характеристики, которые чаще всего применяются для лечения гипо- и гипертиреоза. Кроме представленных лекарственных растений необходимо отметить, что в терапии дисфункций ЩЖ наряду лекарственными растениями, влияющими непосредственно на механизмы развития патологического процесса, необходимо помнить о такой группе лекарственных растений, которые применяются для симптоматического лечения.
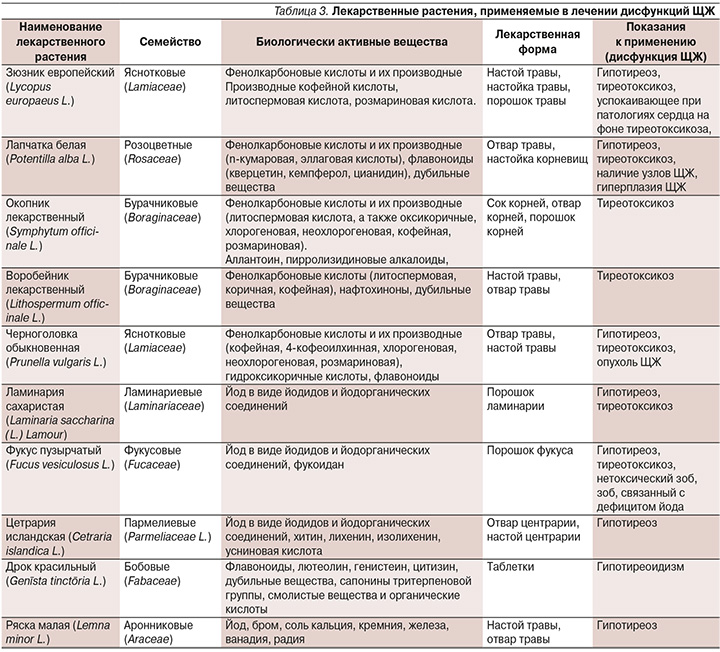
Применение данных лекарственных растений необходимо для устранения таких симптомов, как сердцебиение, дегенеративные изменения в сердечной мышце, расстройства психоэмоциональной сферы, бессонница, нарушения стула, а также расстройства репродуктивной системы (табл. 3) [22–26].
Так, в исследовании В.Н. Кравченко по изучению влияния лекарственных растений на функцию ЩЖ стандартным методом «зобная реакция» у крыс продемонстрировали перспективные результаты (табл. 4) [21, 27].
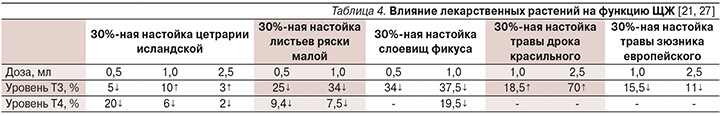
Таким образом, проведенные скрининговые исследования позволили установить влияние всех изучаемых объектов на синтетическую функцию ЩЖ разной степени и разной направленности: как тиреостатическое (30%-ная настойка слоевищ цетрарии исландской, 30%-нач настойка листьев ряски малой и 30%-ная настойка травы зюзника европейского), так и тиреостимулирующее (30%-ная настойка слоевищ фукуса и 30%-ная настойка травы дрока красильного).
Полученные разнонаправленные эффекты от одного того же изучаемого растения, например от 30%-ной настойки травы зюзника европейского, возможно объяснить разными механизмами действия, в частности угнетением процессов конверсии Т3, в Т4, возможным гипоталамо-гипофизарным влиянием, особенностями химического состава и др.
Для установления механизмов тирео-тропных свойств исследуемых растений необходимо проведение углубленных исследований, в т.ч. на экспериментальных моделях гипо- и гипертиреоза [21, 27].
Также следует отметить, что лекарственные растения наряду со свойствами, влияющими на ЩЖ, оказывают положительное влияние и на другие функции. Так, в исследованиях М.В. Боровковой изученные экстракты лапчатки белой и зюзника европейского, нормализирующие функцию ЩЖ, оказывали стимулирующее действие на иммунную систему экспериментальных животных, что является дополнительным положительным эффектом при их применении пациентами с патологией ЩЖ, имеющими сниженный иммунитет [28]. В многочисленных исследованиях также установлено, что комплексное лечение тиреотоксикоза ЛП из лекарственного растительного сырья (ЛРС) и его производных с тиреотатическими ЛП, а также лучевой терапией приводит к снижению числа рецидивов заболевания и практически полному исчезновению симптомов гипертиреоза [29].
Наряду с этим в последние годы вопросы преодоления дефицита йода вновь получили широкий общественный резонанс и мощное развитие в Российской Федерации на государственном уровне. Следует отметить бурые водоросли – ценный источник йода в натуральном виде, из которых можно получить препараты с его содержанием, в несколько раз превышающим количество йода даже в самой водоросли. Благодаря высокой концентрации йода, железа, кальция, магния, калия, серы и других веществ, бурые водоросли улучшают процесс обмена веществ и восстанавливают защитные силы организма (при ослаблении иммунной системы). Кроме того, они способствуют обеспечению нормального функционирования ЩЖ, но, к сожалению, они не содержат селена, необходимого для создания активной формы тиреогормона трийодтиронина [30].
Представляют интерес также результаты применения биологически активных добавок (БАДов) растительного происхождения при тиреопатологиях. Однако применение ЛПРП, содержащих смеси трав, не всегда дает ожидаемый клинический эффект, что может быть связано с антагонизмом составляющих веществ, их низкой концентрацией или другими причинами [21].
Вместе с тем в народной медицине часто используются различные лекарственные растения, такие как водоросли бурые, красные, ламинария сахаристая, аконит байкальский, дрок красильный, ковыль перистый, медуница лекарственная, мох исландский, фейхоа, фукус бородавчатый, лапчатка белая и другие как для профилактики, так и лечения заболеваний ЩЖ [31].
Заключение
Дисфункция ЩЖ является одной из самых распространенных патологии эндокринной системы, причиной возникновения и распространения которой служат в основном геномные нарушения и экологические факторы. Актуальным решением проблемы терапии заболеваний ЩЖ является сочетанное применение ЛП, получаемых из ЛРС, и стандартного метода лечения (заместительной гормональной терапии, терапии изотопом йода).



