Введение
Мочекаменная болезнь (МКБ) – это хроническое многофакторное заболевание с высокими рисками генетического наследования, распространенностью в общей популяции и склонностью к рецидивам. По данным Н. Гаджиева et al., в 2005 и 2019 гг. зарегистрировано 656 911 и 889 891 случай МКБ соответственно, прирост распространенности за исследуемый период составил 35,4%, при этом темпы роста были достаточно равномерными. Заболеваемость МКБ в Российской Федерации в 2005 г. составила 176 773, тогда как в 2019 г. зарегистрировано 205 414 новых случаев уролитиаза с отчетливой тенденцией к росту, при этом прирост за исследуемый период составил 16,2% [1]. В материковой части Китайской Народной Республики, согласно проведенному исследованию W. Wang et al., распространенность в возрастных группах 1991–2000, 2001–2010 и 2011 гг. до настоящего времени составляла 5,95%, 8,86 и 10,63% соответственно [2]. Примерно 10,6% мужского и 7,1% женского населения США страдают от этого заболевания [3]. Манифестирование МКБ приходится на возраст от 25 до 40 и после 50–55 лет, причем тенденция к увеличению заболеваемости более выражена у женщин [4].
Об актуальности проблемы помимо стремительного роста заболеваемости свидетельствует зависимость образования камней от пищевых привычек пациентов. J.B. Ziemba et al. определили связь между увеличенным потреблением кальция с пищей и уменьшением приема жидкости с повышением риска возникновения нефролитиаза как у мужчин, так и у женщин [5]. По данным P.M. Ferraro et al., такие модифицируемые факторы риска, как индекс массы тела, потребление жидкости, диета DASH (для похудения и снижения артериального давления) и потребление кальция, обусловливают увеличение риска возникновения МКБ на 50% [6], а в своем исследовании, включившем 194 095 участников, и медианой наблюдения более 8 лет P.M. Ferraro et al. выявили более высокий риск появления камней в почках при употреблении подслащенных сахаром напитков [7]. Результат проспективного когортного исследования показал, что прием антимикробных препаратов в течение более чем 2 месяцев в возрасте 40–59 лет увеличивает риск возникновения МКБ в более старшей возрастной группе [8]. По данным, представленным K.L. Penniston et al., установлено, что пациенты с МКБ вне зависимости от симптомов имеют более низкое качество жизни [9].
Соли оксалата кальция являются наиболее распространенным субстратом для формирования камней при МКБ, на который приходится 75% всех фенотипов камней в почках. Патогенный путь образования камней из оксалата кальция включает несколько процессов (см. рисунок) [10].
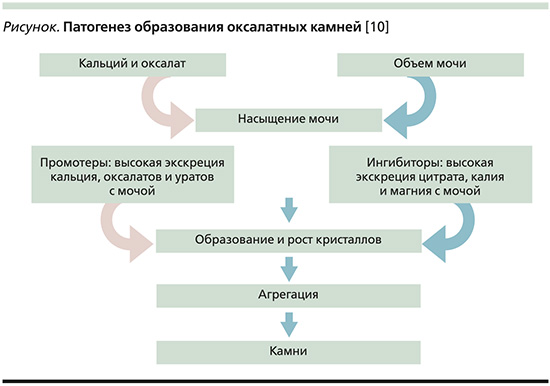
Частота рецидивов оксалатного нефролитиаза достигает 50% в течение первых 5 лет после первого эпизода камнеобразования [11]. Чаще всего (в 80% случаев) конкременты состоят из оксалата кальция или фосфата кальция, реже – из уратов (мочевой кислоты) или могут быть смешанного состава (мочевая кислота+оксалат кальция/фосфат <80%).
Недавние исследования установили различия кишечной микробиоты (КМ) пациентов, страдающих МКБ, и здоровых людей [12]. Также выявлено, что Bifidobacterium lactis снижает содержание оксалатов в моче за счет деградации пищевых оксалатов и снижения их всасывания в кишечнике [13], а Oxalobacter formigenes является представителем КМ, бактерии, разрушающей оксалаты в желудочно-кишечном тракте (ЖКТ), способствующей гомео-стазу щавелевой кислоты и как следствие – снижению экскреции оксалатов с мочой [11].
Исходя из данных, приведенных выше, очевидно, что КМ влияет на образование камней в почках. Коррекция кишечного дисбиоза может способствовать улучшению результатов лечения и метафилактики МКБ. В рамках данной обзорной статьи будут рассмотрены состояние КМ при МКБ, взаимосвязь применения антимикробных препаратов и оксалобиома кишечника, а также влияние трансплантации фекальной микробиоты на риск развития уролитиаза.
O. formigenes и его роль в метаболизме оксалатов в кишечнике
Образование камней в почках в значительной степени коррелирует с функцией ЖКТ, поскольку концентрация в моче двух основных пролитогенных факторов – кальция и оксалата, во многом зависит от степени их всасывания в кишечнике [14]. Таким образом, микробиота играет определенную роль в метаболизме этих веществ в просвете кишечника и, следовательно, может влиять на их всасывание [15]. Проведенные исследования определили, что микробы расщепляют соединения оксалата в фекалиях человека, хотя мало что известно о природе микроорганизмов, ответственных за такую активность. Оксалат представляет собой соединение, содержащееся в растениях, употребляемых в пищу (например, ревень, шпинат и свекла) [16].
Исследования 1940-х и 1950-х гг. показали, что соединения оксалата расщепляются микробами в фекалиях человека и желудке жвачных животных. В 1980 г. группа американских микробиологов под руководством М. Эллисона выделила из материала, полученного из рубца некоторых млекопитающих, штамм бактерий, который характеризовался выраженной метаболической активностью по разложению оксалатов. Впоследствии эта бактерия была выделена из кишечника других млекопитающих, включая домашнюю морскую свинку (Cavia porcellus). Результаты этих исследований позволили разработать методы культивирования бактериального штамма, который впоследствии был классифицирован таксономически как новый вид, названный O. formigenes в связи с его метаболической активностью [17]. В дальнейшем биологические и метаболические характеристики этого вида были изучены с помощью более совершенных методов.
O. formigenes – грамотрицательная облигатная анаэробная бактерия, которая получает энергию в результате ферментации оксалата. Ферментами, участвующими в этом процессе, являются оксалил-КоА декарбоксилаза и формил-КоА трансфераза, гены которых высоко экспрессируются Oxalobacter, что делает бактерию наиболее эффективной биологической системой деградации оксалата [18]. Анализ генома Oxalobacter позволил выделить 2 различных штамма (группа 1 и группа 2), метаболические различия которых до конца не изучены [19].
Медицинский интерес к O. for-migenes возрос после его выделения из образцов фекалий человека с помощью культуральных методов. В обзорном клиническом исследовании B.K. Canales et al. определили, что бактериальная нагрузка Oxalobacter была значительно ниже в группе пациентов, перенесших бариатрическую операцию (гастрошунтирование) и, следовательно, более предрасположенных к развитию гипероксалурии [20]. Это наблюдение привело к предположению, согласно которому данная бактерия участвует в патофизиологическом процессе камнеобразования из оксалата кальция. Еще в конце 1980-х гг. R.A. Argenzio et al. продемонстрировали обратно пропорциональную связь между кишечным всасыванием оксалата у домашних животных с бактериальной нагрузкой O. formigenes [21]. Oxalobacter является неотъемлемой частью КМ человека, но присутствует в небольших количествах и, следовательно, является «второстепенным фактором» в такой сложной экосистеме. Таким образом, его выделение с помощью классических микробиологических методов затруднительно [22]. В 1985 г. группа американских микробиологов разработала метод идентификации и количественного определения Oxalobacter в образцах фекалий человека с помощью полимеразной цепной реакции (ПЦР) гена oxc (oxalyl-CoA decarboxylase) [23]. Этот видоспецифичный метод вызвал новый импульс в исследованиях Oxalobacter и возобновил интерес медицинского сообщества, особенно в связи с его потенциальным значением для лечения и метафилактики МКБ. Важным фактором расщепления оксалатов в кишечнике является не только непосредственное наличие данной бактерии, но и ее количество. В 2021 г. O.F. Golam et al. определили, что присутствие O. formigenes может ингибировать образование оксалата кальция в почках, а также подтвердили преимущество молекулярных методов при выделении O. formigenes [24]. Присутствие O. formigenes не является постоянным в КМ человека и варьируется, по различным оценкам, от 30 до 70% у взрослых. Однако в тех случаях, когда Oxalobacter присутствует, он имеет тенденцию сохраняться в течение долгого времени. Факторы, влияющие на колонизацию кишечника этой бактерией, пока не известны [25].
H. Sidhu et al. в клиническом исследовании 145 пациентов, у которых подтверждено наличие идиопатических оксалатных камней, продемонстрировали обратную корреляцию между уровнем колонизации O. formigenes в кишечнике и числом эпизодов почечной колики. В группе пациентов, колонизированных O. formigenes, экскреция оксалата с мочой оказалась выше [26]. D.W. Kaufman et al. провели исследование зависимости уровня O. formigenes и риска камнеобразования. В данном исследовании принимали участие 247 пациентов с оксалатными камнями и 259 без уролитиаза. Согласно полученным результатам, распространенность колонизации O. formigenes оказалась выше в контрольной группе (38 против 17%). Также выявлено, что колонизация оксалобактериями снижает риск камнеобразования на 70% [27]. R. Siener et al. в 2013 г. оценили роль O. formigenes в метаболизме оксалатов, определив его кишечную абсорбцию, концентрацию в плазме крови и выведение с мочой при соблюдении специальной диеты. В исследовании приняли участие 37 пациентов, среди которых 26 мужчин и 11 женщин в возрасте от 19 до 77 лет. R. Siener et al. показали, что колонизация КМ O. formigenes не влияет на всасывание оксалатов в кишечнике. При этом концентрация оксалатов в плазме была значительно выше у пациентов без O. formigenes в КМ (в соотношении 5,79 к 1,70 мкмоль/л). У пациентов с колонизацией КМ O. formigenes число эпизодов камнеобразования оказалось ниже [28]. Однако в июле 2023 г. M. Liu et al. в своем исследовании причинно-следственной связи камнеобразования в почках и КМ выявили, что связь между КМ и камнями в почках зависит только от присутствия рода Oxalobacter/O. Formigenes: Oxalobacter (отношение шансов [ОШ]=0,99, 95% доверительный интервал [ДИ]: 0,90–1,09; p=0,811) и образованием камней в почках. Отряд Actinomycetales (ОШ=0,79; 95% ДИ: 0,65–0,96; р=0,020), семейство Actinomycetaceae (ОШ=0,79; 95% ДИ: 0,65–0,96; р=0,019), семейство Clostridiaceae 1 (ОШ=0,80; 95% ДИ: 0,67–0,96; p=0,015), род Clostridium sensu stricto 1 (ОШ=0,81; 95% ДИ: 0,67–0,98; p=0,030) и род Hungatella (ОШ=0,86; 95% ДИ: 0,74–0,99; p=0,040) оказывали защитное действие на камни в почках, а род Haemophilus (ОШ=1,16; 95% ДИ: 1,01–1,33; p=0,032), род Ruminococcaceae (UCG010) (ОШ=1,38; 95% ДИ: 1,04–1,84; p=0,028), род Subdoligranulum (ОШ=1,27; 95% ДИ: 1,06–1,52; p=0,009)) являлись факторами риска развития уролитиаза. Для лучшего понимания патогенеза камнеобразования в почках в контексте сложных взаимодействий генов и окружающей среды с течением времени необходимы дальнейшие исследования [29].
Оксалобиом и антибактериальная терапия
Существует такая гипотеза: антимикробная терапия может способствовать исчезновению Oxalobacter из КМ у ранее колонизированных этой бактерией людей [14]. В своем исследовании о взаимосвязи O. formigenes как фактора, снижающего риск камнеобразования у пациентов, принимающих пероральные антибиотики, Y. Ravikumar et al. установили, что бактерия значительно уязвима к некоторым антибиотикам и обусловливает повышение риска камнеобразования у пациентов, применяющих антимикробные препараты [30]. Например, V. Kharlamb et al. в обсервационном проспективном контролируемом исследовании выявили, что при применении таких антимикробных препаратов, как амоксициллин и кларитромицин, во время эрадикационной терапии Helicobacter pylori снижается колонизация O. formigenes [31].
Употребление продуктов с высоким содержанием оксалатов обычно увеличивает численность Oxalobacter в КМ, т.к. рост этих бактерий зависит от наличия энергетического субстрата. С другой стороны, присутствие Oxalobacter в микробиоте способно уменьшить фракционное поглощение оксалата, поступившего в организм с пищей. Поэтому потенциально эта бактерия является очень важным фактором в регуляции метаболизма оксалатов в организме и патофизиологии гипероксалурии. В свою очередь в 2019 г. в ходе исследования A. PeBenito и L. Nazzal выявлено значительное влияние антимикробных препаратов на колонизацию O. formigenes, а также на уровень электролитов в моче, тем самым показано, что общая структура КМ различалась в зависимости от присутствия данной бактерии [32].
J. Lange et al. провели клиническое исследования чувствительности штаммов O. formigenes, выявленных в КМ человека, к наиболее часто назначаемым антимикробным препаратам. Согласно полученным результатам, все штаммы были чувствительными к азитромицину, ципрофлоксацину, кларитромицину, клиндамицину, доксициклину, гентамицину, левофлоксацину, метронидазолу и тетрациклину [33]. В проспективном исследовании «случай–контроль» изучали влияние антимикробных препаратов (в частности, фторхинолонов и цефалоспоринов) на колонизацию микробиоты кишечника Oxalobacter. Результаты исследования показали, что применение антимикробных препаратов может способствовать возникновению резистентности оксалотрофных бактерий в МК [30]. По данным S. Joshi et al., выявлено, что разрушению оксалатов в кишечнике способствует O. formigenes, а его присутствие связано с более низким содержанием оксалата в моче, что создает защиту от оксалатного камнеобразования [34].
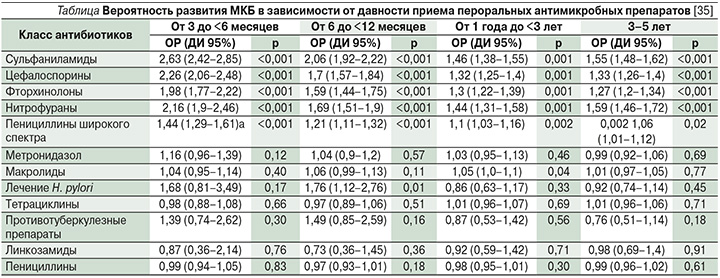
В свою очередь в Великобритании G.E. Tasian et al., проанализировав базу данных Сети улучшения здоровья (THIN), в которой среди лиц, страдавших нефролитиазом, был 25 981 пациент и в контрольной группе – 259 797, показали, что применение антимикробных препаратов увеличивает вероятность развития МКБ. В ходе исследования были оценены 12 классов пероральных антибиотиков и их взаимосвязь с возможностью обусловливать камнеобразование. Применение любого из пяти различных классов антимикробных препаратов (сульфаниламиды, цефалоспорины, фторхинолоны, нитрофурантоин и пенициллины широкого спектра действия) за 3–12 месяцев до диагностики нефролитиаза было связано с камнеобразованием. При этом риск возникновения МКБ был наибольшим у пациентов молодого возраста, а также у принимавших антимикробные препараты за 3–6 месяцев до того, как им был поставлен данный диагноз [35].
Вероятность развития уролитиаза в зависимости от давности применения антимикробных препаратов по результатам этого исследования демонстрирует таблица.
В 2021 г. L. Nazal et al. в своем исследовании более 3000 образцов, полученных от 1000 добровольцев, выявили, что у пациентов с воспалительными заболеваниями кишечника (ВЗК) чаще обнаруживают нарушения гомеостаза оксалатов и как следствие – МКБ (чаще – оксалатный нефролитиаз). Показано, что уровень оксалата в кишечнике повышен у пациентов с ВЗК, причем самые высокие уровни наблюдались у пациентов с болезнью Крона с поражением как подвздошной, так и толстой кишки [36]. Поскольку полностью отказаться от антимикробной терапии в настоящее время не представляется возможным, применение данных препаратов должно быть обоснованным, а также сопровождаться увеличением объема потребляемой жидкости, соблюдением диеты с низким содержанием оксалатов или назначением пробиотика после ее применения [37].
Особый интерес к применению O. formigenes при терапии и метафилактике МКБ обусловлен недостаточным количеством препаратов, способных воздействовать на регуляцию оксалатного метаболизма и, следовательно, – отсутствием альтернативы гипоксалурической диете.
В исследовании на крысах вида Sprague-Dawley, которым искусственно вызывали состояние тяжелой гипероксалурии посредством добавления в пищу оксалата аммония, выявлено, что лечение пробиотиком, содержащим O. formigenes, уменьшает концентрации оксалатов в моче через 2 дня после начала приема пробиотика. При этом пробиотик продемонстрировал хорошую переносимость и безопасность [38].
После однократного перорального приема того же пробиотика взрослыми добровольцами отмечались снижение оксалурии, восстановление активности разложения оксалатов в кале и длительное сохранение колонизации O. formigenes [39]. Применение пробиотика O. formigenes нашло свое место в педиатрической практике. Препарат показал свою эффективность при лечении первичной гипероксалурии – генетического заболевания, характеризующегося дефектом почек при метаболизме оксалатов и приводящего к тяжелой форме вторичного кальциноза и нефропатии в детском возрасте.
Однако в результате рандомизированного двойного слепого плацебо-контролируемого многоцентрового исследования детей с подтвержденным диагнозом первичной гипероксалурии пероральный прием препарата O. formigenes (Oxabact®) существенного влияния на оксалурию не оказал [40]. A. Jairath et al. в исследовании эффективности применения пробиотика Oxalobacter пациентами с камнями в почках (преимущественно оксалат кальция) выявили тенденцию к снижению частоты гипероксалурии (82,5 против 15%; p<0,0001) [41]. Результаты недавнего плацебо-контролируемого рандомизированного клинического исследования показали, что контролируемая диета с ограниченным потреблением продуктов, содержащих оксалаты, снижает их экскрецию с мочой. При этом пробиотик Oxadrop и синбиотик Agri-King не влияли на уровень оксалатов в моче пациентов, соблюдавших данную диету. [42]. В то же время результаты исследования J. Okombo et al. выявили связь между приемом пробиотика VSL#3® здоровыми пациентами в течение 4 недель и снижением абсорбции соединений оксалатов в ЖКТ, что в свою очередь может замедлять процесс камнеобразования в почках [43].
Также интерес научного сообщества вызывает применение других пробиотических препаратов, обладающих, по крайней мере теоретически, оксалат-деградирующей активностью. Действительно, in vitro установлено, что некоторые бактерии родов Bifidobacterium, Lactobacillus (в частности, Lactobacillus animalis, Lactobacillus murinus, Lactobacillus acidophilus, Lactobacillus brevis, Lactobacillus plantarum) обладают оксалат-деградирующей активностью. Так, например, С. Campieri et al. в своем клиническом исследовании пациентов с идиопатическим кальций-оксалатным уролитиазом и гипероксалурией, принимавших смесь лиофилизированных молочнокислых бактерий (L. acidophilus, L. plantarum, L. brevis., Streptococcus thermophilus, Bifidobacterium infantis) в течение 4 недель показали, что в результате у всех пациентов отмечено выраженное снижение суточной экскреции оксалатов с мочой [44]. Помимо этого результаты других исследований могут быть основанием для предположения, что одним из важных направлений в лечении нефролитиаза будет не применение пробиотиков с оксалат-деградирующей активностью, а использование препаратов, содержащих фермент оксалил-КоА-декарбоксилазу, уменьшающих не только всасывание оксалатов в кишечнике, но и размеры существующих камней [45].
Трансплантация фекальной микробиоты при оксалатном нефролитиазе
Трансплантацией фекальной микробиоты (ТФМ) называется метод переноса МК от здорового донора пероральным или ректальным путем. В настоящее время проводится изучение эффективности и безопасности ТФМ при лечении и профилактике МКБ. Так, например, в 2016 г. J.M. Stern et al. опубликовали результат исследования трансплантации фекальной микробиоты на крысах. Выявлено, что уровень кальция в моче после трансплантации кала снизился на 55% (р<0,001), а всасывание щелочи в ЖКТ увеличилось на 29% (р<0,001) [46]. По данным другого клинического исследования, проведенного на лабораторных крысах рода Rattus norvegicus, доказано, что трансплантация микробиоты является эффективным методом постоянной колонизации бактерий, разлагающих оксалат, в кишечнике млекопитающих [47]. В 2023 г. Y. Wang et al. провели исследование корреляции увеличения численности бактерий семейства Muribaculaceae, достигаемое при ТФМ, с ингибированием отложения оксалатных камней на самцах морских свинок и лабораторных крыс Sprague-Dawley. В результате содержание оксалатов кальция, мочевой кислоты, креатинина и мочевины в образцах мочи значительно снизилось. Аналогичным образом наблюдалось значительное снижение соотношения мочевой кислоты и азота мочевины крови к креатинину в образцах сыворотки (p<0,05) [48].
Таким образом, МК играет роль в изменении абсорбции пролитогенных веществ в ЖКТ, тем самым влияя на риск образования камней в почках. Можно сделать вывод: дальнейшее исследование состояния КМ при МКБ будет содействовать разработке новых методик ее коррекции, а значит, улучшению результатов не только лечения, но и метафилактики уролитиаза.
Заключение
МК является сложной, метаболически активной экосистемой, состав которой зависит от множества факторов, как внутренних, так и внешних. Результаты клинических исследований, продемонстрированные в статье, показывают различные нарушения состояния КМ при оксалатном нефролитиазе. Одновременно с этим подтверждается гипотеза о ведущей роли O. formigenes в метаболизме соединений оксалатов в кишечнике при МКБ. Данные, имеющиеся в настоящее время, позволяют предполагать, что терапевтическая коррекция КМ актуальна и может приводить к расширению границ современных представлений о лечении и метафилактике уролитиаза.
Вклад авторов. Н.В. Стуров, С.В. Попов – концепция и методология исследования, редактирование. З.А. Иванов – сбор и обработка материала, статистическая обработка данных. Н.В. Стуров, С.В. Попов, З.А. Иванов – написание текста.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Состояние микробиоты кишечника и ее коррекция у пациентов с мочекаменной болезнью».



