Введение
Проблема антибиотикорезистентности (АР) приобретает особое значение во всем мире, входит в десятку основных глобальных проблем общественного здравоохранения [1–3]. На сайте Всемирной организации здравоохранения ежегодно публикуются отчеты GLASS (Global Antimicrobial Resistance and Use Surveillance System). В развитых странах мира АР рассматривается как угроза национальной безопасности. В России эта проблема не менее значима, что подтверждает выход в свет Методических рекомендаций «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов» в 2022 г. [4]. Мониторинг АР ведется как в глобальных, так и в национальных системах. Так, на сайте Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) представлены исследования, проводимые в настоящее время (ДАРМИС, ПеГАС, DeMaRes, МАРАФОН), цель которых – оценить АР возбудителей внебольничных и нозокомиальных инфекций в России. Постоянно обновляется информация AMRmap – онлайн-платформы анализа данных резистентности к антимикробным препаратам, позволяющая сравнивать и отслеживать динамику в отдельных регионах. К сожалению, ситуацию не во всех регионах можно адекватно оценить при помощи данных ресурсов, что обусловлено отсутствием у ряда стационаров собственных микробиологических лабораторий, невозможностью по этой причине сотрудничества с НИИ антимикробной химиотерапии Смоленской государственной медицинской академии. В подобных случаях особое значение приобретает локальный микробиологический мониторинг, позволяющий оценить динамику чувствительности микроорганизмов в конкретных условиях, сформировать схемы эмпирической антимикробной терапии, провести необходимый объем мероприятий, в т.ч. противоэпидемических [1, 5].
Цель исследования
Целью данного исследования была оценка этиологической структуры и динамики чувствительности основных возбудителей нозокомиальных инфекций к антимикробным препаратам в ведущем многопрофильном учреждении Республики Карелия (ГБУЗ «Республиканская больница им. В.А. Баранова», Петрозаводск) за 2019–2022 гг.
Методы
Дизайн исследования
Проведен анализ всех микробиологических исследований, выполненных в 2019 г. и с июня 2021 по июнь 2022 г.
В 2019 г. исследования выполнялись в медицинской научно-исследовательской лаборатории Explana (Санкт-Петербург), в 2021–2022 гг. – в бактериологической лаборатории ГБУЗ «Республиканская инфекционная больница», в лаборатории «Ситилаб» (Санкт-Петербург), в лаборатории Explana. Использовался диско-диффузионный метод.
Условия проведения
В исследование вошли посевы, выполненные только в ГБУЗ «Республиканская больница им. В.А. Баранова» (Петрозаводск).
Продолжительность исследования
Сроки набора материала – 2019 г. и с июня 2021 г. по июнь 2022 г.
Анализ в подгруппах
Результаты исследований анализировались с учетом принадлежности пациентов к конкретному отделению, а также с учетом локализации инфекции. Сравнения результатов, полученных в 2019 г. и 2021–2022 гг., проводились между идентичными подгруппами.
Статистический анализ
Размер выборки предварительно не рассчитывался. Для статистического анализа данных использован пакет статистических программ Excel, 2013 (Microsoft Office, 2013; США). Методы представления данных – описательная статистика, группировка с последующим графическим представлением полученной информации.
Результаты
Объекты (участники) исследования
За 2019 г. выполнено 1993 исследования, в 2021–2022 гг. – 1228.
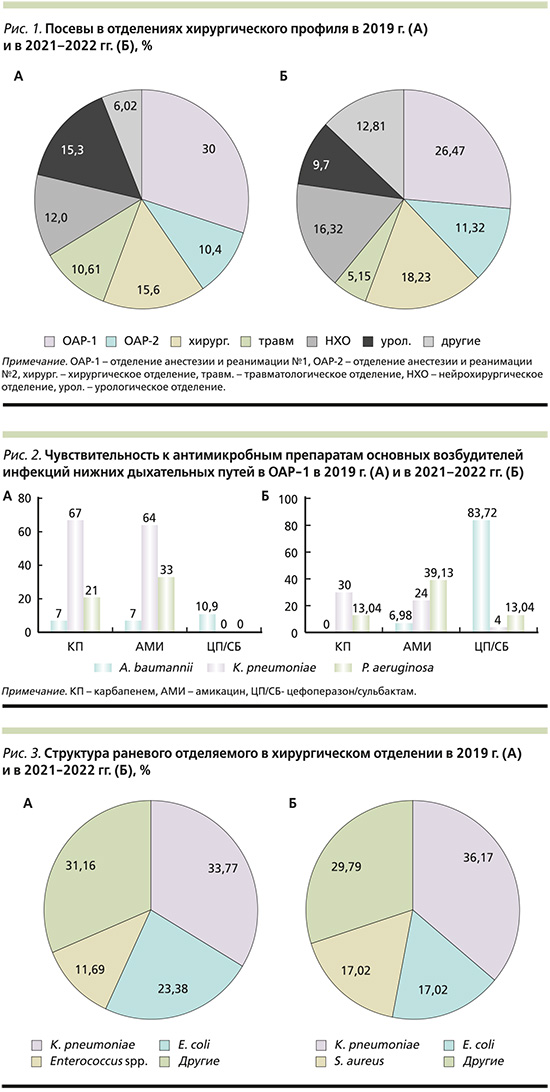
В ряде случаев выявлено 2 возбудителя одновременно. В 2019 и 2021–2022 гг. наибольшее количество посевов выполнено в отделениях хирургического профиля (58 и 56,19% соответственно), среди которых лидирует отделение анестезии и реанимации № 1 (рис. 1). Среди отделений терапевтического профиля в 2019 г. лидером по количеству микробиологических исследований стало отделение нарушений мозгового кровообращения (ОНМК), в 2021–2022 гг. – нефрологическое отделение.
Результаты исследования
В отделении анестезии и реанимации № 1 (ОАР-1) во все проанализированные годы преобладали анализы мокроты (54,83 и 71,06%), всегда–титр диагностически значимый (более 105). Во всех случаях микрофлора носила нозокомиальный характер, поводом для исследования служили ИВЛ-ассоциированная пневмония или гнойный эндобронхит с системной воспалительной реакцией. В качестве возбудителя наиболее часто выделялся A. baumannii (30,82 и 30,71%), K. pneumoniae (29,45 и 35,71%) и P. aeruginosa (17,12 и 16,43%). Относительно чувствительности к антибактериальным препаратам следует отметить, что микрофлора отличалась устойчивостью к большинству антибиотиков. Динамика чувствительности основных возбудителей инфекций нижних дыхательных путей отражена на рис. 2.
В хирургическом отделении оба года чаще исследовалось раневое отделяемое (70 и 75% исследований). В структуре раневого отделяемого преобладала K. pneumoniaе (33,77 и 36,17%) (рис. 3).

Удельный вес чувствительных штаммов возбудителей раневой инфекции в хирургическом отделении представлен на рис. 4.
В нейрохирургическом отделении преобладали посевы раневого отделяемого (26,72 и 31,53%), мокроты (28,44 и 29,73%) и мочи (36,20 и 26,42%).
Из раневого отделяемого в 2019 г. выделены K. pneumoniae (31,25%), чувствительная к меропенему и амикацину во всех случаях, Enterococcus spp. (25%), во всех случаях чувствительный только к ванкомицину и линезолиду, S. aureus (18,75%), во всех случаях чувствительный к цефокситину.
Раневое отделяемое в 2021–2022 гг.: S. aureus (45,16%), в 50% чувствителен к цефокситину, K. pneumoniae (16,13%, из них 20% штаммов чувствительны к цефотаксиму, цефепиму, ципрофлоксацину, 60% – к меропенему, 40% – к амикацину).
Следует отметить возрастание удельного веса золотистого стафилококка в качестве возбудителя раневой инфекции с одновременным снижением чувствительности к цефокситину (соответственно, рост числа метициллин-резистентных штаммов).
В качестве возбудителя инфекции нижних дыхательных путей в нейрохирургическом отделении в оба периода преобладали K. pneumoniaе (40 и 45,45%), P. aeruginosa (20 и 10%) и A. baumannii (16,67 и 15,15%). Чувствительность возбудителей к антимикробным препаратам отражена на рис. 5.
Следует отметить закономерное снижение восприимчивости всех видов возбудителей к антимикробным препаратам.
В качестве возбудителей инфекции мочевыводящих путей в 2019 г. выделены Escherichia coli (E. coli) (37,50%), K. pneumoniaе (28,12%), Enterococcus spp. (18,75%) и Proteus mirabilis (P. mirabilis) (9,37%). В 2021–2022 гг.: E. coli (20%), K. pneumoniaе (28%) и P. mirabilis (12%). Чувствительность микрофлоры отражена на рис. 6.
Обсуждение
Резюме основного результата исследования
В отделениях хирургического профиля в качестве возбудителей нозокомиальных инфекций преобладает грамотрицательная микрофлора. Отмечено значимое снижение чувствительности всех видов возбудителей к антимикробным препаратам, что особенно заметно в отделении реанимации.
Обсуждение основного результата исследования
В качестве возбудителей инфекций нижних дыхательных путей в ОАР-1 наиболее часто выделялись A. baumannii, K. pneumoniae и P. aeruginosa. Микрофлора отличалась устойчивостью к большинству антибиотиков. Значимо снизилась чувствительность A. baumanii и K. pneumoniae к карбапенемам и амикацину ввиду частого их использования в качестве стартовой терапии пациентов в критическом состоянии. Более всего негативная динамика заметна на примере карбапенемов, длительность терапии которыми не лимитирована нежелательными эффектами и необходимостью обязательного лекарственного мониторинга. Цефоперазон/сульбактам сохраняет эффективность ввиду более редкого назначения по причине наличия гипокоагуляции у пациентов с синдромом диссеминированного внутрисосудистого свертывания на фоне сепсиса, амикацин – из-за ограничения длительности использования по причине отсутствия возможности проводить лекарственный мониторинг.
В хирургическом отделении чаще исследовалось раневое отделяемое, в структуре которого преобладала K. pneumoniaе. Обращает на себя внимание снижение ее чувствительности к меропенему и амикацину, что объяснимо тесным взаимодействием хирургического отделения с отделением реанимации № 1, частым назначением данных препаратов у тяжелых пациентов.
В нейрохирургическом отделении следует отметить возрастание удельного веса золотистого стафилококка в качестве возбудителя раневой инфекции с одновременным снижением чувствительности к цефокситину (соответственно, рост метициллин-резистентных штаммов), а также снижение удельного веса K. pneumoniaе с одновременной редукцией восприимчивости к меропенему и амикацину. Обращает на себя внимание повышение удельного веса K. pneumoniaе в структуре основных возбудителей инфекций мочевыводящих путей и снижение ее чувствительности к меропенему, что, наиболее вероятно, обусловлено частым применением данного препарата.
Ограничения исследования
Несмотря на большой объем проанализированной информации, результаты проведенного исследования следует трактовать с осторожностью по причине ретроспективного характера исследования, проведения исследований на базе разных микробиологических лабораторий, недостаточной статистической мощности вследствие небольшого объема выборки пациентов с инфекциями отдельных локализаций в каждом отдельном подразделении стационара.
Заключение
Проблема АР приобретает все большую актуальность во всем мире, о чем свидетельствуют многочисленные пуб-ликации на сайте Всемирной организации здравоохранения (информационные бюллетени о данной проблеме, отчеты о состоянии чувствительности к антибиотикам и их использовании в отдельных странах, объявление о Всемирной неделе правильного использования противомикробных препаратов). Правительством Российской Федерации в 2017 г. утверждена Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 г. Профессиональные сообщества публикуют клинические рекомендации, методические указания по данной проблематике. В большинстве регионов Российской Федерации ведется микробиологический мониторинг. В связи с этим большое значение имеют локальные микробиологические данные, которые не отражены в онлайн-платформе анализа данных резистентности к антимикробным препаратам в России по организационным причинам.
Согласно данным AMRmap, наши результаты в целом соответствуют таковым в Северо-Западном федеральном округе, полученным за последние доступные анализу 2018–2020 гг. у лиц старше 18 лет. При этом чувствительность основных возбудителей более близка к таковой у микроорганизмов в стационарах Санкт-Петербурга. Локальный микробиологический мониторинг важен как для отдельных лечебно-профилактических учреждений, так и для региона в целом. Наличие современных локальных микробиологических лабораторий с возможностью типирования карбапенемаз позволит своевременно назначать этиотропную терапию инфекций, вызванных полирезистентными возбудителями, профилактируя таким образом распространение устойчивости к антимикробным препаратам, а также грамотно формировать локальный антимикробный формуляр и проводить необходимые противоэпидемические мероприятия.
Вклад авторов. Концепция и дизайн исследования – Рябкова Н.Л. Сбор и обработка материала – Москвина Е.Б. Статистическая обработка данных – Рябкова Н.Л. Написание текста – Рябкова Н.Л. Редактирование – Рябкова Н.Л.



